miR-16 在冠心病患者血清中表达及功能分析
靳 星,李文祎,马 蓉
(1.隆尧县医院检验科,河北 邢台 055350;2.北京大学人民医院 检验科,北京 100044)
微小RNA(microRNA, miR)是属于小分子非编码RNA的一种,它们可以通过与靶基因的3'UTR结合抑制其表达。近来研究表明,miR的表达变化与多种疾病相关。在冠心病中,也存在多种上调或下调性变化的miR,它们共同参与该病的调控过程。miR-16是一种广泛表达的miR,血浆中也可检测到该miR的表达。研究证实,miR-16的表达在多种疾病,如肿瘤、心肌肥厚、脑中风等[1-3]。在心肌肥厚过程中,miR-16的表达下调,并因此促进靶基因细胞周期蛋白(cyclin)D1、D2、E1表达的上调,加重心肌肥厚[3]。然而,miR-16在血管平滑肌中的作用尚不清楚,本研究分别通过检测冠心病患者血浆miR-16的表达变化,探讨该miR与冠心病的关系,并通过研究该miR对血管平滑肌增殖的影响初步探讨该miR的作用机制,旨在为冠心病的诊断、治疗提供实验依据。
1 资料与方法
1.1研究对象 随机选取在2016年9月至2017年10月于隆尧县医院心内科住院并经冠状动脉造影确诊为冠心病患者43例,男30例,女13例,年龄(65.8±11.3)岁;对照组为同期经心电图、超声心动图等检测排除心脏疾病,来我院体检的健康人49例,,男23例,女26例,年龄(60.4±12.8)岁。
1.2样品采集 各组研究对象均抽取清晨空腹外周静脉血4 ml,并收集于EDTA-K2抗凝管中。采血后,迅速在4 ℃下以3 000 r/min离心,收集上层血浆,分装于冻存管中,保存于-80 ℃冰箱保存备用。
1.3血浆miR提取及检测 采用mirVana血浆miR提取试剂盒,按照使用说明加入线虫Cel-miR-39类似物作为内参,依据试剂盒的使用说明提取血浆总RNA。用NanoDrop检测RNA浓度,经过稀释、浓度矫正后采用ABI公司microRNA逆转录试剂盒将各样品中miR-16和Cel-miR-39进行逆转录反应。采用TaqMan探针实时荧光定量PCR法检测各样品中miR-16及Cel-miR-39的Ct值,以miR-16与Cel-miR-39的相对Ct值表示miR-16在各样品中的相对表达强度。按对照组miR-16的相对表达强度进行归一化处理,观察各组相对于对照组血浆miR-16的表达变化。
1.4细胞处理与活力检测 将人脐静脉血管平滑肌细胞传代、细胞计数,并稀释至100 000个细胞/ml的密度,迅速接种于96孔板,每孔100 μl细胞悬液。待细胞贴壁后将细胞培养液血清浓度降至0.1%,以同步化细胞周期。血清饥饿24 h后采用Lipofectamin 3000试剂分别将miR-16类似物及其阴性对照转染平滑肌细胞。转染后24 h在相应的细胞中加入PDGF-BB(终浓度10 nmol/L)处理。转染后48 h,观察细胞状态,并在每个孔中加入10 μl的CCK-8试剂,将96孔板再次放入细胞培养箱中孵育2 h,取出观察细胞悬液颜色变化,放置于酶标仪上并检测450 nm处吸光度数值。各组的吸光度数值经过归一化处理后分析其变化情况,并以此表示各组细胞的细胞活力变化。
1.5靶基因检测 将人脐静脉平滑肌细胞接种于12孔板,采用Lipofectamin 3000试剂转染细胞,48 h后收集各组细胞,并采用Western印迹检测各组细胞中cyclin D1、cyclin D2和cyclin E1的表达强度。具体步骤如下:将各组细胞加入RIPA裂解液,低温静置、震荡,充分裂解,并在4 ℃条件下以12 000 r/min进行离心。取上清液转移至新的离心管中,采用BCA法进行蛋白定量。定量后,采用RIPA裂解液稀释至2 μg/μl的工作液,加入5X上样缓冲液之后,在100 ℃中加热煮沸5 min。之后,迅速置于冰上降温,短暂离心后将各组样品加入到SDS-PAGE胶中进行电泳分离(浓缩胶80 V 30 min,分离胶120 V 60 min)。之后,将胶取出,置于电转仪上进行恒流电转膜(300 mA, 120 min)。电转结束后,取出NC膜,采用丽春红工作液染色,并采用5%的脱脂牛奶室温封闭1 h。封闭结束后,采用含有抗cyclinD1、cyclin D2、cyclin E1及GAPDH的一抗稀释液(1∶1 000)于4 ℃摇床上缓慢孵育过夜。次日,采用TBST溶液漂洗4次,并用HRP标记的山羊抗兔二抗室温孵育1 h。采用TBST溶液再次漂洗4次后加入化学发光底物显色。通过Quantity One软件拍摄、记录图像并扫描各条带的灰度值。以GAPDH为内参,以上述蛋白与GAPDH灰度的比值计算其相对表达量。

2 结 果
2.1冠心病患者血浆miR-16水平下调 为探讨miR-16在冠心病患者中的变化,采用实时荧光定量PCR法检测血浆标本中该miR的变化。血浆miR-16的表达在冠心病患者中显著下调(1.00±0.42 vs 0.75±0.23,P<0.05),表明miR-16表达的下调可能与冠心病有关, 见图1。

图1 血浆 miR-16 的表达强度 *与对照组比较P<0.05
2.2miR-16 对血管平滑肌增殖的调控作用 为探讨 miR-16 对血管平滑肌增殖的作用,采用 CCK-8 法检测过表达 miR-16 后血管平滑肌细胞增殖的变化。结果发现,在转染 miR-16 类似物48 h后,血管平滑肌细胞的增殖活力显著下降,是对照组的23.1%,见图 2。在此基础上采用血小板源生生长因子 PDGF-BB(50 ng/L)刺激血管平滑肌增殖,观察到过表达 miR-16 类似物的血管平滑肌细胞增殖活力 是阴性对照组的53.8%,表明过表达 miR-16 后可部分对抗 PDGF-BB 诱导的细胞增殖,见 图 2。采用Western印迹对其靶基因cyclin D1、D2及E1进行检测,发现过表达miR-16后可显著降低上述基因的表达,见图3。
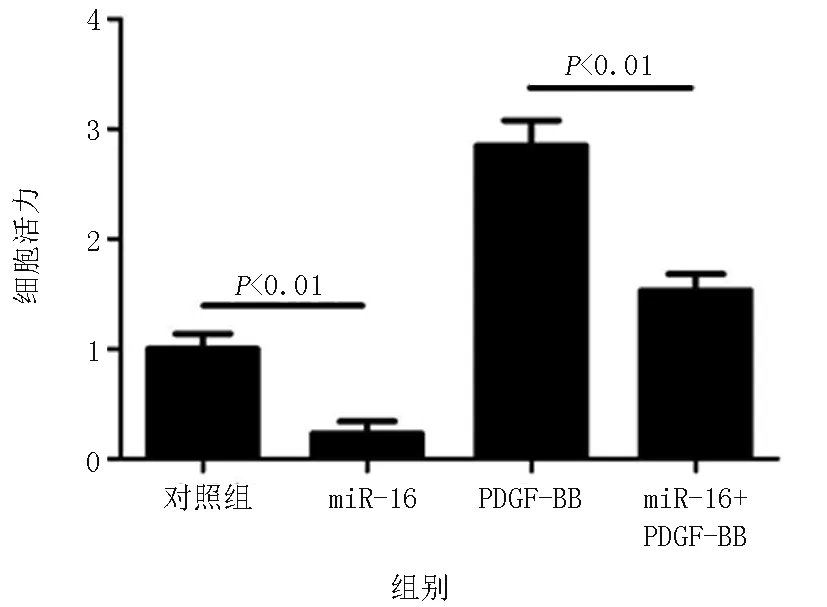
图2 miR-16 对细胞增殖活力的影响 采用CCK-8检测细胞的增殖活力
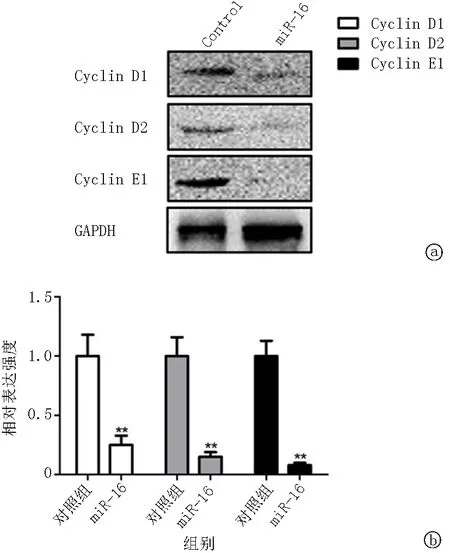
图3 miR-16 对细胞周期蛋白表达的调控作用 采用蛋白印迹检测过表达miR-16后血管平滑肌细胞中cyclin D1、D2及E1表达的变化(a)。进行灰度扫描后以GAPDH为内参,计算各组相对表达强度(b)。**与对照组比较P<0.01
3 讨 论
miR是一种细胞内的小分子非编码RNA,其长度大约为21~23 nt。目前的研究发现,miR参与了胞内多种生物学过程的调控,如细胞周期及增殖、凋亡、自噬等[4-8]。初始的miR转录产物较长,经胞内酶切处理后形成成熟体的miR。这些miR可与其靶基因的3'UTR结合进而影响后者的表达。目前研究证实,miR主要发挥抑制靶基因表达的功能,在哺乳动物细胞中,3'UTR结合miR后主要通过抑制该靶基因的翻译而影响其表达。miR是一种小分子调控分子,因此其可以较容易的从细胞内转移至胞外以及循环血中。相较于大多数RNA分子,miR由于分子量较小而具有较高的稳定性,在转移至循环血中时可以在较长时间稳定存在。因此,循环血中的miR就有可能被远隔部位的细胞重新摄取,并转运至细胞内发挥相应的生物学效应。基于该特性,循环血miR的检测为疾病的诊断以及疾病发病的分子机制研究提供了新方法[9]。
目前研究表明,多种疾病如心血管疾病、肿瘤等,其患者循环血中特定类型的miR表达均可呈现显著变化[10-16]。本研究发现,冠心病患者血浆miR-16表达水平呈显著下调趋势,由此提示该miR很可能在冠心病发病及进展过程中起到重要的调控作用。
miR-16是一种调控细胞周期的小分子非编码RNA,其高表达可显著抑制多种cyclins的表达,进而抑制细胞增殖[1, 17-20]。研究表明,在肿瘤细胞中,miR-16可负向调控cyclin D1、cyclin D2及cyclin E1的表达[3]。我们的研究也发现,在血管平滑肌细胞中过表达miR-16可显著抑制该细胞增殖,并显著下调cyclin D1、D2及cyclin E1的表达强度。血管平滑肌细胞过度增殖是冠状动脉狭窄的病理机制之一。当血管内皮受到氧化应激、炎症损伤时,其功能紊乱,同时导致血管平滑肌细胞的表型转换,即由收缩型转变为分泌型。分泌型的血管平滑肌细胞逐渐失去其原有的形态和功能,获得细胞增殖、迁移、合成分泌的能力。发生表型转换后的血管平滑肌细胞合成细胞外基质成分的能力增加,进而加重血管的重塑和管腔狭窄。在本研究中,我们不仅发现在冠心病患者循环血中miR-16出现显著降低,还发现该miR过表达后抑制了血管平滑肌细胞的增殖以及细胞周期蛋白cyclin D1、cyclin D2及cyclin E1的表达下调。由此提示,该miR很可能发挥了抑制冠心病的作用。通过分子生物学手段阻断血管平滑肌细胞的增殖很可能是治疗冠心病的有效策略。我们的研究表明, 过表达miR-16 后可显著阻断血管平滑肌细胞增殖,该过程很可能是通过靶向抑制细胞周期蛋白 cyclin D1、cyclin D2 及 cyclin E1所致。然而,本研究还存在一些局限性:首先,本研究中病例数目较少,需要在更大规模的人群中做相关分析;其次,本研究尚未在动物模型上做相关验证,尚不能完全阐明miR-16对冠心病发展以及血管平滑肌细胞增殖的直接关系。因此,关于miR-16与冠心病之间的分子机制仍是今后研究的重点。
综上所述,miR-16 是一种冠心病及血管平滑肌细胞增殖相关 miR-16,其表达在冠心病患者中下调。该 miR可通过抑制多种细胞周期调控蛋白抑制血管平滑肌细胞的增殖,miR-16 很可能是冠心病防治的潜在靶点。

