血清IgG4水平对类风湿关节炎疾病活动度及共病发生的临床意义
王子铭,周 莹,李晓军,虞 伟
0 引 言
类风湿关节炎(rheumatoid arthritis,RA)是常见的炎症性自身免疫疾病,发病机制尚未明确。RA患者随病情进展可出现局部或全身的骨质破坏[1];同时RA多系统受累使其生活质量降低,乃至病死率升高[2-3]。随着对IgG4相关疾病的深入研究,血清IgG4因其特异性较低而失去核心地位[4];但在其他疾病中,尤其自身免疫疾病中的升高逐步引起医务工作者的重视。有研究发现IgG4可能与RA疾病活动相关[7];但也有研究认为,血清IgG4以抗炎分子和致病因子的双重矛盾身份而引发疾病[5-6]。目前国内外对血清IgG4与疾病活动关系的研究较少,关于血清IgG4在其合并系统疾病时的临床意义亦鲜见有报道。本研究基于临床检验数据验证IgG4与RA疾病活动关系的同时,进一步探讨其在RA共病(多系统受累)中的临床意义,以期为探讨RA发病机制及IgG4在RA疾病诊疗中的作用提供参考。
1 资料与方法
1.1研究对象研究纳入2013年9月至2017年5月在东部战区总医院确诊为类风湿关节炎患者123例为RA组。患者平均(54.2±15.1)岁,其中女性93例(75.6%),中位病程72个月。所有患者均满足2010ACR/EULAR的诊断标准[8]。按照年龄(±3)、性别1∶1匹配123例健康对照组和123例疾病对照组。健康对照组为同期体检正常,且排除明显自身免疫倾向的健康者;疾病对照组选自同期确诊的其他自身免疫病,包括干燥综合征患者(46例)、系统性红斑狼疮患者(25例)、皮肌炎患者(46例)、未分化结缔组织病患者(6例),均符合相应的疾病诊断标准[9-12]。本研究经东部战区总医院伦理委员会审核批准(批件号:2015NZGKJ-094),所有研究对象均签署知情同意书。
1.2研究方法收集患者的临床资料,包括性别、年龄、共病(多系统受累)、疾病活动指数(disease activity score 28 joints C-reactive protein, DAS28-CRP)、压痛关节数(tender joint count,TJC)、肿胀关节数(swollen joint count, SJC)等;测定实验室检验指标,包括血常规、血沉(ESR)、C反应蛋白(CRP)、外周血补体 C3、C4、抗CCP抗体(A-CCP)、类风湿因子(RF)、体液免疫指标IgA、IgG、IgE、IgM、IgG4等。
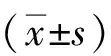
2 结 果
2.1一般资料比较RA组、健康对照组及疾病对照组血清IgG4水平差异均有统计学意义(P<0.05),见图1,表1。RA组、健康对照组及疾病对照组中,血清IgG4相应的升高率依次为:18例(14.6%)、6例(4.9%)及5例(4.1%);IgG4/IgG比值升高率依次为22(17.9%)、6例(4.9%)、6例(4.9%),差异均有统计学意义(P<0.05)。
2.2IgG4与RA疾病活动的关系IgG4水平在不同DAS28-CRP的RA患者间差异无统计学意义(χ2=1.480,P=0.687)。高IgG4患者较正常者在反映疾病活动的红细胞分布宽度(RDW)、血小板计数(PLT)、血小板/淋巴细胞(PLR)、C3、C4、CRP、ESR、DAS28-CRP、RF、A-CCP等血清学指标差异均无统计学意义(P>0.05)。进一步Spearman相关分析示,血清IgG4水平与C3、C4、CRP、ESR、RDW、PLT、PLR、DAS28-CRP、RF、A-CCP均无显著相关性(P>0.05)。见图2。

*P<0.05、**P<0.01

表 1 入组对象基线特征表

图 2 RA患者IgG4与各指标的相关性
2.3RA合并骨骼肌肉系统疾病的单因素分析RA合并不同临床特征患者(除外合并骨骼肌肉系统疾病)较不合并者IgG4水平差异无统计学意义(P>0.05),见表2。在68例(55.3%)合并骨骼肌肉系统疾病RA患者中,骨质疏松或骨量减少患者63例(92.6%)、骨关节炎患者4例(5.9%)、股骨头坏死患者3例(4.4%)、行股骨头置换术1例(1.5%)。合并骨骼肌肉系统RA患者平均年龄显著高于不合并者(P<0.05);同时伴有病程长以及高IgG4、IgE、RF、CRP、PLT、DAS28-CRP、循环系统受累及消化系统受累发生率等特点(P<0.05)。见表3。

表 2 本组RA患者根据临床特征和疾病活动度不同分组后的 IgG4 水平比较[M(P25,P75)]

表 3 RA合并骨骼肌肉系统疾病和不合并患者比较
2.4RA 合并骨骼肌肉系统疾病的多因素logistic回归分析logistic回归分析示,年龄≥55岁、病程≥72个月及IgG4≥1832 mg/L是RA合并骨骼肌肉系统疾病受累的独立危险因素(P<0.05),见表4。

表 4 影响RA患者并发骨骼肌肉系统疾病的二元logistic回归分析结果
3 讨 论
RA患者的达标治疗与疾病活动及共病状况密切相关[13]。因此,补充疾病活动指标和控制RA共病的危险因素不仅可提高患者的生活质量,而且也满足精准治疗和个性化治疗的需求。当前关于血清IgG4在RA中的作用研究存在2种观点:一方面,IgG4无法通过经典途径激活补体,并通过Fc-Fc结合作用封闭其他免疫球蛋白发挥免疫效应,从而发挥抗炎作用;另一方面关于IgG4在RA中的致病作用,即独特的半分子交换可诱导炎症反应,且自身抗原长时间刺激导致IgG4免疫应答占主导地位[5-6]。因此,对血清IgG4的监测可能会为RA的防治提供新的临床切入点。
本研究基于匹配年龄性别合适的健康对照组,以期确定最适合的参考范围上限值。IgG4单侧95%医学参考范围1832 mg/L,以其作为上限值分高值组和正常组,常规反应疾病活动指标,包括CRP、ESR、RDW、MPV、PLT、PLR、DAS28-CRP均差异无统计学意义,相关性分析也提示与疾病活动无关;且不同疾病活动度患者IgG4水平差异亦无统计学意义,提示血清IgG4可能无法反映RA疾病活动,这与Chen等[7]的研究结果不同。推测原因在于以下方面:首先纳入人群的基础特征不同;其次,Chen等[7]研究中IgG4升高沿用国际学者推荐的1350 mg/L为上限,此上限值未充分考虑到因年龄跨度不同,可引发IgG4有效参考范围值存在的差异,其升高率(46%)远超本研究及以往报告范围(14.6%、10.7%、12.9%)[14-15]。
在探讨RA合并不同系统受累的IgG4水平时,发现在合并骨骼肌肉系统受累RA中明显升高,进一步分析合并组和不合并组的实验室指标和临床指标差异,并纳入二元logistic回归发现,除年龄、病程常规认可的指标外,IgG4的OR值为4.65(P=0.041),故考虑为RA患者合并骨骼肌肉系统受累的独立风险因素[16]。在本研究中,90%以上的合并骨骼肌肉系统受累RA患者出现骨质疏松及骨质减少。RA是继发性骨质疏松的一个重要因素,且RA合并骨质疏松患者的骨折风险增加,致残率升高[17]。既往文献报道RA患者骨质疏松的发病率范围波动于30%~50%[18]。骨丢失在RA局部和全身的发病机制主要涉及持续性炎症状态、细胞因子的释放和自身抗体的产生。促炎因子可直接或间接加速骨吸收,抑制成骨细胞发育,破坏骨平衡,导致骨密度降低[19]。此外,Wnt信号通路抑制因子DKK-1下调骨保护素表达,使其竞争性抑制核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)与RANK结合作用减弱,破骨细胞激活亢进促进骨破坏[20];且抗DKK-1抗体在类风湿关节炎骨重塑模型小鼠中发挥积极作用[21]。当前关于IgG4在RA中机制尚不明确,但在RA和IgG4相关疾病中均发现细胞因子IL-10升高[22]。后者可由IL-6诱导巨噬细胞释放;同时IL-6可通过IL-21诱导B淋巴细胞分化为产生免疫球蛋白的浆细胞。值得注意的是,在炎症性肠病引起的继发性骨质疏松中,同样有IL-6、IL-4、TNF-α的升高[23]。综上,基于炎性细胞因子(如IL-6)在免疫介导性疾病中的桥梁作用,关于IgG4升高是否为RA、骨质疏松单独作用或是两者协同作用的副产物仍需进一步探讨。同样的证据来自于本研究IgG4/IgG结果,其比值水平也呈现出与RA合并骨骼肌肉系统一定相关性,故推测在该类共病患者的RA人群中存在有一定程度的IgG4类别转换优势,并可能在疾病发生发展过程中起作用。
本项研究发现,血清IgG4升高在RA患者中占有一定比例,初步结果表明为RA合并骨骼肌肉系统受累的独立危险因子。但IgG4水平与RA疾病活动无相关性,此结论与其他学者结果相矛盾。本研究存在一定缺陷:首先为回顾性、小样本、单中心研究;其次为研究未纳入患者药物治疗情况,未来有待进一步扩充数据进行验证。

