内镜在胃肠道疾病相关缺铁性贫血中的诊断作用
何雨欣,陈卫昌
0 引 言
世界卫生组织将贫血定义为红细胞数量减少或其供氧能力不足以满足生理需要的状况,生理需求因年龄、性别、海拔、吸烟和怀孕状况而异[1]。女性血红蛋白(Hb)<120 g/L、男性<130 g/L时可诊断为贫血[2]。其中全世界缺铁性贫血累及约20亿人,已成为世界性的重要健康问题。世界范围内一半的贫血病例病因为缺铁性贫血[3]。缺铁性贫血患者常有疲劳、脸色苍白、头晕、昏睡、指甲质地脆、皮肤干燥等表现。铁的吸收主要在十二指肠完成;由于人体内缺乏铁排泄的生理机制,机体内铁的稳态是肠道铁的吸收与机体需要的相对平衡状态。铁缺乏(iron deficiency,ID)/缺铁性贫血(iron deficiency anemia,IDA)的病因包括生理及病理2个方面:生理性为铁的需要增加及摄入不足;病理性包括吸收不良、慢性失血、药物相关及TMPRSS6基因突变所致的铁难治性IDA[2]。
导致缺铁性贫血常见的消化道病理因素包括以下方面:①消化道出血,如非甾体抗炎药的使用、消化系统良恶性肿瘤、消化性溃疡、血管性病变、肠道寄生虫感染等;②吸收不良,如胃肠切除术后、幽门螺杆菌感染、乳糜泻、炎症性肠病、长期使用质子泵抑制剂等[1]。文中介绍内镜在胃肠道疾病相关缺铁性贫血的诊断价值。
1 缺铁性贫血的诊断
若Hb低于正常范围,应对贫血的病因进行详细检查。包括红细胞分布宽度(red cell volume distribution width,RDW)、平均红细胞体积(mean corpuscular volume,MCV)、网织红细胞计数及分类血细胞计数[4]。IDA的国内诊断标准(符合以下第1条和第2~9条中任2条或以上可诊断IDA):①小细胞低色素性贫血,即男性Hb<120 g/L、女性Hb<110 g/L,红细胞形态呈低色素性表现;②有明确的缺铁病因和临床表现;③血清铁蛋白< 14 μg/L;④血清铁<8.95 μmol/L,总铁结合力> 64.44 μmol/L;⑤运铁蛋白饱和度<0.15;⑥骨髓铁染色显示骨髓小粒可染铁消失,铁粒幼细胞< 15%;⑦红细胞游离原卟啉>0.9 μmol/L ,血液锌原卟啉>0.9 μmol/L,或FEP/Hb>4.5 μg/g;⑧血清可溶性运铁蛋白受体浓度>26.5 nmol/L(2.25 mg/L);⑨铁治疗有效[2]。
2 内镜检查的作用
目前对于需要进行胃肠道检查的贫血水平尚未达成共识。英国国家健康和临床卓越研究所转诊指南(The National Institute for Health and Care Excellence,NICE)建议:男性Hb<11 g/dL或绝经期女性Hb<10 g/dL为疑似下消化道肿瘤的临界值[4]。然而,也有研究认为上述分界值可能会遗漏部分结直肠癌患者,特别是男性[5]。因此,英国胃肠病学会建议所有男性及50岁以后(或绝经后)女性IDA患者均进行胃肠道检查[1]。
在因消化道出血导致IDA的绝经前妇女中,病变主要来源于上消化道。在该群体中,癌症的患病率较低(0~6%),且多见于40岁以上的患者[6]。在患有IDA的绝经后女性与成年男性中,胃肠镜检查显示上消化道病变占7%~72%,下消化道病变占7%~58%,复合病变者占0~29%[7]。成人IDA诊断流程见图1。
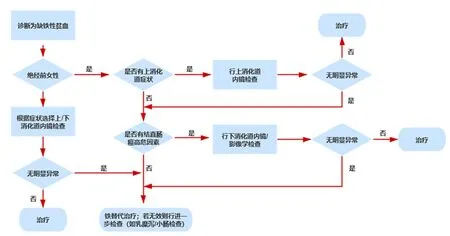
图 1 成人缺铁性贫血的诊断流程
2.1上消化道内镜超过1/3的IDA患者出血来源位于上消化道,且多为良性病变[8]。根据NICE对疑似上消化道肿瘤的转诊指南,任何具有上消化道症状的绝经前IDA女性患者应考虑进行上消化道内镜检查[9]。所有确诊为IDA的绝经后女性患者和所有男性患者,除非能够明确失血并非来自胃肠道,否则均应考虑上消化道和下消化道内镜检查[1]。绝经前女性发生IDA通常是因为月经失血过多(占所有女性的9%~14%)[10]或饮食摄入不足[11]。若此类患者妇科检查无明显异常,且对铁替代疗法(iron replacement therapy,IRT)未见反应,则应首先进行上消化道内镜检查,以排除胃或十二指肠病变所致的隐匿性出血[12]。在患有IDA的绝经前女性中,超过30%的患者存在上消化道糜烂性病变,半数以上由幽门螺杆菌(Helicobacter pylori,H.pylori)感染或使用非甾体抗炎药引起,而上消化道肿瘤则较罕见(0~3%)。
上消化道内镜检查中常见的病变包括消化性溃疡、急性糜烂性出血性胃炎、严重糜烂性食管炎、动静脉畸形及肿瘤[13]。约10%的上消化道内镜在第一次检查时可能出现漏诊。常见的漏诊病变包括上消化道裂孔疝或浅表的血管扩张[14]。重复进行上消化道内镜检查时,应仔细检查已知相对难以观察的区域,包括胃角切迹、胃小弯上侧及十二指肠球部前壁。将食管炎、食管糜烂、Barrett食管和较小的消化性溃疡病认作IDA的病因需谨慎,必须先进行下消化道内镜检查以排除下消化道相关病变[1]。即使上消化道内镜表现为阴性,也无法排除导致IDA的非出血性疾病,如萎缩性胃炎、H. pylori感染、乳糜泻等[9, 15]。
在铁难治性或原因不明的IDA患者中,约27%患有自身免疫性萎缩性胃炎[8-16]。铁在消化道的吸收有赖于胃酸将Fe3+化为可吸收的Fe2+。自身免疫性萎缩性胃炎表现为高胃泌素血症和抗胃壁细胞抗体(anti-parietal antibodies,APCA)阳性。胃酸分泌减少会影响饮食中铁和钴胺的吸收,导致IDA的发生。
在原因不明的口服铁难治性IDA患者中,超过50%的患者有活动性H.pylori感染。此类患者中64%~75%通过根除H.pylori得到永久治愈[15]。H.pylori感染可能通过抗原模拟触发针对胃壁细胞的自身免疫过程。铁是H.pylori必不可少的生长因子。H.pylori可能通过与宿主竞争铁而导致机体铁缺乏。此外,胃体黏膜炎症相关的胃酸降低可能会影响铁的溶解和吸收[16]。
在不明原因的IDA患者中,约5%存在乳糜泻[8]。乳糜泻典型的胃肠道症状包括腹泻、脂肪泻、体重减轻、腹胀、腹痛等;非胃肠道表现包括缺铁性贫血、关节炎、代谢性骨病等。贫血是乳糜泻最常见的表现之一。12%~69%的成人乳糜泻患者有贫血表现[12]。乳糜泻的血清学筛查包括IgA-抗谷氨酰胺转胺酶或IgG-抗去酰胺醇溶蛋白多肽。十二指肠活检对于成人乳糜泻的诊断仍必不可少,无法被血清学取代[17]。活检病理示上皮内淋巴细胞增多,隐窝增生,绒毛萎缩。十二指肠球部活检1~2次,十二指肠远端活检至少4次可确诊乳糜泻[18-19]。如乳糜泻诊断明确,通常无需行进一步的胃肠道检查[1]。
鉴于上述,对于肉眼内镜表现为阴性的IDA患者,建议进行随机的胃窦和胃底活检[8]。若有乳糜泻相关症状,则应进行十二指肠活检。并且对于上下消化道内镜检查结果均为阴性的复发性IDA患者,应进行H. pylori检测。若为阳性则应行根除治疗[1, 20-21]。
2.2下消化道内镜下消化道出血是男性和绝经后女性发生IDA常见的原因。指南一致推荐所有≥50岁的IDA和便血患者进行下消化道内镜检查[1, 7, 22-23]。英国胃肠病学会指南建议:对于<50岁(或绝经前女性),若有下腹部症状、有结直肠癌家族史,或持续性IDA(铁替代治疗无效者),应进行肠镜检查[1]。同时,由于下消化道癌症主要发生在40岁以上的患者中,故有研究者建议对年龄>50岁的IDA患者进行胃镜及肠镜检查[24]。如前所述,因年龄>50岁的患者结直肠癌患病率增高,均超过50岁的IDA患者应优先考虑进行肠镜检查,但内窥镜检查的顺序首先应以患者的症状为指导[25]。
下消化道内镜发现的常见病变包括:结直肠癌(0~34%)、腺瘤(1%~27%)、炎症性肠病(0.4%~10%)和血管发育不良(0~7%)[7]。对>1 cm的结肠息肉切除2~3个月后,IDA往往可以缓解;而<5 mm的息肉切除后IDA通常不会有改善[26]。因此,将<1 cm的结肠息肉认作是导致IDA的病因需十分慎重。鉴于上述,息肉切除术后应对IDA患者进行持续随访[27]。由痔疮出血引起的IDA发病率为每年0.5/10万,不足IDA所有病因的1%。多数肛门或直肠出血的患者表现为间歇性的少量便血[22]。因此,在将IDA归因于肛周出血前,建议应进行完整的下消化道内镜检查。若第一次内镜检查的结果为阴性,或权衡风险后认为第一次发现的阳性结果不能解释出血的真正原因,建议进行2次检查。
在结肠镜检查禁忌的情况下,影像学检查可作为替代方案。对于>10 mm的病灶,CT造影的敏感性超过90%[28]。与肠镜相比,CT结肠造影(CT colonography,CTC)具有非侵入性、无需肠道准备、可检查消化道外病变等优点,且CTC并发症发生率较低[13, 29]。然而,CTC可能会遗漏血管病变。肠镜在识别诸如血管发育不良和非甾体抗炎药所致损伤等浅表病理时,较CTC更有优势,并可直接对病变进行活检和治疗[13]。
2.3胶囊内镜及小肠镜消化道出血的患者中,5%~10%患者无法通过标准的内镜检查明确病因。在这些患者中,约75%出血来源于小肠[30]。对于<40岁的IDA患者,小肠出血的常见病因包括炎症性肠病、Dieulafoy病变、小肠肿瘤(如间质细胞瘤、淋巴瘤、类癌、腺癌或息肉)、梅克尔憩室。在>40岁的IDA患者中,小肠血管扩张、非甾体抗炎药相关糜烂或溃疡等则更为常见。与<40岁的患者相比,老年患者小肠良恶性肿瘤所致出血的比例较小。小肠血管扩张的危险因素包括高龄、主动脉狭窄、慢性肾功能衰竭、左心室辅助装置和其他遗传性疾病。更少见的小肠出血的病因包括过敏性紫癜、小肠静脉曲张和(或)门脉高压性肠病、遗传性息肉病综合征、胆道出血、胰腺出血和主动脉肠瘘等[30]。
对于有反复不明原因消化道出血且第一次标准内镜(已进行过胃镜及肠镜)检查后未发现病变的患者,在对小肠进行检查之前,可针对患者症状,选择进行二次胃镜/肠镜检查[31]。若二次标准内镜检查后仍未能明确消化道出血来源,胶囊内镜(video capsule endoscopy,VCE)可作为小肠检查的第一线方案[30]。
随着胶囊内镜和小肠镜的出现,小肠横断面成像和核扫描在评估不明原因消化道出血中的作用已经较前下降。若无VCE相关禁忌症,应在小肠镜检查前进行VCE检查。在大出血或存在VCE禁忌的情况下,推荐初始即进行小肠镜检查[32]。比较各种诊断方法(推进式小肠镜、双气囊小肠镜、单气囊小肠镜、螺旋管式小肠镜、胶囊内镜、血管造影)的成本效益分析发现,双气囊小肠镜不仅是评估显性小肠出血最经济有效的方法,且止血成功率也最高。VCE引导下的双气囊小肠镜可能是并发症风险最低、利用效率最高的选择[33]。目前推进式小肠镜已较少使用。
目前不推荐在小肠出血的评估中进行钡剂检查。VCE对于黏膜内病变及炎性病变的诊断能力明显优于CT小肠造影(CT-enteroclysis,CTE)[13]。然而有研究表明,当小肠肿瘤未突出到腔内时,CTE诊断肿瘤的敏感性高于VCE[34]。对已确诊的炎症性肠病、既往有放射治疗史、既往有小肠手术史和(或)疑似小肠狭窄的患者,应先行CT小肠造影。
因此,对于诊断小肠出血,VCE与CTE应相辅相成。怀疑小肠出血且VCE检查阴性者可行CTE,其可指导随后的小肠镜检查。对于血流动力学稳定且有活动性出血证据的患者,可进行CT血管造影检查以明确出血部位并指导进一步治疗。
如发现出血来源于小肠,且与持续贫血和(或)活动性出血相关,则应采用小肠镜治疗。在接受VCE指导的干预后, 50%~66%的患者在长期随访中未再出血[35-37]。VCE检查结果为阴性的患者中,有6%~27%的患者发生了再出血[38-39]。推荐对VCE检查后仍未发现出血来源的患者推迟进一步的侵入性检查,首先进行保守治疗。若首次小肠检查为阴性,但有持续的显性或隐匿性出血者,则建议重复诊断性检查。
3 结 语
IDA是广泛影响世界各国的重要健康问题之一。导致IDA常见的胃肠道疾病包括消化道出血及吸收不良。内镜检查对于诊断IDA的病因有很重要的作用。内镜检查的顺序因以患者的症状为指导。对于妇科检查无异常的铁难治性IDA女性,建议首先进行上消化道内镜检查。确诊为IDA的绝经后女性患者和所有男性患者,除非能明确失血并非来自胃肠道,否则均应考虑上消化道检查和下消化道内镜检查。5%~10%的消化道出血患者无法通过上/下消化道内镜明确病因。消化道出血的患者若在上/下内消化道镜检查后仍未能明确病因,应考虑出血位于小肠。由于胶囊内镜、小肠镜检查的进步,大多数患者均可确定小肠出血的原因。此外,内镜可以对病变直接进行活检或治疗。
但我们仍应认识到内镜检查的局限性,影像学检查侵入性较小(如CTC、CTA、CTE),可能更适用于体弱者和老年人。因此在胃肠道疾病相关缺铁性贫血的诊断中,内镜应与影像学检查相辅相成。

