剑麻内生枯草芽孢杆菌JM-3胞外蛋白的分离及其对苹果树腐烂病菌的抑制作用
张淑颖,曲田丽,李保华
(1.青岛农业大学植物医学学院;2.青岛农业大学化学与药学院,山东 青岛 266109)
由黑腐皮壳菌[Valsaceratosperma(Tode) Maire]引起的苹果树腐烂病最早于1897年在日本被发现,在我国苹果产区也普遍发生.该病菌具有潜伏侵染的特点[1],正常的苹果树皮上会带有潜伏病菌,其存在于树皮表面的死组织或细胞团中以及果树剪口、枯梢和干桩上,尤其是新鲜伤口极易被侵染发病[2],严重时造成整株果树乃至果园毁灭.我国历史上有过4次苹果树腐烂病发病高峰期,给不少果园造成灭顶之灾.目前,生产上主要靠化学农药防治该病,但存在防治难、防效差、环境污染等问题,严重制约了苹果产业的可持续发展.因此,寻求苹果树腐烂病无公害防治措施势在必行.
枯草芽孢杆菌(Bacillussubtilis)能产生多种抗菌物质,可抑制真菌、细菌、病毒等病原体的正常生长[3].国内外已有许多利用枯草芽孢杆菌开发的生物农药,用于防治农业生产病害[4].笔者前期研究发现,剑麻(Agavesisalana)内生枯草芽孢杆菌菌株JM-3发酵滤液能抑制苹果树腐烂病菌的菌丝生长和分生孢子萌发,导致菌丝和芽管膨大、畸形,最终菌丝破裂,原生质外流,且对离体苹果树枝条上腐烂病斑的扩展有较好的抑制效果[5],但抑菌物质的性质、种类、成分及作用机理尚不清楚.故本研究拟从该菌株胞外代谢产物中提取对苹果树腐烂病菌具有抑制作用的拮抗蛋白,以期为该抑菌蛋白的推广应用提供理论依据.
1 材料与方法
1.1 供试菌株
病原指示菌:苹果树腐烂病菌为黑腐皮壳菌,从富士苹果树腐烂病斑上分离、纯化并鉴定.试验菌:枯草芽孢杆菌菌株JM-3自剑麻中分离并鉴定.
1.2 无机培养基的筛选
试验设碳源+KNO3、碳源+NH4Cl、碳源+NH4NO3、碳源+(NH4)2HPO4、碳源+(NH4)2SO4、碳源+尿素、碳源+氨基乙酸等培养基.每1 000 mL碳源母液中含葡萄糖10 g、MgSO4·7H2O 0.3 g、FeSO4·7H2O 0.02 g、CaCO30.2 g、KH2PO40.5 g、Na2HPO4·12H2O 0.5 g,氮源3 g,pH为7.0~7.2,250 mL二角瓶装液量为100 mL,34 ℃、170 r·min-1振荡培养48 h[6].菌株发酵液活菌数与D600 nm呈良好的线性相关[7],以相应培养基组分为空白对照,通过用分光光度计测D600 nm计算活菌量.取细菌过滤器过滤后的上清滤液0.1 mL于牛津杯中进行抗菌活性测定.用紫外分光光度计测定波长在260和280 nm的光密度(D)[8],计算蛋白质浓度(ρ).
ρ(蛋白质)=1.45D280 nm-0.74D260 nm
1.3 胞外蛋白粗品的制备及抑菌效果测定
分别用不同饱和度(NH4)2SO4沉淀同批次发酵液.将发酵液10 000 r·min-1离心10 min,取上清液经细菌过滤器制备无菌发酵滤液,加入固体(NH4)2SO4,4 ℃冰箱中静置24 h,15 000 r·min-1离心10 min,分别收集沉淀和上清液.用0.05 mol·L-1PBS(pH 6.8)溶解盐析沉淀蛋白(每4 mL PBS溶解1 L粗提液盐析蛋白),牛津杯置于PDA平板中央,在杯中注入40 μL各沉淀溶解物,在其四周各放一个苹果树腐烂病菌菌饼,28 ℃暗培养96 h,测量抑菌圈直径.以PBS、饱和上清液、苯醚甲环唑(4 μg·mL-1)为对照.
选取有拮抗作用的沉淀蛋白,测定其对苹果树离体枝条腐烂病菌的抑制作用:用75%酒精对直径约1 cm的苹果树枝条进行表面消毒,用打孔器(直径5 cm)去除枝条表皮,先接种20 μL沉淀蛋白后再接种苹果树腐烂病菌菌饼(直径5 cm),保鲜膜覆盖菌饼,25 ℃恒温培养,10 d后测定腐烂病斑长度.
1.4 拮抗蛋白的分离
SDS-PAGE:浓缩胶质量分数为4%,分离胶质量分数为8%,用考马斯亮蓝R250染色,后经脱色、拍照、灌胶、加样、电泳、染色及脱色等程序,最后制作标准曲线.
同时灌注2块胶:胶Ⅰ用考马斯亮蓝R250染色,脱色,拍照;胶Ⅱ不染色.比对胶Ⅰ和胶Ⅱ电泳图,在胶Ⅱ相同位置将每一个蛋白条带分别切割,无菌水冲洗3次,用0.05 mol·L-1PBS(pH 6.8)浸提过夜,得浸提蛋白液.
将浸提蛋白液置于牛津杯中,观察其对培养皿中腐烂病菌菌丝生长的抑制情况,测量抑菌圈直径.以PBS为对照,分别测定每一个蛋白条带的抑制效果.
1.5 拮抗蛋白对苹果树腐烂病菌抑制效果的测定
1.5.1 对菌丝生长的毒力 提取得到的拮抗蛋白经冷冻干燥后,用50 mmol·L-1PBS(pH 6.8)缓冲液按蛋白的质量配成1、5、10、20、100 μg·mL-1溶液.采用牛津杯法进行测定,取20 μL蛋白处理液置于牛津杯中,四周等距离放置苹果树腐烂病菌菌饼,28 ℃暗培养96 h,用十字交叉法测量菌落直径,每个浓度重复3次.以苯醚甲环唑(10 μg·mL-1)为对照,根据不同浓度蛋白的菌丝生长抑制率计算回归方程和EC50值.
菌丝生长抑制率/%=(对照菌落直径-处理菌落直径)/对照菌落直径×100
相对抑制率/%=处理抑制率/原液抑制率×100
1.5.2 对分生孢子萌发的影响 提取得到的拮抗蛋白经冷冻干燥后,用50 mmol·L-1PBS(pH 6.8)缓冲液按蛋白的质量配成1、2、4、8、16 μg·mL-1溶液.配制孢子悬浮液(106个·mL-1),将其与拮抗蛋白液等体积混匀.采用培养皿玻片法进行测定,凹玻片上28 ℃暗培养96 h,以芽管长度超过孢子直径一半作为萌发标准,测定其对分生孢子萌发的抑制率.以苯醚甲环唑(20 μg·mL-1)为对照.
1.5.3 对离体苹果树枝条腐烂病斑扩展的影响 提取得到的拮抗蛋白经冷冻干燥后,用50 mmol·L-1PBS(pH 6.8)缓冲液将其配成10 μg·mL-1溶液,测定方法同1.3.处理为20 μL蛋白液,PBS为对照.
1.6 数据分析
采用SAS 9.0统计数据,用Duncan氏新复极差法进行差异显著性分析.
2 结果与分析
2.1 不同氮源的无机培养基对JM-3生长及其抗菌物质分泌的影响
试验结果表明,在无机培养基中,菌体生长的最适培养氮源为NH4NO3,D600 nm为1.752;(NH4)2HPO4次之,D600 nm为1.706(表1).以NH4NO3作为氮源最有利于生成胞外蛋白物质,ρ(蛋白质)达1.900.以(NH4)2HPO4作为氮源,抑菌活性最强,抑菌圈直径达15 mm;NH4NO3和氨基乙酸次之,抑菌圈直径分别为10和5 mm.由此可以看出,以NH4NO3作为氮源,JM-3菌体生长量最大,胞外蛋白物质含量最多;以(NH4)2HPO4作为氮源,抑菌活性最强.

表1 JM-3菌株在无机培养基中的生长量及其抑菌活性1)Table 1 Reproduction and antagonistic activity of JM-3 in different inorganic media
2.2 胞外蛋白粗品的制备
结果(表2)表明,(NH4)2SO4饱和度为40%~60%时,可将无机发酵滤液中的活性蛋白完全沉淀析出.其中,40% (NH4)2SO4的盐析蛋白抑菌圈直径达25 mm,皿内抑菌效果最好;50% (NH4)2SO4沉淀蛋白次之,抑菌圈直径为14 mm,与前者有显著差异(P<0.05).40%和50% (NH4)2SO4盐析蛋白能有效抑制离体枝条病斑扩展,抑制效果优于4 μg·mL-1苯醚甲环唑(P<0.05);60% (NH4)2SO4盐析蛋白对离体枝条病斑扩展的抑制效果较差,与苯醚甲环唑无显著差异(P>0.05).
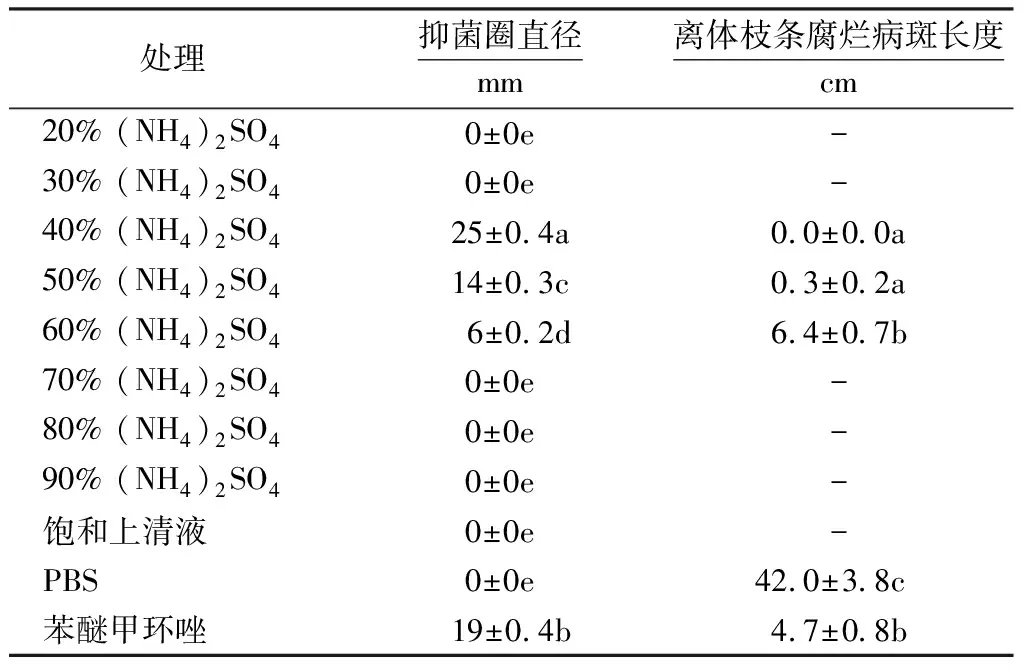
表2 不同饱和度(NH4)2SO4盐析蛋白对腐烂病菌的抑制效果1)Table 2 Inhibition effects of different saturations of ammonium sulfate precipitation on V.ceratosperma
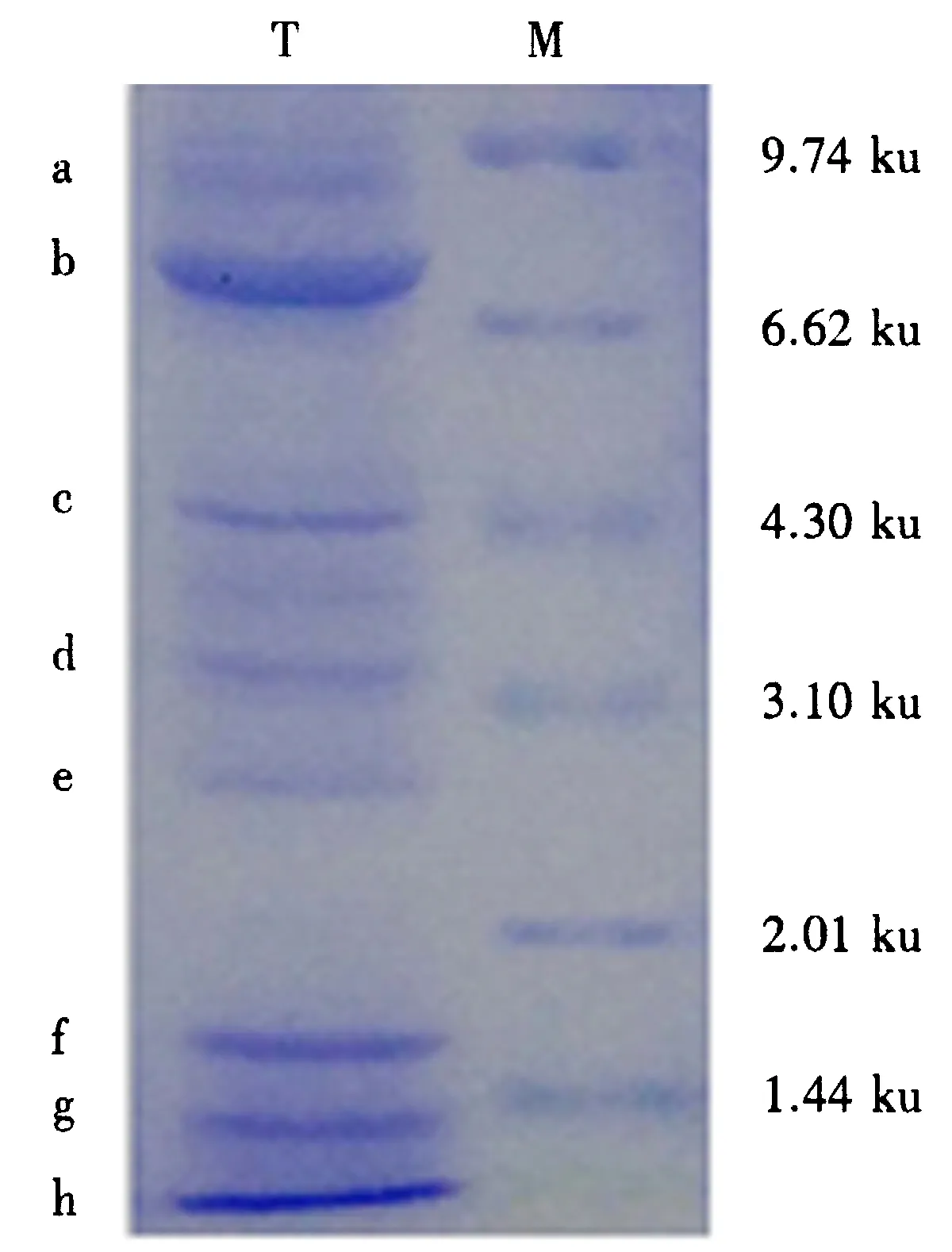
M.Marker;T.胞外蛋白(a-h为可见蛋白条带).图1 JM-3菌株胞外蛋白电泳图Fig.1 Electrophoresis of extracellular protein from JM-3
2.3 拮抗蛋白的分离及其抑菌效果
40%、50%饱和(NH4)2SO4盐析蛋白经凝胶电泳后分离出数条蛋白条带(图1).拮抗测定结果表明:仅c蛋白条带能抑制苹果树腐烂病菌菌丝生长(图2),其相对分子质量约为4.5 ku.

左:PBS (CK);右:拮抗蛋白c.图2 拮抗蛋白对苹果树腐烂病菌菌丝生长的抑制效果Fig.2 Antagonistic activity of antagonistic protein on mycelial growth of V.ceratosperma
2.4 拮抗蛋白c对苹果树腐烂病菌的抑制作用
拮抗蛋白c对腐烂病菌菌丝生长的毒力方程为y=3.490 5+0.989 2x,EC50值为33.54 μg·mL-1;苯醚甲环唑对腐烂病菌菌丝生长的毒力方程为y=0.943 8+2.231 1x,EC50值为65.71 μg·mL-1.可见,拮抗蛋白c的抑菌效果优于苯醚甲环唑.
当拮抗蛋白c浓度为8 μg·mL-1时,对腐烂病菌分生孢子萌发的抑制率为89.5%,与对照相比无显著差异(P>0.05);拮抗蛋白c浓度为16 μg·mL-1时,对腐烂病菌分生孢子萌发的抑制率为97.2%,与对照相比差异显著(P<0.05,表3).
图3显示,对照病斑长度为64 mm,拮抗蛋白c能完全抑制离体苹果树枝条腐烂病斑扩展.
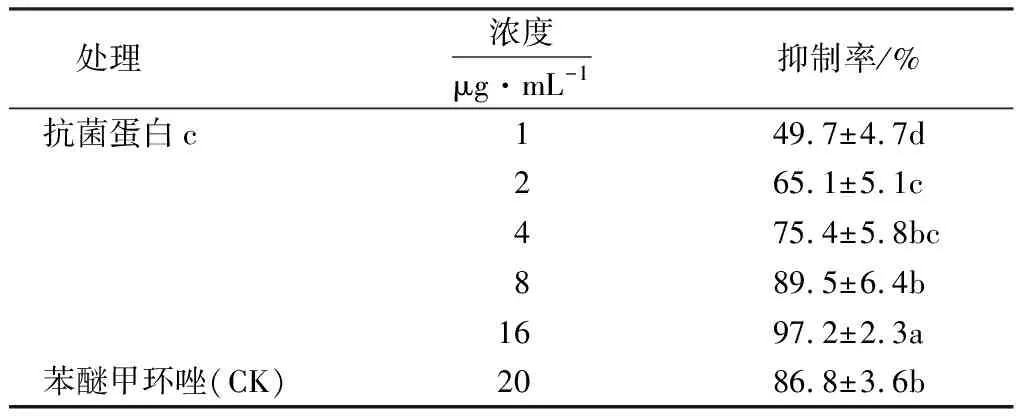
表3 拮抗蛋白c对苹果树腐烂病菌分生孢子萌发的抑制率1)Table 3 Inhibitory rate of antifungal protein c on the conidial germination of V.ceratosperma
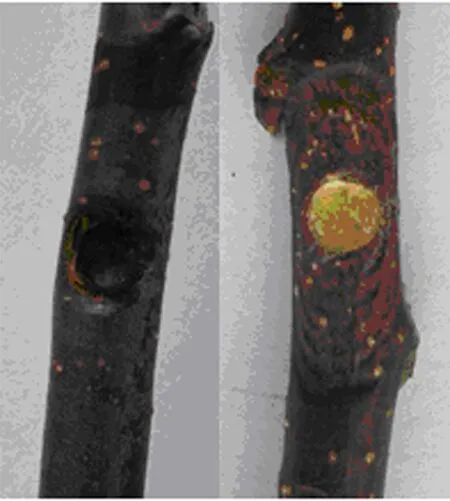
左:拮抗蛋白c;右:PBS (CK).图3 拮抗蛋白c对离体苹果树枝条腐烂病菌的抑制效果Fig.3 Inhibition effect of antifungal protein c on lesion expansion of apple branch caused by V.ceratosperma in vitro
3 讨论与结论
枯草芽孢杆菌除具有对人畜无害、不污染环境、抗逆性强等特性外,还有非常发达的外分泌系统,生成的次级代谢产物能够有效控制病害发生[6].其产生的抗菌物质按来源可以分为两大类:一类是由非核糖体合成,另一类是由核糖体合成.非核糖体合成的抗菌物质以肽类抗生素为主,分子质量介于300~3 000 u之间,绝大多数为环状肽或环状脂肽;核糖体合成的抗菌蛋白分子质量大于20 ku.枯草芽孢杆菌胞外蛋白对植物病害的抑制机制主要分为2种:(1)生成拮抗物质,如细菌素、凝集素、蛋白酶抑制剂、几丁质酶和葡聚糖酶等细胞壁降解酶[2,9-15];(2)诱导寄主产生抗性防御反应[16-17].
传统有机发酵培养基中含有蛋白物质,易对试验结果产生干扰,因此本试验采用无机培养基对菌体进行发酵培养.研究发现,剑麻内生枯草芽孢杆菌菌株JM-3在以(NH4)2HPO4作为氮源的无机发酵培养基中培养,生成的抑菌物质活性最强,其拮抗蛋白可通过40%~60% (NH4)2SO4分级沉淀盐析.40%和50% (NH4)2SO4盐析蛋白经凝胶电泳,获得1条活性蛋白条带c,其分子质量约为4.5 ku,能够抑制苹果树腐烂病菌菌丝生长和分生孢子萌发,也可完全抑制离体苹果树枝条腐烂病斑扩展.枯草芽孢杆菌至少能分泌60多种抗菌物质,但由于抗菌物质积累的机制不明确,分离纯化体系不完善,仅10余种具有确定的结构和功能[18].有关拮抗蛋白c的成分、结构以及在田间的应用效果还有待于进一步研究.

