针刺改善阿尔茨海默病氧化应激机制的研究现状与思考*
赵丽萍,缪林清,蒋鹭莲,刘 珂,冯 渊,朱翔宇**
(1. 北京中医药大学针灸推拿学院 北京 100029;2. 北京理工大学机电学院 北京 100081)
阿尔茨海默病(Alzheimer’s disease,AD)是发生于老年前期和老年期的一种进行性神经系统退行性疾病,主要病理表现为细胞内发生神经纤维缠结(Neurofilament tangle,NFT)、细胞外产生淀粉样沉积物老年斑(Senile plaques,SP)以及神经细胞凋亡等,临床以认知功能障碍及精神行为障碍为特征[1-4]。全球有约2900 万老年人患上此病,预计到2050 年,这一数字将增加三倍[1]。在发达国家AD 已成为继心脏病、脑血管疾病、肿瘤之后的第四位高死亡率的疾病[5]。我国老年人AD 患病率为4%-5%,80 岁人群患病率高达30%,对我国高龄人群的健康具有较大威胁[5]。但此病的治疗缺乏有效的治疗手段,因此对AD 治疗方法和机制的研究仍然是目前脑科学领域和老年医学领域的研究热点和重点。针刺治疗AD 因其疗效较好、副作用小,近年来被广泛使用。《本草备要》中记载“人之记性皆在脑中”;《本草纲目》也有记载“脑为元神之府”提示思维、记忆等活动皆于脑中产生,认为痴呆的病位在脑。针刺具有安神益智、调理气机、疏通气道等功效,通过针刺特定穴位,对AD 患者的生理功能确有改善作用[6-7]。
但关于针刺经由何种机制治疗AD 迄今尚无确切的结论,近年来关于针刺治疗AD 的机制研究发展迅速,产生了众多机制假说丰富了针刺治疗AD 的理论。现有的AD 致病学说有基因学说、胆碱能学说、基因突变学说、TAU 蛋白异常学说、免疫炎症学说、氧化应激学说等,其中氧化应激学说受到越来越多的关注[8-9]。氧化应激被认为是AD 重要的致病因素,自由基产生与清除失衡使氧化应激反应增强诱发AD病理改变[10]。众多研究[8-9,11-19]发现,针刺疗法改善了脑内自由基-氧化应激系统,增强了神经系统抗氧化能力。因此,本文将对此机制进行分析与探讨,阐明针刺对脑内氧化应激系统的影响,丰富针刺治疗AD 的研究思路与治疗方法。
1 针刺治疗AD的临床研究现状
目前临床上对于AD 的治疗多以西药为主,但西药治疗副作用较大,易引发其他疾病,且给家庭带来的经济负担较重。研究[20]表明,在2002 年到2012 年间,美国的临床研究网站上有244种用于治疗AD的药物进行过临床实验,但最终只有一种药物(美金刚胺)获得了美国食品药品监督管理局(Food and drug administration,FDA)的批准。由此可见治疗AD 的西药研制时间长而成果甚微,研发艰难。如何寻找一种经济方便,效果良好,副作用小的治疗方法成为目前AD治疗领域的追求目标。
AD 在我国传统医学的文献中虽无记载,但对AD的相关症状的表述分散见于“癫疾”、“呆病”、“善忘”等描述,对于此类疾病,我国早有使用针刺治疗的先例。针刺是我国传统物理治疗手段,现阶段有大量文献[21-25]表明,针刺治疗AD 临床疗效显著,其能够使患者的痴呆状况得到改善、生活自理能力逐步提高。赵磊等[21]对60 例患者均进行针刺治疗后通过简易精神状态检查量表(Mini-mental state examination,MMSE),发现治疗后MMSE 量表的评分均高于治疗前,证明针刺能改善AD患者的精神状态;彭静等[25]对试验组进行西药治疗后增加电针疗法,对照组仅进行单纯西药治疗,结果发现治疗后试验组MMSE 和改良长谷川痴呆量表(HDS-R)评分均明显高于对照组、总有效率优于对照组,以上均能说明针刺疗法对AD具有较好疗效。
目前针刺治疗AD 氧化应激机制受到越来越多学者的关注[10,26-29],例如王少锦等[9,14]通过对痴呆大鼠进行针刺干预后发现,针刺组大鼠的迷宫学习记忆能力提高,且大脑皮质中自由基的链锁反应产物丙二醛(Malondialdehyde,MDA)含量较模型组显著降低而抗氧化物质谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、超氧化物歧化酶(Superoxide dismutase,SOD)活性明显升高。张秋艳等[16]的研究中:实验组大鼠经电针治疗后,走完迷宫全程的时间和走错次数均明显低于模型组,大鼠的记忆与学习能力得到改善,体内的MDA 含量与自由基一氧化氮(Nitric oxide,NO)活性明显低于对照组、SOD 活性明显高于对照组。预示了针刺对机体氧化应激水平的调控很可能是针刺治疗AD的机理之一。由此,本文将对现阶段针刺治疗AD 氧化应激机制的研究进行分析整合,以探究针刺如何通过氧化应激机制来治疗AD。
2 AD与体内氧化应激机制的联系
2.1 氧化应激系统产生自由基
衰老的自由基学说由英国Harman 于1956 年提出,并逐步发展为自由基-氧化应激学说[30]。氧化应激指体内氧化和抗氧化作用失去平衡的一种状态[26]。需氧细胞在代谢的过程中与氧气发生反应,利用体内的氧气来产生能量,但氧气可以与机体的某些物质发生反应而产生活性氧,即一种自由基[31]。活性氧的产生又能与脂质反应,继续引发更多链式反应,产生更多自由基[27]。自由基是许多通路的第二信使,正常情况下体内一些分解代谢的反应会通过自由基来发挥作用[14];但当自由基含量过多时,则会攻击机体内的蛋白质、脂质、DNA 等,对细胞产生毒性,对组织造成损伤[32-34]。
2.2 产生的自由基导致AD
人体在逐渐衰老的过程中,细胞内线粒体的电子泄露会增加,氧化应激水平增高[27]。氧化应激导致的细胞损伤对AD 发病有着重要的作用[35-36],由于脑的多不饱和脂肪酸含量高、耗氧量大,但抗氧化酶却相对缺乏,因此容易受到自由基的攻击。并且随着年龄的增长,脑组织结构改变与功能退化、抗氧化能力下降,使得脑对自由基更为敏感[18]。目前大多数研究[11,37]认为AD 的病理改变主要为神经元内的神经纤维缠结(NFT)、细胞外老年斑(SP)以及神经元数量的减少。研究[8]表明,自由基对神经系统的攻击与NFT、SP、神经元凋亡与变性坏死存在密切关系。
NFT 的主要成分是过度磷酸化的Tau 蛋白。研究[8,19]表明,活性氧自由基(Reactive oxygen species,ROS)能导致Tau蛋白的异常磷酸化。Tau蛋白过度磷酸化,失去了与微管结合的能力最终促进NFT 的生成[38];SP的主要成分为淀粉样蛋白(β-amyloid protein,Aβ),由淀粉样前蛋白(Amyloid precursor protein,APP)水解后产生,自由基能促进APP 的产生,加速了SP 的形成[39];研究[40]发现,ROS 对神经元细胞凋亡具有促进作用,自由基的细胞毒性是促进神经元细胞的衰老与凋亡的原因之一。一氧化氮(NO)易破坏蛋白质、脂质、DNA 的结构,导致细胞变性坏死[41]。均使AD 朝不良方向发展。
此外自由基能从其他方面对AD 产生影响:自由基可以在抗氧化物质作用下生成H2O2[11]。H2O2几乎能与机体的大多数有机物如蛋白质、脂类等发生反应,且有非常高的速度常数,损伤细胞明显,能引起神经元细胞的凋亡[11];机体内过多的自由基还能与脂质发生链式反应和过氧化反应。链式反应扩大了活性氧的作用,产生毒性更大的羟自由基(OW)的前身物,加速机体衰老进程[14]。过氧化反应生成脂质过氧化物(Lipid peroxide,LPO)包括异构前列腺素(8-IPF2α)、终产物丙二醛(MDA)等[42-62],以及DNA 损伤后产生的脱氧鸟嘌呤核苷(8-OH-dG)[63]。其中8-IPF2α是反映脑组织脂质过氧化状态最精确的标准[64],也是评估氧化应激水平的金标准。8-OH-dG 是较为理想的DNA损伤的生物标志物[65]。MDA 的作用有二:一是引起蛋白质、核酸、脂质等大分子交联[8];二是对细胞有毒性作用,围绕脂褐素沉淀,SP 沉积[17]。这两种作用均使脑内细胞的结构发生改变,功能下降。
3 针刺治疗AD的氧化机制研究总结
3.1 针刺激活氧化防御体系
第一类是针刺手法使机体的氧化防御体系中的物质增多,减少过多自由基对神经系统的毒害作用。机体内的氧化防御体系依靠直接清除自由基,减少自由基导致的TAU 蛋白过度磷酸化、APP 大量表达生成Aβ、加速神经细胞凋亡与坏死,从而减少AD的主要病理特征出现,以及降低自由基链锁反应对细胞膜、生物大分子如DNA、脂质等的直接损伤作用来改善AD,包括酶性氧化防御体系与非酶性氧化防御体系[8]。大量研究[42-52]表明,针刺治疗AD 与酶性和非酶性物质有着密切联系。对针刺干预后的AD 大鼠进行相关抗氧化酶含量或活性的检测,发现针刺导致抗氧化酶含量增加或活性升高,氧化应激水平得到改善,针刺组学习记忆功能也有所提升,说明针刺治疗改善机体的氧化防御水平是针刺治疗AD的机理之一。
3.1.1 针刺激活酶性氧化防御体系
酶性氧化防御体系主要包括SOD[8]、GSH-PX、过氧化氢酶(Catalase,CAT)等。大部分研究发现针刺治疗后抗氧化酶SOD 的活性升高[66-74];张秋艳等[16]采用电针疗法对大鼠进行治疗,观察电针对AD 大鼠脑皮质的SOD 活性及认知记忆功能等影响。结果表明针刺后大鼠脑内SOD 活性明显增强,大鼠走完迷宫全程的时间与走错次数明显减少,提示大鼠的认知记忆功能得到改善。林艺明等[12]采用针刺治疗,结果显示针刺后大鼠海马组织的SOD 活性显著上升,迷宫测试反应时间减少,大鼠学习记忆能力上升。唐勇等[48]采用手针治疗,治疗前后对比发现SOD 的水平无明显变化,与大部分研究不符。SOD 主要通过催化ROS 与氢离子的歧化反应生成H2O2与水,从而阻断自由基促进AD 主要病理特征生成和自由基链锁反应中毒性更大的物质产生。
部分研究[28-29,74]证明针刺治疗后抗氧化酶GSHPX 的活性升高,抗氧化酶CAT 活性增强[27,42]。李书晓等[8]观察电针对AD 大鼠GSH-PX 等活性及大鼠空间学习记忆能力的影响,结果显示针刺后实验组大鼠血清中GSH-PX 活性高于对照组,大鼠水迷宫测验平均逃避潜伏期和平均游泳路程少于对照组,空间学习记忆能力提升。郭艳芹等[11]使用电针疗法观察电针对AD 大鼠CAT 等活性与空间学习记忆能力的影响,结果显示电针干预后实验组大鼠CAT 活性增加,在定位航行实验中平均逃避潜伏期同模型组比较显著缩短,空间探索试验中电针组在平台象限游泳距离百分比明显高于模型组,提示针刺治疗后大鼠的学习、记忆能力显著提升。但也有研究显示针刺治疗AD 可能与GSH-PX、CAT无关,Sutalangka等[60]使用激光针灸治疗AD 大鼠,结果显示GSH-PX 的水平无明显变化。CAT与GSH-PX 共同作用可以清除脑内过多的H2O2,此外GSH-PX也能清除体内过多的ROS,还可与维生素E一起保护细胞,减少脂质过氧化反应在细胞中的发生[8]。
3.1.2 针刺激活非酶性氧化防御体系
非酶性氧化防御体系主要包括了谷胱甘肽(Glutathione,GSH)、褪黑素(Melatonin,MT)等[8]。大部分研究表明,针刺能增加AD 患者GSH 的活性或含量。黄畅[45]采用灸法观察其对AD 大鼠GSH 含量及大鼠空间学习记忆能力的影响,结果显示大鼠血清中GSH 含量升高,针刺后大鼠空间学习记忆能力得到改善。GSH 具有清除体内自由基,在细胞多种代谢中起到抗氧化作用[75-77]。通过增加GSH 含量,清除体内自由基,维持细胞正常生理功能,延缓AD 病情。研究报道,针刺增加了AD 患者MT 的含量。何疆等[24]对AD 大鼠进行电针治疗,结果发现两周后大鼠脑内MT 含量显著增加,AD 症状得到改善。MT 是脑内具有最强氧化防御作用的激素,保护脑细胞正常结构[27]。MT能清除多种自由基和NO 等,还能增加脑内GSH,提高SOD 等抗氧化酶的活性[67]。
3.2 针刺减少自由基反应产物
另一类针刺通过氧化应激机制治疗AD 是通过针刺手法致使自由基反应产物减少来降低自由基链锁反应的发生率,目前主要研究LPO。LPO 大多数以MDA 为指标,MDA 含量的变化反映机体的脂质过氧化水平[78]。首先大量研究[42-47]证明针刺治疗后MDA 含量减少。王少锦等[9]观察针刺对AD 大鼠大脑皮质MDA 含量和学习记忆能力的影响,结果表明针刺干预后大鼠脑皮质的MDA含量比对照组显著降低,迷宫学习记忆能力测试成绩优于对照组;其次有研究[13,46]证明针刺治疗后8-IPF2α 含量降低。朱宏等[13]使用针刺疗法治疗AD 患者,观察此疗法对患者血清及尿液中8-IPF2α 含量及精神状态改善情况的影响,结果显示针刺治疗后8-IPF2α 含量下降、MMSE 评分高于治疗前。此外还有研究针刺后8-羟基-2’脱氧鸟嘌呤核苷(8-OH-dG)与硝基化酪氨酸(NT)的含量变化。8-OH-dG 是 DNA 氧化损伤的标志物[65]。NT 是 NO 被氧化后结合游离酪氨酸的生成物,是评价氧化损伤的常用指标[27]。何疆[27]等采用电针治疗AD大鼠两周后,NT含量减少,氧化应激水平得到改善;Wu 等[59]采用电针治疗AD 大鼠,观察到针刺能减少8-OH-dG 的含量。以上结果均证明针刺后氧化应激水平得到改善,认知等功能也得到改善,说明针刺疗法使得脂质过氧化物减少从而降低自由基反应产物对细胞的损害作用也是针刺治疗AD的机理之一。
关于针刺治疗AD的氧化应激机制由表1可得,针刺通过氧化应激机制的治疗可以分为针刺激活氧化防御体系、针刺减少自由基反应产物两类。
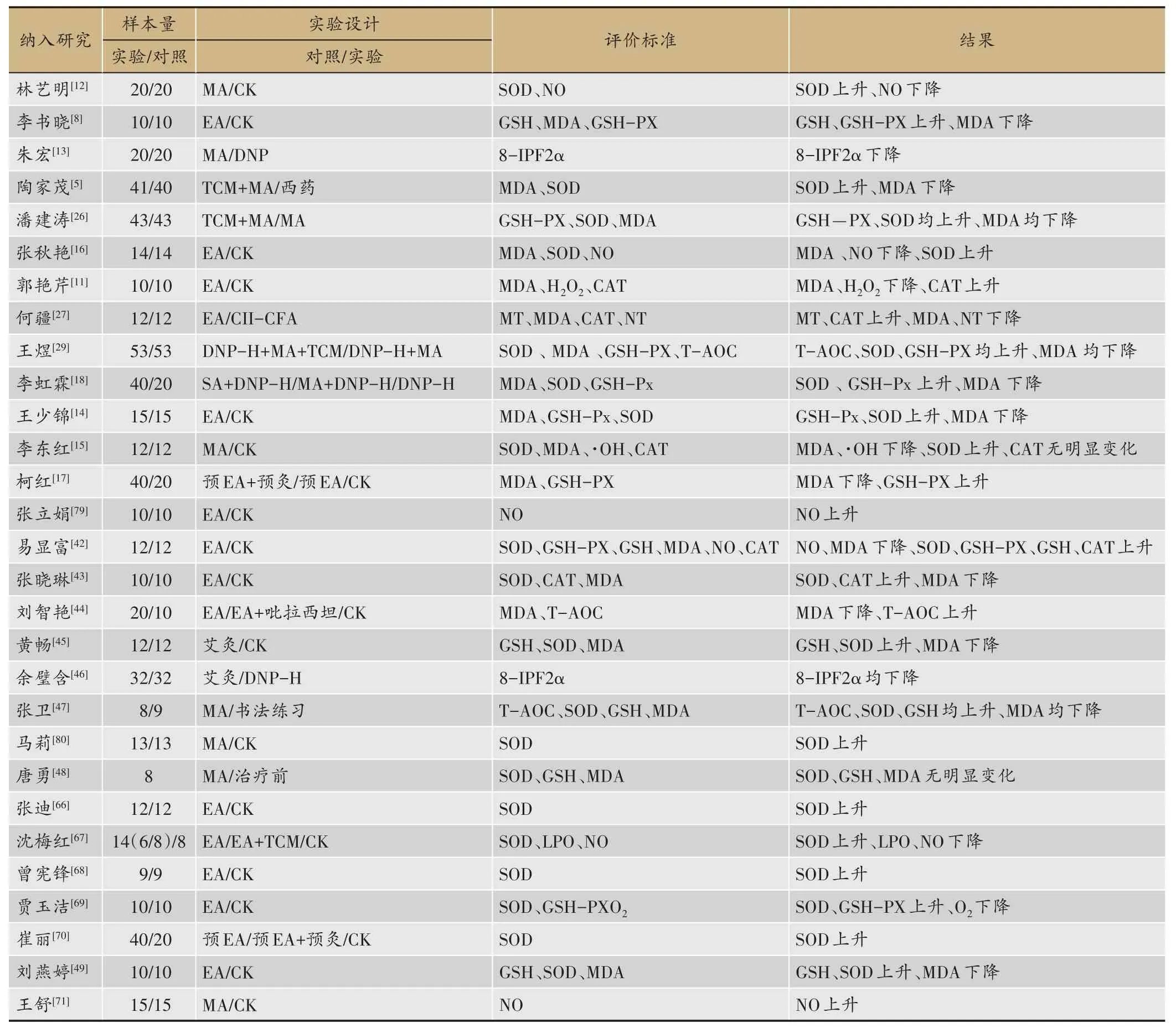
表1 针刺治疗AD的氧化应激机制临床研究
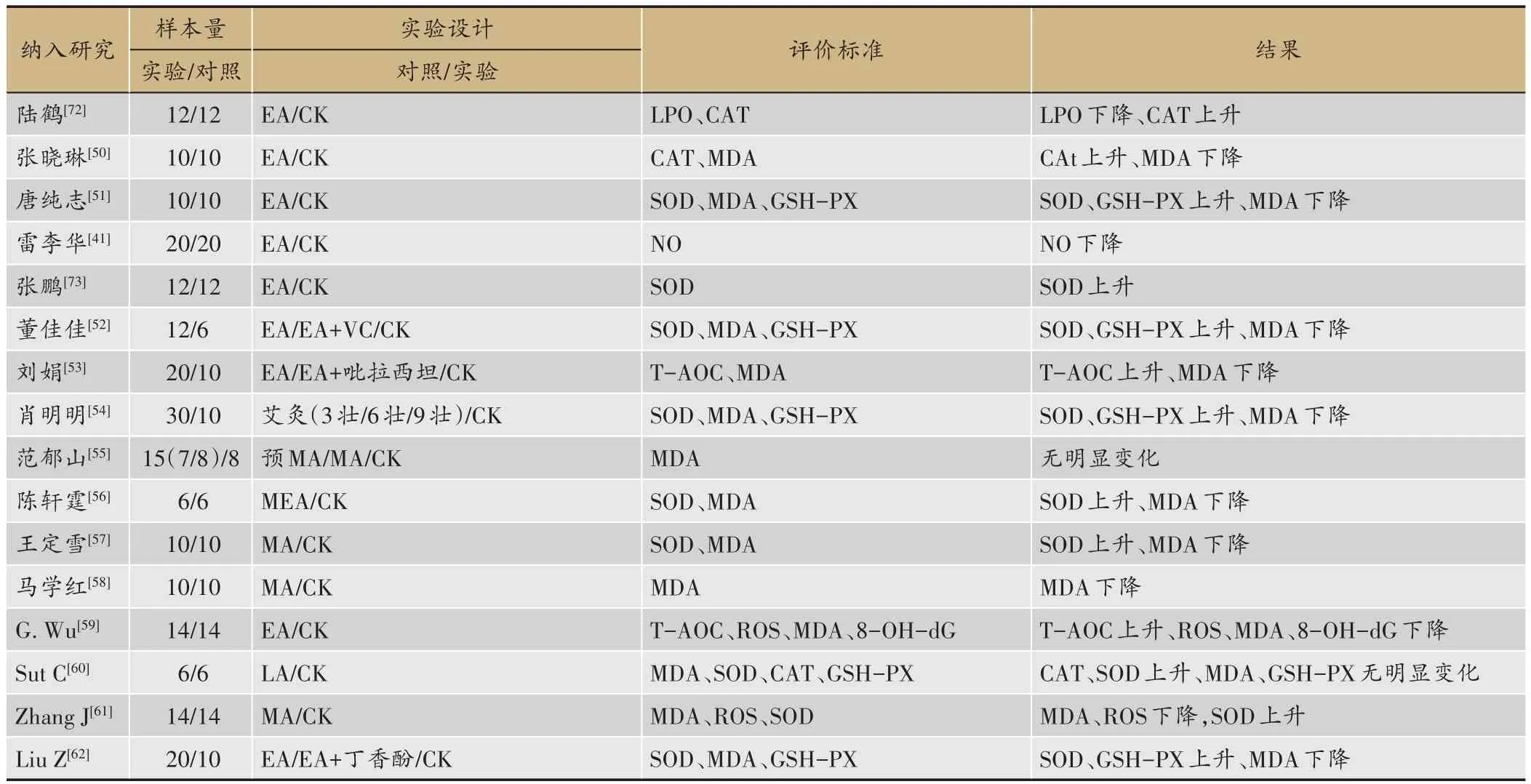
续表
4 讨论与思考
本文收集近年来关于针刺治疗AD 的研究,发现针刺疗法作用机制之一是改变机体的氧化应激水平来治疗疾病。表1 的研究显示,研究大多通过检测试验后抗氧化物质(例如SOD、GSH-PX、CAT、GSH 等)和自由基反应产物(例如MDA、8-IPF2α 等)的含量或活性,体现针刺后脑内或体内氧化应激水平。证实针刺通过提高机体氧化防御系统活性与减少自由基反应产物含量的两种方式治疗AD。第一种途径为针刺对氧化防御系统激活后间接降低脑内氧化应激水平,其系统内抗氧化物质丰富,可由各类途径大范围减少自由基含量,故此类途径作用效果较突出。第二种途径为针刺减少自由基反应产物直接降低氧化应激水平,其作用较为单一。机制引发的两种途径之间也存在着一定关联,由于抗氧化物质在消除自由基的同时也可消除自由基链锁反应的产物,因此针刺疗法与氧化防御体系的激活会共同促进自由基反应产物的减少。故针刺治疗AD 氧化应激机制更为重要的途径是激活了体内氧化防御系统。
本文通过对现存文献分析得到针刺激活AD 患者的氧化防御系统的作用途径如下:针刺疗法提高了AD患者脑内抗氧化物质如SOD、GSH、GSH-PX、CAT、MT 的含量或活性。T-AOC 是反映机体内总的抗氧化能力的重要指标之一,是酶性和非酶性抗氧化物的总体水平[80-81]。故T-AOC 也得以增强。由于SOD、GSHPX、CAT 对 H2O2的清除作用、MT 对 NO 的清除作用以及SOD、GSH、GSH-PX、CAT、MT等抗氧化物质对自由基(包括OH 等)的清除作用,使脂质过氧化反应以及链锁反应发生率降低,最终导致LPO(包括8-IPF2α、MDA)以及8-OH-dG、NT的生成减少(图1)。
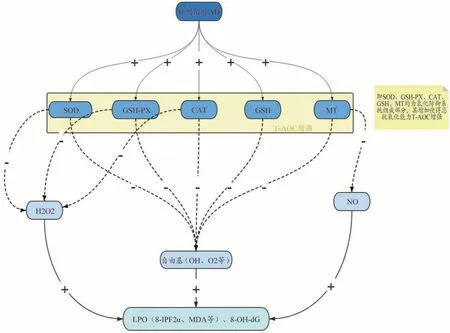
图1 针刺激活AD患者的氧化防御系统机制
但不是所有的研究均能证实以上作用途径。关于SOD、GSH 的研究中,唐勇等[48]对8例AD 患者进行一个月的手针治疗,结果发现SOD、GSH 水平均无明显变化。其认为可能原因是治疗时间过短导致针刺对氧化防御系统的提升不够明显;关于MDA 的研究中,唐勇[48]、Sutalangka[60]、范郁山[55]的研究均显示针刺治疗后MDA 的含量没有明显变化,综合来看,原因为以下几种:唐勇认为可能是治疗时间过短导致,Sutalangka 认为是检测指标所选大脑区域与暴露类型的差异导致,范郁山的研究中并未提及可能的原因。本文认为由于只有范郁山的研究中针刺采用沿皮浅刺法,故造成MDA无明显变化的原因可能是采用此种针刺手法;关于 GSH-PX 的研究中,Sutalangka 等[60]发现针刺后GSH-PX 无明显变化,其认为可能是检测指标所选大脑区域与暴露类型的差异导致;关于NO 的研究中,张丽娟[79]、王舒[71]等发现针刺治疗后AD 患者的NO 含量反而上升。原因是NO 重要的生理功能之一是:在中枢神经系统中起到信号传递的作用,神经系统的可塑性有关;进而与神经系统的发育、成熟,以及记忆功能有关,只有当NO 超过了生理浓度,才会产生细胞毒性[41]。在张丽娟[79]、王舒[71]的研究中,AD模型大鼠的NO 含量低于正常浓度,故需要针刺治疗使其上升,恢复正常浓度,使中枢神经系统更好地发挥生理功能。此外,针刺治疗AD 与CAT 活性之间的关系也存在争议。
李东红等[15]在对针刺后的相关因子检测中发现各组间CAT 水平无显著差异,提示针刺治疗AD 的作用过程可能与CAT 无关,但郭艳芹[11]、何疆[27]等均发现针刺治疗后实验组的CAT 活性确有增加,说明针刺治疗AD 与CAT 的活性加强有关,实验结果存在冲突。通过查阅研究[11,15,27]发现针刺治疗导致不同研究中CAT活性变化不同的原因可能有二:(1)对AD 大鼠采取针刺治疗方法的差异,李东红等[15]对AD 大鼠使用手针治疗;郭艳芹[11]、何疆[27]对AD 大鼠均采用电针治疗。(2)治疗持续时间的差异,李东红等[15]针刺治疗AD 大鼠疗程为34天;郭艳芹[11]、何疆[27]针刺治疗AD大鼠疗程均约两周。以上实验设计的不同均可能导致针刺治疗后大鼠脑内CAT 活性变化的不同,从而影响实验结论。
通过对现存研究分析发现:现阶段的研究对针刺治疗AD 的作用机制仍不能给出确切的答案,因为针刺对于AD 的改善很有可能是多靶点共同作用的结
果,是多重机制相互关联所导致。现阶段关于AD 的致病机理的主要假说以胆碱能系统的研究最为深入,现已公认胆碱能系统活性下降是引起AD 的重要原因,大量研究[9,12,16,27]探究了针刺治疗AD 时对机体自由基-氧化应激系统与胆碱能的影响,发现针刺能调节体内氧化应激水平的同时也能对中枢胆碱能的代谢功能进行调节。神经细胞生成的胆碱乙酰转移酶(ChAT)和乙酰胆碱酯酶(AchE)水平的降低是胆碱能系统机能下降的原因之一,而自由基对细胞的毒性会导致神经细胞的凋亡,故针刺后减少了自由基对神经细胞的损伤从而使胆碱能系统机能增强可能也是针刺治疗AD 的氧化应激机制之一。表1 各研究采取针刺的穴位与方法不尽相同,虽皆能改善氧化应激水平,但治疗时针刺方法与穴位的不同会对氧化防御系统产生不同的影响。由于本文主要研究针刺治疗AD的氧化应激机制,关于具体何种针刺疗法对改善氧化应激水平最有效,本课题组后续将持续关注。
总而言之,体内的自由基-氧化应激系统与AD的发病与发展有着重要联系,针刺调节机体氧化应激水平是针刺治疗AD 的内在机理之一。通过对针刺的自由基假说机制的探究,追溯其治疗原理,将能为今后临床针刺治疗AD 提供更多理论依据以改进针刺的具体治疗手段,帮助更多的AD 患者提高生活质量。