NFκB p65 siRNA对ox-LDL诱导的人脐静脉内皮细胞的保护作用
丁 倩,武文丽,魏尧悦
(1山东医学高等专科学校,山东 临沂 276000;2临沂市妇女儿童医院)
在动脉粥样硬化(AS)形成过程中,以血管壁的炎症为主要特征,而NFκB参与炎症过程中的多种信号传导途径,对多种促炎症细胞因子、黏附分子、趋化因子等的表达起着重要调控作用。本研究采用氧化型低密度脂蛋白(Oxidized low density lipoprotein,ox-LDL)诱导人脐静脉内皮细胞(HUVEC),降低细胞内超氧化物歧化酶(SOD) ,促进细胞内脂质过氧化物丙二醛(MDA)的产生,从而破坏血管内皮细胞(EC)的正常结构和功能,使细胞活力下降,构建EC的氧化应激损伤模型。本研究利用RNA干扰技术,靶向沉默核转录因子(Nuclear factor kappa B, NFκB)p65,抑制血管EC内其信号通路,观察阻断该信号通路对ox-LDL诱导HUVEC的作用。
1 材料与方法
1.1材料 Lipofectamine 2000、RPMI 1640培养基、胰蛋白酶消化液Trypsin Solution(美国Invitrogen公司),兔抗人NFκB p65(美国Cell Signaling Technology公司),辣根过氧化酶标记山羊抗兔IgG(美国Abcam公司),RIPA裂解液(碧云天生物技术研究所),DMSO、MTT(美国Sigma公司),微量MDA、SOD测试盒(南京建成生物工程研究所)。
1.2方法
1.2.1HUVEC的原代培养 选择无感染、无妊娠期高血压的健康孕妇的足月新生儿脐带,长约20 cm,在超净台中先用无菌PBS将脐带表面血液及黏液冲洗干净,将无菌平头针头插入脐静脉一端,通过针头注入PBS进行清洗,直到流出液中无血色。用止血钳将脐带另一端夹闭,通过针头将胰蛋白酶注入脐静脉内,孵育10 min左右,消化完毕收集消化液并继续注入PBS冲洗,将冲洗液一并收集至离心管,1000 r/min离心10 min,弃上清,用含20%胎牛血清的1640培养基重悬细胞,转移至细胞培养瓶中,置于5% CO2、37℃培养箱中静置培养,24 h后更换培养液,待细胞长至80%融合后进行传代。
1.2.2实验分组 将原代培养的HUVEC传至2~3代后取对数生长的细胞进行随机分组,各组均加入100 μmol/L的ox-LDL。ox-LDL培养组:不添加其他试剂;si-control组:加入不针对任何基因的siRNA进行对照转染;si-NFκB组:加入NFκB p65基因特异性siRNA进行阳性转染。
1.2.3细胞转染 转染前24 h将细胞按照1.5×105的浓度接种于6孔板,每孔加入2 ml无抗生素无血清的培养基,培养24 h,待细胞融合度达到60%~70%时进行转染。将siRNA与Lipofectamine 2000按1∶50比例混合,以siRNA终浓度40 pmol/L进行转染。
1.2.4Western blot鉴定NF-κB敲除效率 细胞转染48 h后,将细胞从培养箱中取出,去除培养液,加入细胞裂解液裂解细胞提取蛋白,BCA法测定各组蛋白总浓度并用PBS校准为相同浓度,将蛋白与适量蛋白上样缓冲液混匀,置于沸水中10 min,使蛋白变性,于电压60V进行电泳,待蓝色条带迁移至浓缩胶与分离胶交界处时,将电压调整为120V,继续电泳至蓝色条带迁移至玻璃板边缘,将蛋白质转移至硝酸纤维素薄膜,将膜置于5%脱脂奶粉封闭液中室温孵育1 h,将膜取出后置入兔抗人NFκB p65按照1∶500比例的稀释液中,4℃孵育过夜后,再将膜取出后置入山羊抗兔IgG按照1∶2000比例的稀释液中,室温孵育2 h。孵育完成后TBST洗膜,每次10 min,洗膜3次。洗膜后ECL化学发光成像系统曝光蛋白条带,采用Image J软件对目的蛋白条带和内参蛋白条带进行灰度值测量分析,鉴定NFκB敲除效率。
1.2.5MTT比色法测定细胞存活率 取对数生长期的HUVEC,制备成3×104/ml的细胞悬液,按每孔200 μl接种于96孔板,37℃、5%CO2培养箱孵育12 h,按1.2.2实验分组方法随机分为3个实验组,并加设正常对照组(用1640完全培养基正常培养HUVEC)、空白对照组(与实验平行,不加细胞只加培养液),继续培养48 h,每孔加入20 μl MTT溶液,37℃避光孵育4 h,吸弃上清液,每孔加入二甲基亚砜150 μl,轻微震荡,10 min后置于酶标仪上,于570 nm处以空白对照组调零,测实验组吸光度。细胞存活率=(实验组A570/正常对照组A570)×100%。
1.2.6胞内微量MDA的检测 取对数生长期的HUVEC,按照每孔1×105个细胞接种于6孔细胞培养板,37℃、5%CO2培养箱中培养,待细胞贴壁后按照1.2.2实验分组方法随机分为3个实验组,继续培养48 h后,吸弃培养液,每孔加入200 μl细胞裂解液,待细胞充分裂解后离心,取上清液测定各组胞内MDA含量。
1.2.7胞内SOD的检测 细胞接种、分组、裂解后取上清液步骤同1.2.6,测定各组胞内SOD含量。
2 结果
2.1各组NF-κB p65的敲除效率比较 si-NFκB组与其他两组比较,NFκB p65的表达量显著降低(F=99.73,P<0.01),其他两组相比差异无统计学意义(P>0.05)。见图1。
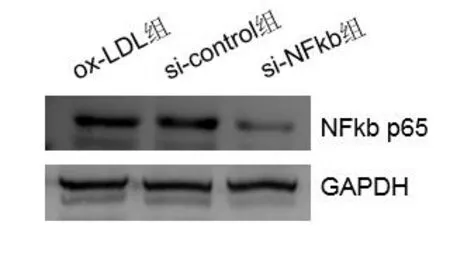

图1 siRNA转染HUVECs后NFκB蛋白的表达水平
2.2各组细胞存活率、MDA及SOD的比较 三组细胞存活率、MDA及SOD含量比较均有统计学意义。两两比较显示,si-NFκB组细胞存活率及SOD含量均高于其他两组(P<0.05),MDA低于其他两组(P<0.05);其他两组间各指标比较无统计学意义(P>0.05)。见表1。
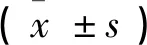
表1 三组细胞存活率、MDA及SOD的比较
3 讨论
近年来,大量研究表明,血管EC损伤在AS的发生发展中起重要作用,血管EC的凋亡是AS发生发展的始动环节[1]。血管壁内沉积的ox-LDL可诱导巨噬细胞形成泡沫细胞,触发炎症反应,是AS形成过程中的关键因子[1-2],同时有大量研究指出,ox-LDL可通过诱导细胞内氧化应激和内质网应激导致EC凋亡,ox-LDL在血管EC损伤过程中起重要作用[3-4]。
本研究设计构建了靶向干扰NFκB的siRNA,采用脂质体转染的方法将其导入ox-LDL诱导的HUVEC,结果显示:si-NFκB组能明显下调细胞NFκB的表达,而其他两组相比无明显差异,表明构建的靶向干扰NFκB的siRNA具有较高的特异性及干扰效率。本研究通过靶向干扰ox-LDL诱导的HUVEC NFκB的表达,发现靶向干扰NFκB能显著提高ox-LDL诱导的HUVEC的存活率,表明靶向干扰NFκB对ox-LDL氧化损伤的HUVEC起到保护作用。
MDA是自由基导致的过氧化物,MDA含量的测定可以直接反映细胞遭受氧化应激损伤的程度。SOD可以清除细胞内活性氧物质,对抗并阻断氧自由基对细胞造成的损害,通过检测细胞内SOD变化可以反映细胞遭受氧化应激的水平[5]。因此,SOD与MDA含量的测定相互配合可间接反映细胞抗氧化的能力及被氧化程度。本研究结果显示:靶向干扰NFκB能显著降低ox-LDL诱导的HUVEC的MDA的含量,并显著提高胞内SOD的含量。
综上所述,靶向干扰NFκB的表达有望在分子水平上为AS的防治提供新的思路和靶点,为在分子水平上对该病的临床治疗提供理论依据。

