外源GB 对盐胁迫下2 种黄芪种子萌发及幼苗抗氧化酶的影响
韩多红,王恩军,张 勇
(1.河西学院生命科学与工程学院,甘肃 张掖 734000;2.甘肃省河西走廊特色资源利用省级重点实验室,甘肃 张掖 734000)
0 引言
【研究意义】土壤盐渍化已成为当前全球极其重要的农业与环境问题,全球20%的耕地和33%的灌溉农田受到土壤盐分的影响,加上生产中不合理灌溉和过度施肥等农业措施也进一步加剧土壤次生盐渍化[1]。甜菜碱(Glycinebetaine, GB)属于季铵型水溶性生物碱,是一种生理抗盐剂,通过生理调节作用减缓由于盐胁迫对植物造成的伤害,以达到提高植物耐盐性的目的,对植物维持呼吸作用和光合作用的正常进行也具有重要的生理意义[2]。因此,利用外源GB 诱导植物产生抗逆性是提高植物抵御不良环境的有效方法,对增强农作物的耐盐性具有重要的意义。【前人研究进展】研究表明,盐渍条件下,植物体内会发生渗透胁迫,导致细胞氧化损伤和膜系统伤害[3-5]。外源甜菜碱(GB)的添加,可有效调节植物光合作用生理过程,促进幼苗生长,缓解低温造成的氧化损伤,提高植物的抗盐性[6-9]。目前,对黄芪的研究大多集中在栽培、药用成分、药理作用等方面[10-12]。【本研究切入点】在盐胁迫条件下,外源GB 对黄芪盐分调控效应的研究未见报道。【拟解决的关键问题】本研究以蒙古黄芪和膜荚黄芪为材料,研究在盐胁迫下其种子萌发和幼苗抗氧化酶代谢的变化规律,并分析2 种黄芪耐盐性的差异性,探讨盐胁迫下外源GB 对植物的调控机制,为黄芪在河西走廊大片盐碱化土地上的栽培提供依据和参考。
1 材料与方法
1.1 试验材料
黄芪种子由甘肃省张掖市民乐诚泰药业有限公司黄芪种植基地提供,经河西学院张勇教授鉴定为蒙古黄芪Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao 和 膜 荚 黄 芪Astraglus membranaceus(Fisch.)Bge.的干燥成熟种子。试验于2019 年5 月在河西学院生命科学与工程试验中心进行。
1.2 试验方法
1.2.1 种子萌发指标的测定 选择籽粒饱满的种子用64% H2SO4处理4 min 破除硬实,清水冲洗30 min后,用2% NaClO 消毒5 min,蒸馏水冲洗干净。设置6 个处理:CK1(蒸馏水)、CK2(100 mmol·L-1NaCl )、T1(100 mmol·L-1NaCl + 10 mmol·L-1GB)、T2(100 mmol·L-1NaCl+ 20 mmol·L-1GB)、T3(100 mmol·L-1NaCl+ 30 mmol·L-1GB)、T4(100 mmol·L-1NaCl + 40 mmol·L-1GB )。依照国际种子检验规程,发芽床试验采用滤纸法,每处理1 个培养皿,重复3 次,共18 个培养皿。每个培养皿中垫有两层滤纸,在不同处理的培养皿中分别加入相应的处理液6 mL。供试种子先破除硬实后置于培养皿中,每个培养皿放入50 粒种子,置于恒温培养箱中,设定温度25 ℃、光照时间10 h、光照强度2 000 lx。每天统计种子萌发数,第3 d 计算发芽势(GV),第7 d 计算发芽率(GR)、发芽指数(GI)、活力指数(VI)和相对盐害率。
GV= 3 d 内正常发芽种子数/全部供试种子数×100%
GR= 7 d 内正常发芽种子数/全部供试种子数×100%
GI= Σ (Gt/Dt)
式中,Gt为浸种后t日的发芽数;Dt为相应发芽日数。
VI=S×GI
式中,S为平均鲜重。
相对盐害率=[(CK1发芽率-胁迫处理发芽率)/CK1发芽率]×100%
1.2.2 幼苗生理指标的测定 选取经64% H2SO4破除硬实处理后的黄芪种子,放入25 ℃的恒温培养箱中浸种催芽,待种子露白后播种于装有蛭石的育苗钵内,6 个处理,每处理3 个育苗钵,每育苗钵内播种30 粒种子,用1/4 Hoagland 培养液进行浇灌,在幼苗2 叶期时定苗,每钵留生长一致的幼苗15 株,3 个重复。在第51 d 后进行处理:每天每钵分2 次根施5 mL 的处理液,7 d 后测定保护酶活性。超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性参照陈建勋等[13]的方法测定;抗坏血酸过氧化物酶(APX)活性、谷胱甘肽还原酶(GR)活性、脱氢抗坏血酸还原酶(DHAR)活性参照段九菊等[14]的方法测定。
1.3 数据处理
试验数据以平均值±标准误表达,应用SPSS16.0统计分析软件进行单因素方差分析(one-way ANOVA)和LSD法(a=0.05)多重比较,Origin8.0 绘图。
2 结果与分析
2.1 外源GB 对盐胁迫下黄芪种子萌发指标的影响
由表1 看出,CK2(盐胁迫对照处理)2 种黄芪种子发芽率、发芽势、发芽指数和活力指数均较CK1(纯水对照处理)明显降低,相对盐害率均达62%以上。CK2与CK1相比,蒙古黄芪的发芽率降低65.58%,膜荚黄芪降低64.50%。在盐胁迫下添加外源GB 浓度为10~30 mmol·L-1(T1、T2、T3)情况下,随着外源GB 浓度增大,2 种黄芪的各项发芽指标总体呈升高的趋势,相对盐害率呈下降趋势;当盐胁迫下的外源GB 浓度为40 mmol·L-1(T4)时则各项发芽指标显著下降,相对盐害率显著上升。T3处理的各项发芽指标均达到最大值,与CK2处理相比,蒙古黄芪的发芽率(GR)、发芽势(GV)、发芽指数(GI)和活力指数(VI)分别升高159.07%、341.28%、189.25%和184.62%,膜荚黄芪分别升高167.01%、372.41%、210.10%和200.00%,蒙古黄芪和膜荚黄芪的相对盐害率分别较CK2降低74.38%和76.18%。

表1 外源GB 对盐胁迫下黄芪种子萌发的影响Table 1 Effect of GB on seed germination of A.membranaceus under salt stress
2.2 外源GB 对盐胁迫下黄芪幼苗抗氧化酶活性的影响
由图1 可知,不同品种的纯水对照处理(CK1),膜荚黄芪幼苗SOD、POD 和CAT 活性均比蒙古黄芪高;盐胁迫对照处理(CK2)的2 个黄芪品种(蒙古黄芪和膜荚黄芪)的SOD、POD 和CAT活性均有升高,分别比CK1提高18.34%和22.23%、12.41%和13.63%、31.65%和33.72%,且2 种黄芪的POD、CAT 活性均与CK1差异显著(P<0.05)。盐胁迫下添加外源GB 的4 个处理(T1、T2、T3、T4),2 种黄芪幼苗SOD、POD 和CAT 活性均呈先上升后下降的趋势,T3达到最大值。T3处理的SOD、POD 和CAT活性,蒙古黄芪分别较CK2提高41.23%、89.15%和50.67%,膜荚黄芪分别较CK2提高42.92%、91.44%和53.41%,差异均达显著水平(P<0.05)。表明外源GB 可显著提高黄芪幼苗在盐胁迫下的SOD、POD和CAT 活性,且膜荚黄芪的提高幅度大于蒙古黄芪。
由图2 可知,盐胁迫对照处理(CK2)的2 种黄芪APX、GR 和DHAR 活性均比纯水对照处理(CK1)大幅度下降,两者存在显著性差异(P<0.05)。盐胁迫下添加外源GB 的4 个处理(T1、T2、T3、T4),2 种黄芪幼苗的APX、GR 和DHAR 活性均呈先上升后下降的趋势,在T3处理达到最大值,T4处理出现下降。与CK2相比,T3处理的APX、GR 和DHAR活性,膜荚黄芪分别提高323.02%、139.38%和109.92%,蒙古黄芪分别提高343.23%、167.25%和111.01%,差异均达显著水平(P<0.05)。表明外源GB 可显著提高黄芪幼苗在盐胁迫下的APX、GR和DHAR 活性,且外源GB 对膜荚黄芪的盐胁迫缓解效果优于蒙古黄芪。
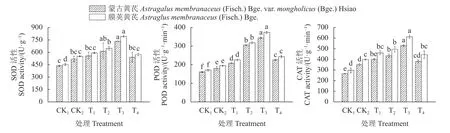
图1 外源GB 对盐胁迫下黄芪幼苗SOD、POD 和CAT 活性的影响Fig.1 Effects of GB on SOD, POD and CAT activities in A.membranaceus seedlings under salt stress

图2 外源GB 对盐胁迫下黄芪幼苗APX、GR 和DHAR 活性的影响Fig.2 Effects of GB on APX, GR and DHAR activities in A.membranaceus seedlings under salt stress
3 讨论与结论
3.1 外源GB 对盐胁迫下黄芪种子发芽指标的影响
植物最重要的繁殖器官是种子,因此植物种子在萌发阶段的耐盐状况可以反映该物种的耐盐能力[15]。本研究中,盐胁迫会导致2 种黄芪种子的发芽率等指标明显降低,相对盐害率大幅上升,但在添加外源GB(≤30 mmol·L-1)后,发芽率等指标均出现升高,表明外源GB 可有效缓解盐胁迫对种子萌发造成的抑制作用。在盐胁迫处理下,蒙古黄芪种子的发芽率等指标降幅较大;在外源GB 处理后,膜荚黄芪的发芽率等指标增幅较大,表明膜荚黄芪种子对盐胁迫的耐受性和调控响应性均高于蒙古黄芪。
3.2 外源GB 对盐胁迫下黄芪幼苗抗氧化酶活性的影响
盐胁迫可引起植物体内产生活性氧簇(ROS),由于ROS 的增加,细胞中抗氧化酶(SOD、POD、CAT 和APX 等)活性都会有所升高以清除产生的ROS[16]。逆境中保护酶活性会增强或维持较高的水平,才能清除活性氧自由基使之保持较低水平,以防止自由基对生物膜结构和功能的破坏[17]。SOD 能催化O2-发生歧化反应产生H2O2和O2,H2O2随后主要 被POD、CAT 和AsA-GSH 循环清除,APX 在AsA-GSH 循环中清除H2O2起着关键作用, 而MDHAR、DHAR 和GR 主要通过影响AsA 和GSH 的再生,为APX 清除H2O2提供底物[18]。本研究中,盐胁迫下,2 种黄芪幼苗中的SOD、CAT、POD 活性出现小幅度的升高,但APX、GR 和DHAR 的活性出现显著下降;在外源GB(≤30 mmol·L-1)处理后,SOD、POD和CAT,以及AsA-GSH 循环的关键酶APX、GR 和DHAR 活性均出现升高。这表明,黄芪幼苗可通过调节自身SOD 等酶的活性来抵御盐胁迫伤害,外源GB 可有效提高抗氧化酶的活性,缓解盐胁迫伤害,这可能是由于外源GB 可作为辅因子参与Ca2+-CaM信号转导途径, 调控相关蛋白表达所致。同样在经外源GB 处理后,膜荚黄芪的抗氧化酶活性高于蒙古黄芪,说明品种之间存在差异性。
综上所述,盐胁迫会对黄芪种子的萌发和幼苗生长造成伤害,添加外源GB 可有效缓解盐胁迫的伤害,本试验适宜的添加浓度为30 mmol·L-1。2 种黄芪品种相比较,膜荚黄芪的耐盐性及对外源GB 调控的响应性强于蒙古黄芪。因此,在干旱多盐碱的河西走廊种植区,可通过适宜浓度的外源GB 调节来提高黄芪的耐盐性,并根据实际情况选择合适品种种植,以减轻盐胁迫对植物生长发育的影响。

