别嘌呤醇对慢性间歇性缺氧大鼠肾损伤的保护作用
杜 艺 梁 顺 魏玉婷 柯剑婷 裴雪峰
1.中山大学附属第五医院肾内科,广东珠海 519000;2.广东省粤北人民医院内分泌科,广东韶关 512000
阻塞型睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是指在睡眠状态下上气道塌陷阻塞所致的呼吸反复暂停或低通气,伴有呼吸中枢神经调节因素障碍的疾病[1]。OSAHS是临床常见疾病之一,中年人患病率为2%~4%,儿童为2%~4.8%[2],同时OSAHS 是高血压与冠心病等常见心脑血管疾病的重要致病因素[3]。慢性间歇性缺氧(chronic intermittent hypoxia,CIH)是造成OSAHS患者器官损害的机制之一[4],近年来对OSAHS相关的肾损伤研究也愈来愈重视。既往对OSAHS的治疗研究重点多集中在外科手术,近年来对于内科药物的辅助治疗也愈加深入。本研究通过模拟CIH 致肾损伤大鼠,采用别嘌呤醇(allopurinol,ALLO)对其进行干预,观察ALLO 对CIH 大鼠肾脏损伤的保护作用。
1 材料与方法
1.1 材料和仪器
ALLO(上海信谊万象药业股份有限公司),蛋白浓度测定试剂盒(Thomo公司,美国),Western 及IP 裂解液、PMSF (南京建成生物工程研究所),β-actin抗体(Sigma公司,美国),黄嘌呤氧化酶(xanthine oxidase,XO)抗体(山羊多克隆抗体,Santa公司,美国),HRP-IgG(CST公司,美国),ECL 发光液(北京酷来搏科技有限公司)。超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)Assay 试剂盒(南京建成生物工程研究所),ELISA 试剂盒(购于上海铭睿生物科技有限公司),慢性间歇性缺氧/再氧合动物舱(广州市华粤仪器有限公司)。
1.2 建立动物模型
健康雄性Wistar 大鼠40只,8周龄,体重180~200 g,由中山大学实验动物中心提供,饲养于我院实验动物中心。所有大鼠适应性饲养3 d,自由饮水饮食,饲养环境温度19~23℃,空气湿度为50%~60%。采用随机数字表法将其分为正常对照组(10只)、模型组(30只),模型组又随机分为模型对照组、ALLO小剂量组、ALLO大剂量组,各10只。
在大鼠适应期后,ALLO分别按40 mg/(kg·d)、20 mg/(kg·d)溶于2 ml 生理盐水搅拌均匀后灌胃;模型对照组生理盐水同等剂量灌胃,同时开始CIH模型建立。建模方法:根据N2稀释原理,循环充入N2和O2,每1个循环为9 min,4 min 充入N2,随之5 min 充入O2,使箱内氧浓度在6%和21%切换;由测氧仪监测间歇性低氧舱中的氧浓度,调节气体流量,使每1个循环间歇性低氧舱内的最低氧浓度达6%左右,持续45 s 左右,然后再逐渐恢复至21%。舱内N2和O2的转换通过定时电磁转换器完成,该循环每天重复8 h,共14 d,最终建立间歇性低氧大鼠模型[5-6]。每天上午8点至下午4点将模型组放置于间歇性缺氧舱内。在实验过程中将整个实验舱罩上黑布,模拟夜晚大鼠睡眠环境,实验舱内及室内温度20~25℃,湿度45%~55%;实验结束后,所有大鼠均放置普通饲养笼中饲养且给予人工日光照射,模拟大鼠白天状态,大鼠全天活动及饮食自由。对照组大鼠放置无盖箱内常规饲养,不予任何处理。每天除实验时间外,所有大鼠放置相同自然环境下生活和饲养。
1.3 标本获取及检测
1.3.1 血清标本获取 造模且治疗14 d后,所有大鼠尾静脉采血,分离血清待测。ELISA 方法检测血清血管内皮生长因子(vascular endothelial growth factor,VEGF),放射免疫法测定胱抑素C(cystatin C,Cys-C)。
1.3.2 肾组织标本获取 10%水合氯醛麻醉大鼠,开腹暴露左右肾,行肾静脉注射PBS 液洗至肾苍白再将肾取出,取100 mg 肾皮质,加入1 ml 生理盐水后研磨成10%的匀浆,3000 r/min,离心10 min,取上清液应用比色检测试剂盒检测DOD、MDA水平,具体试验方法见产品说明书。
1.3.3 病理切片制作 4%多聚甲醛固定部分肾组织24 h后,梯度乙醇脱水,二甲苯透明,浸蜡,包埋,制备4 μm石蜡切片。常规HE 染色,中性树脂封片,光镜显微镜(×400)下观察分析肾脏组织病理变化。
1.3.4 Western blot 检测XO表达 以蛋白提取液裂解组织30 min,BCA 法测定蛋白浓度,加5×Buffer蛋白上样缓冲液煮沸10 min,使蛋白变性。各孔道上样50 μg 10% SDS-PAGE 凝胶,恒压电泳,后湿转至PVDF 膜。5%脱脂奶粉封闭1 h,加入一抗(XO 多克隆抗体1∶600),4℃孵育过夜,β-actin(1∶200)作为内参,TBST 洗膜3次。辣根过氧化物酶标记二抗(浓度1∶5000)室温孵育1 h,TBST 洗膜3次,ECL 发光液暗室胶片曝光。以β-actin 为内参,Quantity One 4.6.2 图像分析软件采集分析结果,计算XO 与β-actin 灰度比值作为相对表达量。
1.4 统计学方法
采用SPSS 21.0 统计软件分析处理数据,服从正态分布的计量资料用均数±标准差(±s)表示,正态分布且组间方差齐性采用方差分析,两两比较采用t 检验,采用Pearson 检测进行相关性分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 肾组织切片光镜观察
正常对照组肾小球、肾小管及肾小管间质未发现异常(图1A)。模型对照组肾组织切片可见肾小球体积增大、系膜细胞和基质显著增生,可见部分肾小球出现局灶性节段性硬化;肾小管局灶性片状扩张,上皮细胞可见空泡样变性(图1B)。ALLO小剂量组、ALLO大剂量组的肾小球肥大较模型组明显减轻,无肾小球硬化;上皮细胞空泡样变性消失(图1C、图1D)。
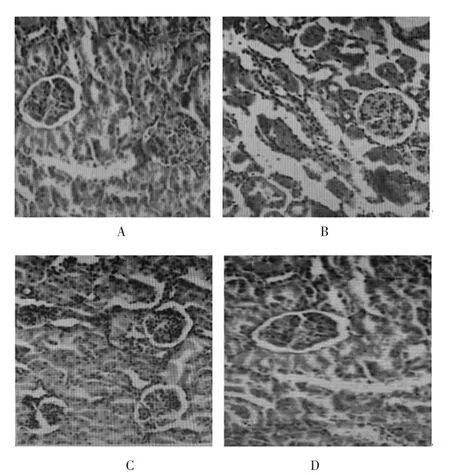
图1 肾组织切片光镜图(HE,400×)
2.2 各组血Cys-C、VEGF水平及肾组织SOD、MDA、XO水平表达的比较
模型对照组的血Cys-C、VEGF水平,肾组织MDA及XO表达水平高于正常对照组,肾组织SOD水平低于正常对照组,差异有统计学意义(P<0.01);模型对照组的血Cys-C、VEGF水平高于ALLO组,肾组织MDA、XO表达水平高于ALLO组,肾组织SOD表达水平低于ALLO组(P<0.01);ALLO大剂量组的肾组织MDA水平低于模型对照组、ALLO小剂量组,SOD水平高于模型对照组及ALLO小剂量组(P<0.05)。ALLO大剂量组与ALLO小剂量组的血Cys-C、VEGF水平及肾组织XO表达水平比较,差异无统计学意义(P>0.05)(表1)。
表1 各组血Cys-C、VEGF水平、肾组织SOD、MDA水平、XO表达的比较(±s)
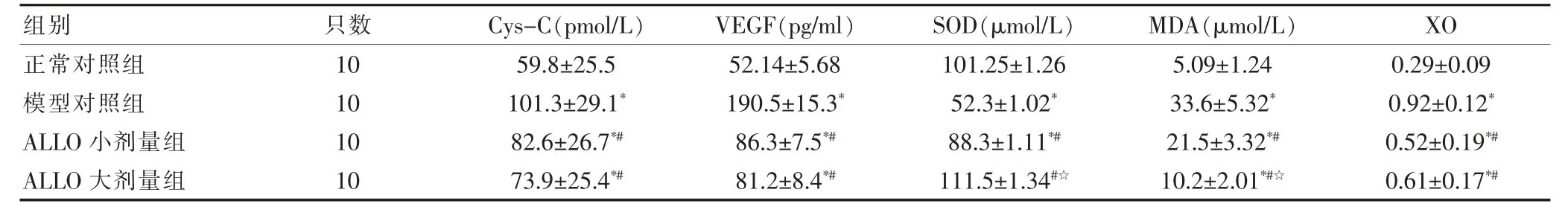
表1 各组血Cys-C、VEGF水平、肾组织SOD、MDA水平、XO表达的比较(±s)
与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.01;与ALLO小剂量组比较,☆P<0.05
组别 只数 Cys-C(pmol/L) VEGF(pg/ml) SOD(μmol/L) MDA(μmol/L) XO正常对照组模型对照组ALLO小剂量组ALLO大剂量组10 10 10 10 59.8±25.5 101.3±29.1*82.6±26.7*#73.9±25.4*#52.14±5.68 190.5±15.3*86.3±7.5*#81.2±8.4*#101.25±1.26 52.3±1.02*88.3±1.11*#111.5±1.34#☆5.09±1.24 33.6±5.32*21.5±3.32*#10.2±2.01*#☆0.29±0.09 0.92±0.12*0.52±0.19*#0.61±0.17*#
2.3 肾组织MDA水平与血VGEF 的相关性
Pearson分析结果显示,肾组织MDA水平与血VGEF 有相关性(r=0.65,P<0.05)。
3 讨论
OSAHS 主要表现为睡眠中出现完全或不完全的上气道阻塞或塌陷,导致短暂呼吸停止或明显低通气在睡眠过程中反复发生,进而引起夜间低氧血症、二氧化碳潴留与睡眠结构片段化等,渐进性地对人体各脏器产生损害[7],主要变现为高血压病、高脂血症、高胰岛素抵抗、肥胖、糖耐量异常、视神经非动脉炎性病变、心肌梗死、心力衰竭、哮喘和脑梗死等[8]。国内外大量研究发现,OSAHS 通过CIH 导致交感神经的异常兴奋、内皮功能的紊乱、氧化应激反应等引起肾脏功能损害[9],集中表现为肾功能改变、蛋白尿、多尿以及小管功能受损等[10]。持续气道正压(continuous positive airway pressure,CPAP)即用面罩将持续的正压气流送入气道,作为一种标准的无创治疗方式,其仍然是OSAHS患者的首选,对患者的肾脏功能损伤也具有明显的改善作用。但有关报道显示,在CPAP治疗过程中有一定比例的患者不能耐受、依存性差,舒适度不够,而且费用较高,长期使用者仅占40%[11-12]。因此,对药物减轻OSAHS 脏器功能损害的研究近年来就越来越受到重视。
ALLO 为XO 抑制剂,XO 在嘌呤新陈代谢中扮演重要角色,且是活性氧(reactive oxygen species,ROS)的主要内源性来源[13],在缺氧状态下其含量将会上升,从而引起氧化应激。ALLO 抑制XO 活性可以减少氧化应激,防止氧化应激引起的细胞损伤以及缺血性并发症得到验证。ALLO 能改善大动脉的顺应性及内皮细胞功能,减轻动脉硬化而不依赖于尿酸的降低[14]。一项来自英国的观察性研究显示,ALLO 治疗是改善慢性肾脏病患者动脉硬化的独立决定因素,并且有效地降低了外周血压、中心血压[15]。在慢性心力衰竭持续性缺氧时有报道ALLO 可以缓解XO 蛋白表达和活性均上调,减轻心脏和血管的氧化应激[16]。Hirsch等[17]报道,心力衰竭患者静脉输入ALLO后高能磷酸盐相对和绝对浓度均升高,增加了心力衰竭患者ATP的生成。ALLO 对慢性心力衰竭大鼠心功能的改善作用基于其在慢性心力衰竭持续性缺氧患者中的治疗作用,本研究通过建立CIH 大鼠模型,观察ALLO 处理后CIH 大鼠的氧化应激反应及肾功的变化、ALLO是否对OSAHS所致的CIH 状态的血管内皮功能有益,以期对临床OSAHS的药物治疗提供线索。
本实验中,经过间歇性缺氧处理后,模型对照组的血CysC 水平及肾组织的HE 染色均显示明确的肾脏受损,肾组织中SOD水平下降,MDA水平、XO表达上升,提示在CIH 下肾组织的氧化应激反应加重,XO 在缺氧状态下其含量将会上升,XO表达加强产生ROS 可以使肾组织细胞发生脂质过氧化,产生毒性终产物MDA[18],从而引起氧化应激,这与既往的研究结果(OSAHS患者体内存在氧化应激和抗氧化能力下降[19]引起肾脏组织的损伤)符合。本实验中,模型对照组大鼠出现明显的氧化应激反应伴肾损伤,同时有VEGF水平的上升。VEGF 是体内广泛存在的一种调节性蛋白质,高度特异性地作用于血管内皮细胞可促进血管内皮细胞分裂、增殖、细胞质钙聚集以及血管生成的作用,在肺、肾脏、肝脏、脑和脾脏中含量丰富[20]。在肾脏中,VEGF 主要表达在肾小球足细胞,远曲小管和集合管也有少量表达在近曲小管[21]。缺血缺氧是VEGF表达水平升高的强烈诱导因素[22],模型对照组大鼠明显的VEGF 上升说明CIH时出现血管内皮的损伤,VEGF 与肾小球基底膜有高度的亲和力,能使基底膜的通透性增加,并促进一氧化氮、内皮素的产生,从而改变肾脏的血流动力学,导致蛋白尿的产生,损害肾功能[23]。文献证实,ALLO 这种抗氧化剂对中重度OSAHS患者内皮细胞损伤有改善的作用,与本实验相符[24],同时本实验也发现MDA水平与VGEF 有相关性(r=0.65,P<0.05)。
本实验中,ALLO两组大鼠给予不同剂量的ALLO 干预后与模型对照组比较,血VEGF水平减低,肾组织中SOD水平上升,MDA水平下降,XO 的表达减少进而肾损伤减轻。但ALLO大剂量组和ALLO小剂量组只在肾组织MDA、SOD水平方面有差异,在血VGEF水平和XO 的表达方面并未发现显著性差异,提示ALLO 对CIH 大鼠的氧化应激有抑制作用,同时可以降低血VGEF水平,但增大别嘌醇的剂量对XO的表达、血VGEF水平并未发挥作用。
因此,ALLO 对CIH 大鼠的氧化应激反应有抑制作用且随剂量的加大作用更加显著,同时ALLO 对CIH 大鼠的血VGEF水平有抑制作用,ALLO 可以减轻CIH 大鼠的肾损伤,CIH 大鼠的肾损伤可能与氧化应激及VGEF 有关,ALLO 可以作为OSAHS 肾损伤治疗药物的一个选择做进一步的研究。

