抽提透刺法对脑梗死模型大鼠脑的保护机制及对CXCL12-CXCR4信号通路的作用研究*
王磊磊,胡方梅,陈 华,孙金鹏,刘国华,崔友祥
河北省沧州中西医结合医院(沧州 061001)
脑梗死(Cerebral infarction,CI) 是中老年人常见的缺血性脑血管病,一般急性起病,并迅速表现为局限性或弥漫性的神经功能缺损症状,是引起人类死亡和残障的重要原因之一[1-3]。神经系统本身具有可塑性,若能采用手段促进脑梗死后神经组织修复和功能重建[4],对于减轻后遗症状有重要意义。
针刺在脑梗死的治疗中应用已久,尤其在后期康复治疗中,取得了显著疗效[5]。本实验通过观察抽提透刺法对脑梗死模型大鼠神经功能的影响,该疗法能够提高脑梗死大鼠缺血区微血管密度,可上调大脑皮质CXCL12、CXCR4蛋白表达,为抽提透刺法治疗脑梗死提供了理论支持。
材料与方法
1 实验动物 健康雄性SD大鼠56只,清洁级,周龄6~7周,体重260~300 g,平均(282.74±8.74)g,由武汉大学动物实验中心提供,动物许可证号:SCXK(鄂)2014-0004。所有大鼠每笼5只置于饲养室内进行为期1周的适应性饲养,室温控制在22~25 ℃之间,相对湿度控制在50%~60%,避免噪音、强光刺激,明暗周期为12 h∶12 h,饲以标准饲料和纯净水,大鼠在笼内自由活动及进食饮水,定期清扫鼠笼、更换垫料及消毒。
2 主要药物、试剂与仪器 脑蛋白水解物注射液,规格:每支2 ml,批号:20170723。大脑中动脉栓塞(MCAO) 线栓,购自深圳市瑞沃德生命科技有限公司。VECTASTAIN@ ABC免疫组化试剂盒,购自上海桑戈生物科技有限公司;二氨基联苯胺(DAB)试剂盒,购自上海嵘崴达实业有限公司;大鼠VEGF、基质金属蛋白酶-9(MMP-9)酶联免疫分析(ELISA)试剂盒,购自上海信帆生物科技有限公司;二奎琳甲酸(BCA)法蛋白定量试剂盒,购自北京纽朴生物技术有限公司;十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶制备试剂盒,购自南京巨禄生物科技有限公司;兔血管内皮生长因子(VEGF)多克隆抗体、生物素标记山羊抗兔免疫球蛋白G(IgG)、CXC趋化因子配体12(CXCL12)、CXC趋化因子受体4(CXCR4)、肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG,购自北京冬歌博业生物科技有限公司。
G-L型离心机,德国IKA公司产品;Elisys Duo型全自动酶免分析仪,胡曼诊断产品(北京)有限公司生产;DM4000M型光学显微镜,德国Leica公司产品; Agaro Power型电泳仪,柏业贸易(上海)有限公司产品;Gel Doc EZ型凝胶成像分析系统,美国BIO-RAD公司产品。
3 动物分组及干预方法
3.1 模型建立:经过适应性饲养后,将所有大鼠编号,之后按随机数字表法分为对照组14只及造模组42只。称重后,采用10%水合氯醛35 mg/kg腹腔注射麻醉大鼠,仰卧位固定于手术台上,颈前部常规进行备皮、消毒,取颈正中2 cm切口,逐层切开并分离筋膜、腺体组织,暴露并分离右侧颈总动脉、颈外动脉及颈内动脉;造模组采用微动脉夹夹闭右颈总动脉,使颈外动脉游离,用电凝笔电凝颈外动脉分支,于右颈总动脉分叉附近5 mm处将右颈总动脉结扎、离断;暴露颈内动脉,采用微动脉夹夹闭其分支(翼腭动脉);于颈外动脉残端开口,插入线栓至颈内动脉颅内大脑前动脉,闭塞大脑中动脉开口;剪去尾部多余线栓,除掉微动脉夹,对伤口进行消毒后逐层缝合;对照组手术操作与造模组相同,但只分离血管,不插线栓。术后常规采用青霉素防止感染。术毕1 d,大鼠右侧肢体疼痛回缩反应迟钝、消失,右侧上肢在提尾倒悬时无法前伸,爬行时偏向右侧即为脑梗死模型建立成功;造模过程中出现死亡或者造模失败情况,及时补齐大鼠[5]。
3.2 分组及给药:将造模成功大鼠随机分为模型组、针刺组及药物注射组,各14只。模型建立24 h后,模型组及对照组分别给予生理盐水10 ml/kg,腹腔注射,1次/d;针刺组根据实验大鼠针灸俞穴图谱及针刺手法中的方法,取大鼠的百会透刺双侧曲鬓,使用抽提手法,幅度为0.1~0.2 cm,行针30 s,留针30 min,1次/d;药物注射组给予脑蛋白水解物注射液10 ml/kg,腹腔注射,1次/d。各组大鼠均干预14 d。
4 观察指标及方法
4.1 神经功能评价: 末次给药第2天,参照改良Longa评分评估大鼠的神经功能,评分标准:未见神经功能缺损记为0分;左侧前肢无法伸展完全记为1分;左侧前肢屈曲记为2分;大鼠运动时轻度偏向左侧转圈记为3分;大鼠运动时严重偏向左侧转圈记为4分;大鼠运动时向左侧跌倒记为5分。得分越高,表明大鼠的神经功能缺陷越严重。
4.2 标本采集与处理:完成神经功能评价结束后,采用10%水合氯醛35 mg/kg腹腔注射麻醉大鼠,打开腹腔,自腹主动脉取血5 ml,以3000 r/min速度离心10 min,分离血清,保存于-2 ℃冰箱内备检;横断颈部处死大鼠,打开颅腔,小心取出脑组织,取1/2缺血侧脑组织采用4%多聚甲醛固定,常规经梯度浓度乙醇脱水、二甲苯透明、石蜡包埋、切片,制备厚度为5 μm的组织切片;剩余1/2缺血侧脑组织经液氮速冻,置于-70 ℃冰箱内保存,以用于后续蛋白质免疫印迹(Western blot)检测。
4.3 免疫组化法检测脑组织微血管密度:取脑组织石蜡切片,经二甲苯脱蜡、梯度浓度乙醇复水后,微波炉高火5 min、中10 min行抗原修复,3%过氧化氢30 min阻断内源性过氧化物酶,之后用稀释血清内室温封闭20 min;用VEGF多克隆抗体(1∶200稀释)4 ℃孵育16 h,然后用生物素标记山羊抗兔IgG工作液室温孵育30 min,依次采用免疫组化试剂盒染色30 min,DAB试剂盒显色;经复染、梯度浓度乙醇脱水后,中性树胶封片。在光学显微镜下从热点(棕黄色阳性细胞密集处)内随机选择不重复的5个100倍视野,于400倍镜下计数新生血管数目。新生血管判定标准:每个棕黄色的内皮细胞或内皮细胞簇记为一条微血管,形成管腔者直径需≤8个红细胞直径。微血管密度(MVD)=热点内微血管数目/4。
4.4 ELISA法检测血清VEGF、MMP-9水平:取冻存的血清,迅速融化恢复至室温,按照ELISA试剂盒说明书进行操作,采用Elisys Duo型全自动酶免分析仪,测定血清VEGF、MMP-9水平。
4.5 Western blot法检测大脑皮质CXCL12、CXCR4蛋白表达水平:取冻存的大脑皮质组织,加入预冷的RIPA制备匀浆,4 ℃下,12000 r/min离心30 min,采用BCA试剂盒确定上清液蛋白浓度;配制好的SDS-PAGE凝胶置于电泳槽内;取蛋白样本30 μg,与上样缓冲液混合,100 ℃变性5 min后加样;电泳至溴酚兰跑至电泳槽底部时停止,将凝胶上目的蛋白转至聚偏氟乙烯(PVDF)膜上;PVDF膜浸入封闭液室温封闭2 h,然后浸入CXCL12(1∶1000稀释)、CXCR4(1∶1000稀释)一抗工作液及内参β-actin(1∶1000稀释)内,4 ℃摇床孵育16 h;取出、洗涤后浸入二抗工作液(1∶10000稀释),室温孵育2 h;采用ECL试剂盒化学发光,于暗室内X线胶片曝光、定影。采用Gel Doc EZ型凝胶成像分析系统采集图像,Image pro plus 6.0软件分析各蛋白条带灰度值,计算CXCL12、CXCR4蛋白与内参β-actin灰度值的比值。
5 统计学方法 所有统计数据采用SPSS 22.0统计学软件分析,计量资料以均数±标准差表示,用LSD-t检验。P<0.05表示差异具有统计学意义。
结 果
1 各组大鼠神经功能评分比较 见表1。与对照组比较,模型组大鼠神经功能评分明显降低,差异有统计学意义(P<0.05)。与模型组比较,针刺组及药物注射组大鼠神经功能评分均较低,且针刺组低于药物注射组,差异有统计学意义(P<0.05)。

表1 各组大鼠神经功能评分比较(分)
2 各组大鼠脑组织MVD比较 见表2。免疫组化染色结果显示,VEGF标记的血管内皮细胞胞质被染成棕黄色,在缺血区周围集中分布(图1)。定量分析显示,与对照组比较,模型组大鼠脑组织MVD明显升高,差异有统计学意义(P<0.05)。与模型组比较,针刺组及药物注射组大鼠脑组织MVD均较高,且针刺组高于药物注射组,差异有统计学意义(P<0.05)。

表2 各组大鼠脑组织MVD比较(个)
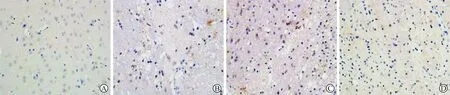
A:对照组;B:模型组;C:针刺组;D:药物注射组 图1 各组大鼠脑组织MVD观察(免疫组化染色,×400)
3 各组大鼠血清VEGF、MMP-9水平比较 见表3。免疫组化染色结果显示,与对照组比较,模型组大鼠血清VEGF、MMP-9水平明显升高,差异有统计学意义(P<0.05)。与模型组比较,针刺组及药物注射组大鼠血清VEGF、MMP-9水平均较高,且针刺组高于药物注射组,差异有统计学意义(P<0.05)。

表3 各组大鼠血清VEGF、MMP-9水平比较
4 各组大鼠大脑皮质CXCL12、CXCR4蛋白相对表达水平比较 见表4(图2)。免疫组化染色结果显示,与对照组比较,模型组大鼠大脑皮质CXCL12、CXCR4蛋白相对表达水平明显升高,差异有统计学意义(P<0.05)。与模型组比较,针刺组及药物注射组大鼠大脑皮质CXCL12、CXCR4蛋白相对表达水平均较高,且针刺组高于药物注射组,差异有统计学意义(P<0.05)。

表4 各组大鼠大脑皮质CXCL12、CXCR4 蛋白相对表达水平比较
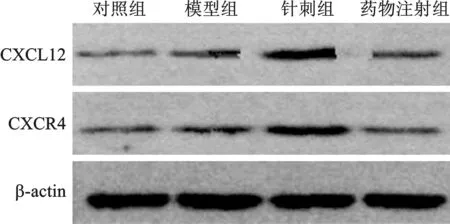
图2 Western blot法检测各组大鼠大脑皮质 CXCL12、CXCR4蛋白相对表达结果
讨 论
近年来,由于生活水平提高、饮食习惯改变,社会步入人口老龄化等原因,脑梗死的发病率呈现不断上升趋势,已经成为重要的社会公共健康问题。脑梗死是由多种因素引起的一种十分复杂的级联损伤反应,发病初期由于血管阻塞,缺血区神经细胞绝大部分功能丧失而并未全部坏死,随着缺血时间延长,缺血中心部分神经细胞进一步坏死形成不可逆的梗死灶;而梗死灶周围缺血半暗带区仍有少量血供残留,该区内神经细胞多受到可逆性损伤,若能尽早建立侧支循环,恢复血供,对于挽救缺血半暗带、促进神经细胞损伤修复及改善预后有重要意义[6-8]。中医认为,该病属于“中风”范畴,针刺治疗的历史悠久且疗效确切。针刺的种类繁多,其中以头穴针刺最为常见。田亮等[9]总结认为,头穴针刺治疗中风的机制包括:扩张血管,改善脑组织血液循环以及能量代谢;调节神经生长因子表达水平,加速神经干细胞增殖、分化,提高神经功能;抑制兴奋性氨基酸水平和毒性,减少神经损伤;抑制炎性免疫反应;改善脂质代谢,清除氧自由基;抑制神经细胞凋亡等等。但是上述机制也并不完全,仍需进一步研究探讨。
在本次研究中,我们采用线栓法建立的脑梗死模型大鼠,结果发现,模型组大鼠神经功能评分明显高于对照组,提示成功建立脑梗死模型;之后采用抽提透刺法对模型大鼠进行治疗,取穴为百会透双侧曲鬓,于学平等[10]研究认为,百会透刺曲鬓穴对于脑微血管纤维连接蛋白的表达有促进作用,减轻脑缺血再灌注相关的组织损伤。本次治疗后,针刺组及药物注射组大鼠神经功能评分低于模型组,且针刺组小于药物注射组,表明抽提透刺法确实有效改善了脑梗死模型大鼠的神经功能,发挥脑保护作用。
微血管生成对于缺血区脑组织侧支循环建立具有重要意义,有助于减轻梗死区周边神经细胞损伤,控制病情进展,也有利于神经细胞修复[11-12]。本次研究发现针刺组及药物注射组大鼠脑组织MVD均高于模型组,且针刺组高于药物注射组,提示抽提透刺法能有效增加脑梗死模型大鼠脑组织微血管密度,促进侧支循环建立,与相关报道一致[13-14]。而关于其具体的作用机制,可以从CXCL12-CXCR4信号通路及其相关因子方面进行探讨[15-17]。CXCL12属于CXC趋化因子超家族成员,CXCR4则为受体,二者在多种细胞和组织中表达,结合后可通过耦联的G蛋白等转化为生物信号,参与细胞增殖、分化、血管及神经生成等多种过程[18-20]。有研究认为,CXCL12-CXCR4在血管修复和再生过程中起到重要的促进作用[21]。CXCL12对于MMP-9的表达有上调作用,而MMP-9可以加速细胞外基质降解和重组,促进血管生成;此外,CXCL12- CXCR4具有血管刺激作用,能够促进VEGF表达,VEGF是已知最强的特异性促血管生成因子,其能促进血管内皮细胞增殖,启动脑梗死后血管新生。又有研究称,补充VEGF有助于脑梗死大鼠梗死区周边血管新生和神经功能恢复[22]。本次研究结果显示,与模型组比较,针刺组及药物注射组大鼠血清VEGF、MMP-9水平较高,大脑皮质CXCL12、CXCR4蛋白表达水平较高,且针刺组高于药物注射组,表明抽提透刺法能促进脑梗死模型大鼠脑组织CXCL12-CXCR4信号通路激活,上调血管生成相关因子VEGF、MMP-9水平,这可能是抽提透刺法促进微血管形成,加速神经损伤修复,保护脑组织的作用机制之一[23]。
综上所述,抽提透刺法能有效改善脑梗死大鼠神经功能,提高缺血区微血管密度,其脑保护作用可能与上调CXCL12-CXCR4信号通路相关蛋白表达有关。

