红茶菌发酵罗城毛葡萄13种有机酸的同时检测
郝俊光,陈婉玲,杨 丽,陈霜梅,梁振荣,银 书,祁 岑,*(.北部湾大学钦州市特色果蔬发酵重点实验室,广西钦州 5350;.广西天龙泉酒业有限公司,广西河池 546400)
罗城毛葡萄2016年获国家农产品地理标志认证,其富含氨基酸、维生素、硒、锶、锌、白藜芦醇等营养物质,酸甜适中,具有良好的酿造加工性状[1]。2019年毛葡萄的种植面积达8万亩,产量1.5万吨,已成为当地支柱产业[1],有利于贫困农民脱贫和石漠化土壤改良。丰产后的毛葡萄暴露出了加工销售能力弱、产业链单一的问题,因此需拓宽深加工能力、寻求多样化应用[1]。传统的红茶菌饮料是利用酵母菌、醋酸菌等天然共生菌群发酵茶糖水而制成的民间饮料,其源于中国,经日本和俄罗斯向全球传播[2-3],其保健作用备受各国人民的关注。目前人们对红茶菌的发酵机理[4-6]、抗菌作用[7]、保健机理[8-9]、微生物组成[3,10-11]等进行了系列的研究,从中鉴定出茶多酚、葡萄糖醛酸、葡萄糖酸、D-葡萄糖二酸-1,4内酯等有益成分[4-5,9],证明了其具有抗癌[7]、护肝[8-9]、抗炎症[10-12]、防治糖尿病[12-13]等功效。当前红茶菌产品不再局限于茶叶发酵饮料,已扩展至对咖啡[14]、谷物[15-16]、水果[17-19]等的开发应用,但尚未应用到毛葡萄,这为毛葡萄的深加工提供了新思路。
红茶菌类产品是酸性的,主要有机酸是葡萄糖酸、葡萄糖醛酸、乙酸等[20-22]。相关研究多用pH或总酸表征其酸性特征[22-23],即便涉及有机酸也仅限乙酸、琥珀酸、柠檬酸、葡萄糖酸等[17,21-22],检测有机酸的种类偏少,不能用于多种有机酸组成变化的同时检测。建立包括葡萄糖醛酸、葡萄糖酸、抗坏血酸等多种有机酸的同时检测技术,有益于红茶菌类产品的开发和品控。有机酸的测定方法主要包括气相法、液相法(紫外法、示差法、质谱法)、离子色谱法、毛细管电泳法,其中液相紫外法和离子色谱法较常用[24],已知离子色谱法不能将氟离子跟红茶菌最主要的有机酸-葡萄糖酸有效分离[25]。GB/T 15038-2006的实施,引发了学者利用不同反相色谱柱对不同样品有机酸检测的方法开发,现已形成了多种有机酸检测的专用方法,但未见同时检测红茶菌特征有机酸包括葡萄糖酸、葡萄糖醛酸的在内的多种有机酸的检测方法[24,26-27]。Waters Atlantis® T3色谱柱适合保留和分离性强的极性化合物,其在有机酸方法开发中的应用尚未见报道。为明确红茶菌发酵毛葡萄多种有机酸的同时变化,拟采用T3色谱柱开发包括葡萄糖酸在内的13种有机酸的检测方法,来分析利用红茶菌发酵毛葡萄生产酸性功能软饮品的可行性。
1 材料与方法
1.1 材料与仪器
毛葡萄 2019年市售罗城产毛葡萄,糖度15.5 Bx°,色泽紫黑,饱满,无霉烂、损伤,购买后在4 ℃冰箱贮存;白糖 市售甘蔗白糖;红茶菌 好氧菌股份有限公司;0.22 μm SLGP 033RB针头滤膜 美国Millipore公司;乙腈、磷酸、KH2PO4、L-苹果酸、乙酸、L-乳酸、L-酒石酸、柠檬酸、琥珀酸、抗坏血酸、草酸、富马酸、奎尼酸、葡萄糖醛酸、丙酮酸、柠檬酸钠 色谱纯,上海麦克林生化科技有限公司;葡萄糖酸溶液 纯度51%,上海麦克林生化科技有限公司。
Waters Alliance 2695HPLC分离单元、2996 PDA检测器 美国Waters公司;UV-1800紫外可见光分光光度计 岛津仪器(苏州)有限公司;DK-98-II电热恒温水浴锅 天津市泰斯特仪器有限公司;INNOVA43R落地式低温摇床 上海巴玖实业有限公司;WYT-J手持式折光仪 成都豪创光电仪器有限公司;H1850高速离心机 湖南湘仪实验室仪器开发有限公司;HE53水分测定仪、ME204E电子天平 梅特勒-托利多仪器(上海)有限公司;Cascada I实验室超纯水系统 美国PALL公司。
1.2 实验方法
1.2.1 红茶菌发酵毛葡萄
1.2.1.1 毛葡萄发酵工艺流程 毛葡萄→洗净除梗→称量→破碎→加入糖水→混匀→加入菌膜→封盖→控温发酵
1.2.1.2 毛葡萄发酵操作要点 破碎:将毛葡萄用清水漂洗,除去坏果、梗枝,沥干表面水分。用经400 mg/L焦亚硫酸钠清洗过的对辊粉碎机捣碎。
糖水配制:25 g/100 mL糖水装于三角瓶中,121 ℃灭菌15 min。
接种:将400 g带皮葡萄浆倒入已灭菌的2 L三角瓶中,加入400 mL糖水、50 g红茶菌膜,混匀,使发酵液糖度达到18 Bx°。
发酵:瓶口用8层医用纱布覆盖、扎紧,28 ℃发酵。
取样与检测:在18个发酵瓶中进行平行实验,分别在3、5、7、9、14、17 d打开三瓶进行检测。每个样品的有机酸检测三次,结果以平均数和标准偏差形式表示。
1.2.2 有机酸检测
1.2.2.1 色谱条件的优化和有机酸的定性 配制草酸50 mg/L、葡萄糖醛酸50 mg/L、酒石酸400 mg/L、葡萄糖醛酸2500 mg/L、奎尼酸75 mg/L、丙酮酸75 mg/L、苹果酸200 mg/L、抗坏血酸10 mg/L、乳酸200 mg/L、乙酸2000 mg/L、柠檬酸100 mg/L、富马酸4 mg/L、琥珀酸200 mg/L的单标,用于不同有机酸的保留时间、峰形和强弱的确定。上述单标溶液等体积混合后用于色谱条件的优化,色谱峰的辨识基于单标所获取的峰形、强度和出峰顺序)。
色谱条件的优化:首先验证了210 nm测定有机酸的适应性,接着在其它条件固定的前提下,分别进行了柱温(25、30、35 ℃)、流动相KH2PO4的浓度(0.01、0.02、0.04 mol/L)、流动相pH(2.4、2.6、2.8、3.0)、流速(0.4、0.45、0.5、0.55 mL/min)的单因素比对实验,从而得到优化的色谱条件。在优化的条件下确定每个有机酸的保留时间,最终完成有机酸的定性。
1.2.2.2 标准曲线的建立与方法评价 混合标准储备液的配制:称取各种标准品适量,用KH2PO4缓冲液溶解并定容至100 mL,得到浓度为葡萄糖醛酸 0.8 mg/mL(用于葡萄糖醛酸和草酸共流出峰的相对定量)、酒石酸3.2 mg/mL、葡萄糖酸20 mg/mL、奎尼酸0.6 mg/mL、丙酮酸0.6 mg/mL、苹果酸1.6 mg/mL、抗坏血酸0.08 mg/mL、乳酸1.6 mg/mL、乙酸20 mg/mL、柠檬酸1.6 mg/mL、富马酸0.024 mg/mL、琥珀酸1.6 mg/mL的混合标准储备液,4 ℃保存。
在优化的色谱条件下进行有机酸标样的定量检测。色谱柱:Waters Atlantis®T3色谱柱(4.6 mm×250 mm,5 μm);流动相:KH2PO4缓冲液(0.02 mol/L,pH2.6);等度洗脱;流速:0.4 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:210 nm。
标准曲线的建立:用KH2PO4缓冲液将混合标准储备液稀释至所需浓度的混合标准工作液,共六个梯度。在优化的条件下对六个梯度进行检测,将峰面积(y)和浓度(x)进行强制过原点的线性拟合,建立标准曲线。
定量方法的方法学评估:对最低浓度标准溶液逐步稀释检测,取信噪比S/N 3和10时对应分析物的浓度作为检出限和定量限。向毛葡萄7 d发酵液的5倍稀释液中加入等体积的梯度4混合标准溶液,平行测定6次,计算出相应组分的加标回收率和相对标准偏差。
1.2.2.3 样品的检测 红茶菌发酵毛葡萄样品以8000 r/min离心15 min,用去离子水稀释3~5倍,经0.22 μm针头微孔滤膜过滤至样品瓶。在优化的色谱条件下上机检测,用标准曲线定量。
1.3 数据处理
使用Microsoft Excel 2016软件对数据进行处理,数据以平均数±标准偏差形式表示。
2 结果与分析
2.1 色谱条件的确定
2.1.1 检测波长的选择 利用二极管阵列检测器PDA对草酸、葡萄糖醛酸等13种目标分析物在190~400 nm范围内进行扫描,发现各分析物在210 nm均有较大的吸收,且流动相干扰较小,故采用210 nm作为检测波长。
2.1.2 检测温度的选择 在流动相KH2PO4缓冲液(0.02 mol/L,pH2.6)、流速0.4 mL/min的前提下,对比了25、30、35 ℃检测温度对有机酸分离度的影响,结果见图1。可以发现,随着温度的升高,有机酸的保留时间有所缩短。25 ℃条件下,柠檬酸和富马酸不能有效分离。35 ℃条件下L-酒石酸、葡萄糖酸的分离度较30 ℃差,因此,选择30 ℃为优化的检测温度。草酸/葡萄糖醛酸在所有优化过程中均完全重合,故在下述优化描述中不再重复提及。
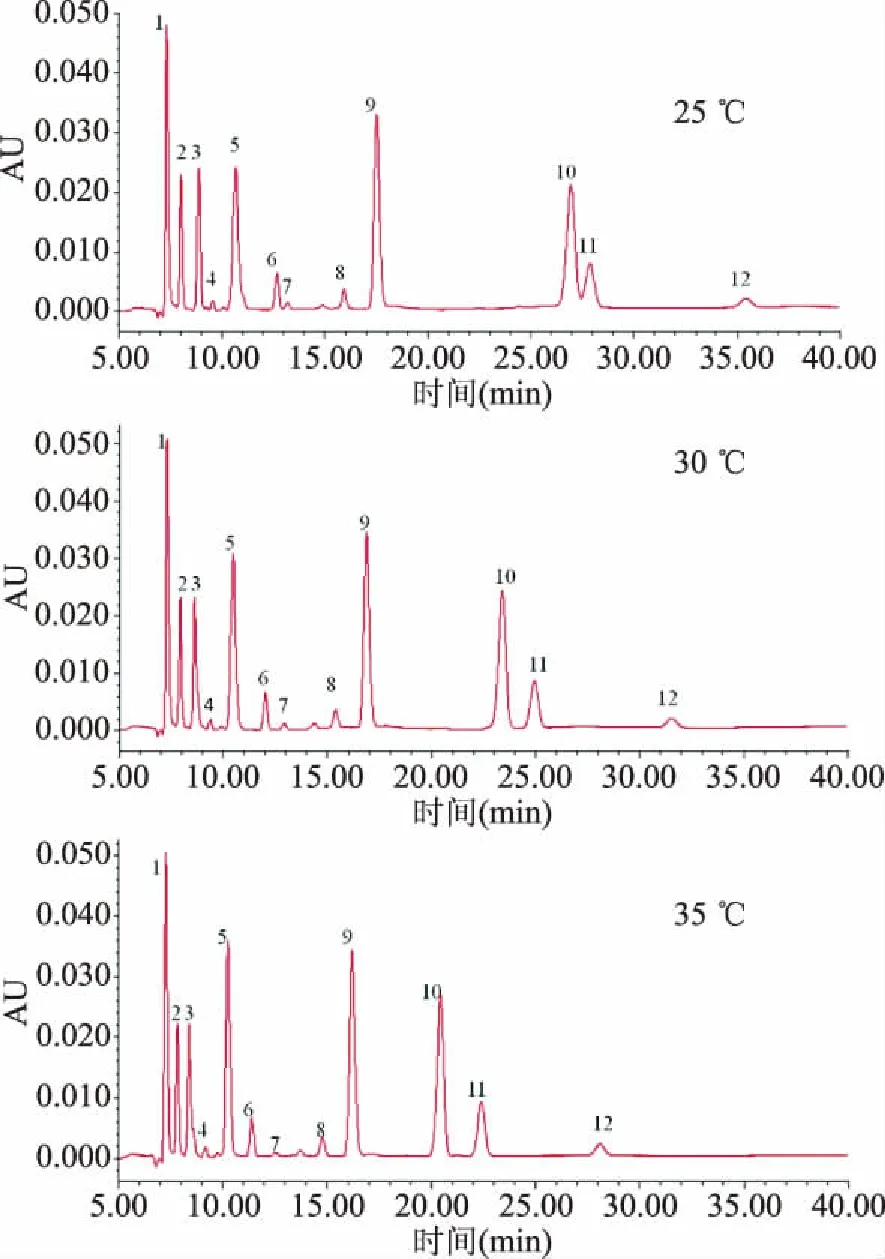
图1 13种有机酸标样在不同检测温度下的HPLC色谱图Fig.1 HPLC chromatograms of 13 organic acid standards under different column temperature注:1:草酸/葡萄糖醛酸;2:L-酒石酸;3:葡萄糖酸;4:奎尼酸;5:丙酮酸;6:L-苹果酸;7:抗坏血酸;8:L-乳酸;9:乙酸;10:柠檬酸;11:富马酸;12:琥珀酸;图2~图5同。
2.1.3 流动相浓度的选择 用H3PO4滴定,调整0.01、0.02、0.04 mol/L的KH2PO4缓冲液的pH到2.6。在流速0.4 mL/min 30 ℃的检测温度下,比对三个浓度梯度对有机酸分离效果的影响,结果见图2。三个梯度的分离度差异不大,考虑到缓冲溶液的浓度高有利于有机酸分子态的稳定存在以及高浓度的盐溶液会对泵和柱子的寿命会产生影响,选取0.02 mol/L的KH2PO4溶液做流动相。

图2 13种有机酸标样在不同浓度缓冲盐作为流动相的HPLC色谱图Fig.2 Chromatograms of 13 organic acid standards with different concentration of buffer solutions
2.1.4 流动相pH的选择 用H3PO4滴定调整0.02 mol/L的KH2PO4缓冲液的pH分别达到2.4、2.6、2.8、3.0,在流速0.4 mL/min、30 ℃的检测温度的前提下,比对四个不同pH缓冲液对有机酸分离效果的影响,结果见图3。流动相pH增加时各有机酸的保留时间会缩短,柠檬酸和富马酸在pH2.8时不能有效分离,在pH3.0时融合、峰形异常。pH2.4、2.6均有较好的分离效果,考虑到低pH流动相对柱子寿命的潜在影响,选择pH2.6的KH2PO4溶液做流动相。
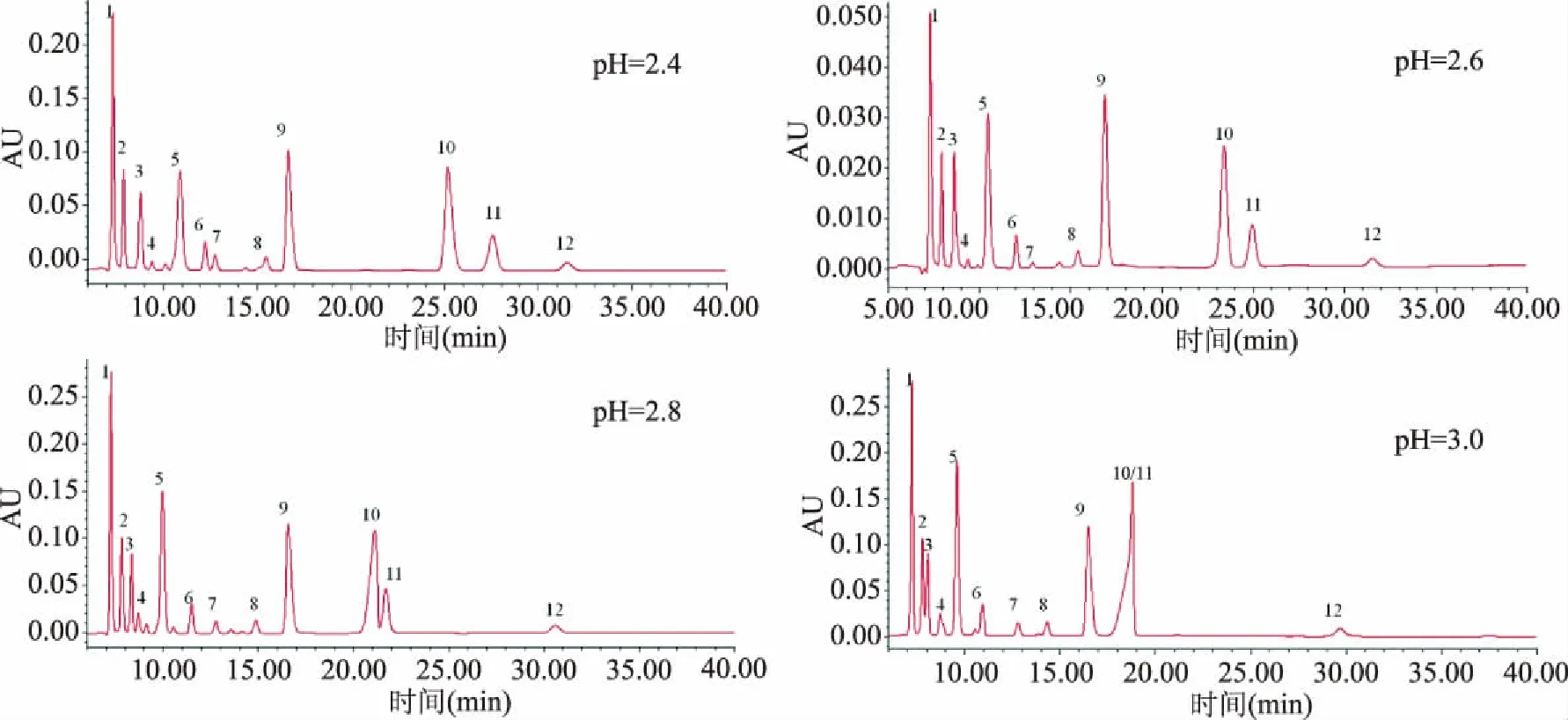
图3 13种有机酸标样在不同pH缓冲盐作为流动相的HPLC色谱图Fig.3 Chromatograms of 13 organic acid standards with different mobile phase pH
2.1.5 流速的选择 在流动相KH2PO4缓冲液(0.02 mol/L,pH2.6)、30 ℃检测温度的条件下,对比了流速0.40、0.45、0.50、0.55 mL/min对有机酸分离情况的影响,结果见图4。发现随着流速的增加,有机酸的保留时间缩短。相对而言,0.40 mL/min条件下各有机酸的分离度均较好,尤其是 L-酒石酸、葡萄糖酸的分离效果优于其它流速,所以选择流速0.40 mL/min。

图4 13种有机酸标样在不同流速下的HPLC色谱图Fig.4 Chromatograms of 13 organic acid standards with different flow velocity of mobile phase
2.2 有机酸的定性
在优化的条件下确定每个有机酸的保留时间,实现有机酸的定性。图5为优化条件下13种有机酸的色谱图,可以看出除草酸和葡萄糖醛酸共流出外,其它有机酸标样均有较好分离。
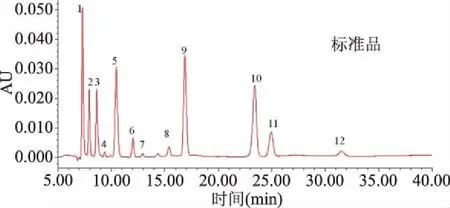
图5 优化条件下13种混合标准品的HPLC谱图Fig.5 Chromatograms of 13 organic acid standards under optimum conditions
2.3 标准曲线建立及方法的评价
在上述最优条件下,将红茶菌发酵毛葡萄7 d发酵液稀释5倍后进行检测,色谱图见图6。可以发现目标物周围无明显的干扰,说明方法适合样品检测。由于本研究色谱条件下葡萄糖醛酸和草酸完全重合,只能采用葡萄糖醛酸的标准曲线对共流出峰进行相对定量。目前有采用液相紫外和示差法对葡萄糖醛酸含量绝对定量的报道[4,17-18],但其未同时检测草酸的情况,不能排除在这些文献报道的色谱条件下存在草酸对葡萄糖醛酸数据干扰的可能性。相对而言,液相质谱报道的红茶菌葡萄糖醛酸数据更为可信,因为检测机理决定着其检测不受草酸干扰[28]。

图6 优化条件下红茶菌毛葡萄发酵稀释液的HPLC谱图Fig.6 Chromatogram of organic acids in fermentative broth ofVitis quinnquangularis Rehd. by the kombucha consortium under optimum HPLC conditions
在优化的条件下对6个混合标准梯度进行检测,将峰面积(y)和浓度(x)进行强制过原点的线性拟合,建立标准曲线,并进行方法评价。标准曲线及其线性范围与R2、检出限、定量限、加标回收率、RSD等结果见表1。结果显示,线性范围较宽,标准曲线线性相关系数分布范围0.990~0.996,线性良好,适合红茶菌稀释3~5倍后进行检测;检出限范围0.024~0.080 mg/L,定量限范围0.080~4.789 mg/L,加标回收率92.68~107.35%,相对标准偏差<5%,说明该方法精密度良好,准确度高,可满足实际样品的检测。
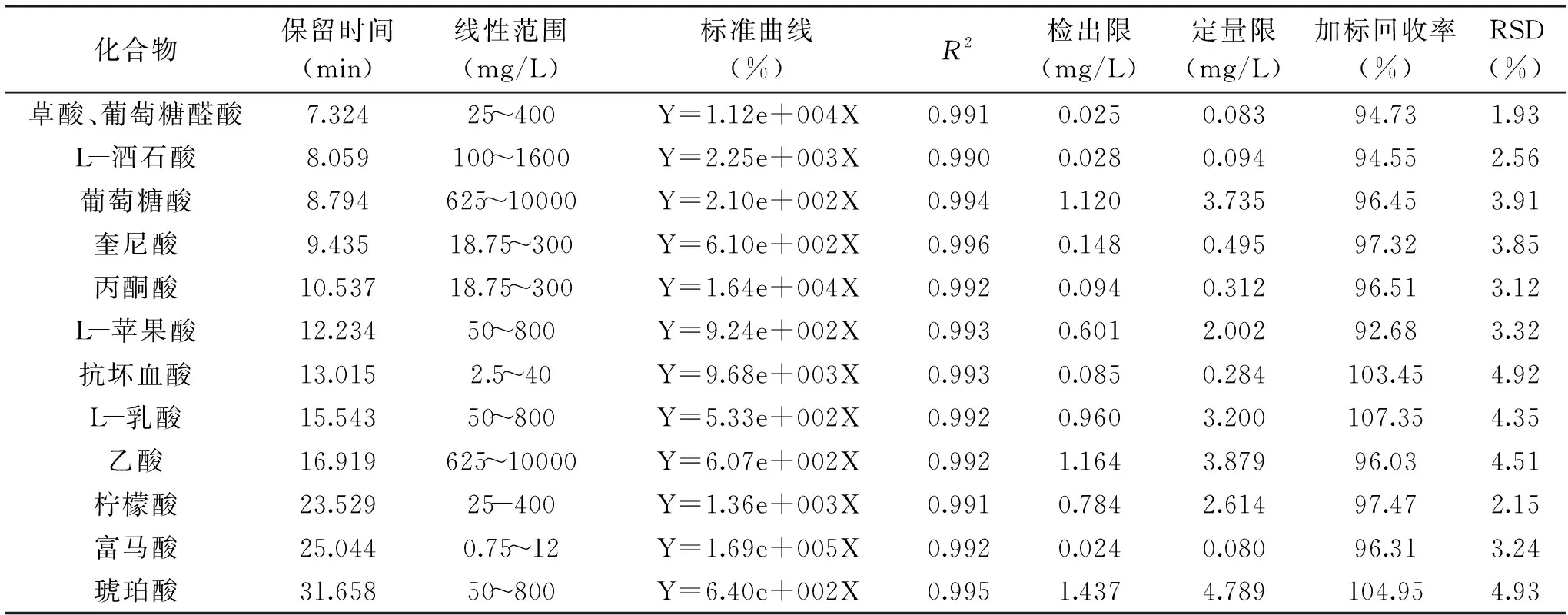
表1 有机酸组分的保留时间、线性范围、标准曲线、相关系数、检出限、定量限、加标回收率、标准偏差Table 1 Retention time,linear range,regression equation,correlation coefficient,limit of detection,limit of quantitation,recovery,RSD of organic acids by HPLC
2.4 红茶菌发酵过程有机酸的变化
红茶菌发酵毛葡萄浆的有机酸变化见图7。葡萄糖酸、乙酸是主要的有机酸,在17 d的发酵液中浓度分别是138795和37841 mg/L,占所测有机酸总量的75.03%和10.46%。在17 d发酵液中有机酸浓度由大到小的顺序依次是:葡萄糖酸>乙酸>L-酒石酸>奎尼酸>L-苹果酸>L-乳酸>丙酮酸>琥珀酸>柠檬酸>草酸/葡萄糖醛酸>抗坏血酸>富马酸。
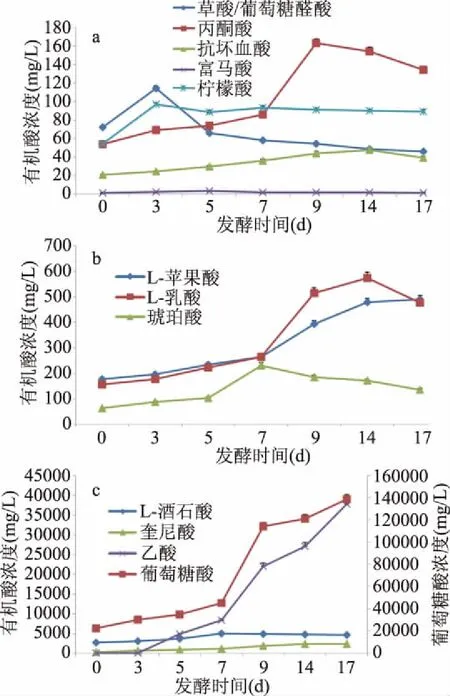
图7 毛葡萄红茶菌发酵过程13种有机酸的变化情况Fig.7 The changes of 13 organic acids in fermentative broth of Vitis quinnquangularis Rehd. during the process fermented by the kombucha consortium
从发酵过程的变化趋势上看,除葡萄糖酸、苹果酸、乙酸一直增加外,其它组分均呈现先升后降的趋势且各自出现浓度峰值的时间不同。葡萄糖醛酸/草酸共流出物相对含量的峰值出现最早,而其下降或许与草酸容易形成盐沉淀有关。葡萄糖醛酸因其解毒功能而备受人们重视[18,29-30],但葡萄糖醛酸/草酸共流出物相对含量在17 d的发酵液中含量仅为46.1 mg/L,再次印证了其在红茶菌发酵液中含量不高。酒石酸在葡萄汁中初始含量相对较高,发酵过程未呈现大幅增加,跟葡萄酒发酵过程的表现类似[24]。奎尼酸是自然界普遍存在的多羟基化合物[31],在发酵过程增加明显,与酚酸的报道趋势一致[14,17]。乳酸由红茶菌菌群的乳酸菌代谢生成[22,28],但它不是红茶菌的主要有机酸。抗坏血酸在前14 d的发酵过程中一直增加,在17 d时有所下降,其发酵过程含量的提升与文献报道一致[2]。琥珀酸在发酵过程中缓慢增加后缓慢降低,柠檬酸的变化不显著,而富马酸含量极少。与初始发酵液对比,仅17 d草酸/葡萄糖醛酸共流出物的浓度下降,降幅为0.36倍;而其它有机酸均增加,增幅由大到小依次是乙酸(945.1倍)、奎尼酸(6.8倍)、葡萄糖酸(5.2倍)、L-乳酸(2.1倍)、L-苹果酸(1.7倍)、丙酮酸(1.5倍)、琥珀酸(1.1倍)、抗坏血酸(0.85倍)、柠檬酸(0.65倍)、富马酸(0.33倍)。葡萄糖酸和乙酸是红茶菌的主要有机酸,是醋酸菌分别作用葡萄糖和乙醇所生成的产物[32],它们的浓度和比例决定着发酵液的酸度和酸感。葡萄糖酸的酸味纯正柔和[30]、酸度约为柠檬酸和乳酸的1/3~1/4[33],预示着利用红茶菌发酵罗城毛葡萄制作酸性功能饮料将较葡萄醋的口感更佳。
3 结论
通过对检测波长、流动相pH、流动相浓度、柱温和流速进行优化,建立了高效液相色谱同时测定毛葡萄红茶菌发酵液中13种有机酸的分析方法。在优化的条件下,葡萄糖醛酸和草酸完全重合(只能用葡萄糖醛酸的标准曲线相对定量),而葡萄糖酸、奎尼酸、抗坏血酸等其它11种酸组分在样品中均能有效分离。该方法线性宽、检出限低、回收率高、精密度好,不仅适用于毛葡萄红茶菌发酵液组分的检测,也已在火龙果、百香果、桑葚以及米酒发酵液的有机酸检测中得到成功应用。
通过对毛葡萄红茶菌的发酵过程进行跟踪,明确了各有机酸的协同变化规律。葡萄糖酸、乙酸是主要的有机酸,分别占所测有机酸总量的75.03%和10.46%。有机酸浓度由大到小的顺序依次是:葡萄糖酸>乙酸>L-酒石酸>奎尼酸>L-苹果酸>L-乳酸>丙酮酸>琥珀酸>柠檬酸>草酸/葡萄糖醛酸>抗坏血酸>富马酸。与初始发酵液对比,仅17 d草酸/葡萄糖醛酸共流出物的浓度下降,其它有机酸均增加,且乙酸、奎尼酸、葡萄糖酸、L-乳酸的增幅在2倍以上。苹果酸、葡萄糖酸、乙酸在发酵过程中一直增加,而其它酸类均呈现先升后降的趋势、各自出现浓度峰值的时间也不同。鉴于葡萄糖酸的纯正柔和口感、弱酸度,意味着用红茶菌发酵罗城毛葡萄制作酸性功能饮料将比葡萄醋的口感更佳,这为罗城毛葡萄深加工提供了一条新思路。

