折点加氯去除氨氮特性
许高平,冯在玉,任婉璐,甘 炜
(江西省水务水科学检测研发有限公司,江西省饮用水安全重点实验室,江西景德镇 333000)


(1)

(2)

(3)

(4)

(5)
1 材料与方法
1.1 材料
(1)梅宇牌六联搅拌装置1台,磁力搅拌装置(可控温)1台,便携式余氯检测仪1台(哈希PC-II-58700-00),便携式水质多参数检测仪1台(哈希DR1900),可见分光光度计1台(北京普析T6新世纪)。
(2)氨氮标准溶液(1 000 mg/L):称取烘至恒重的氯化铵3.819 g,用纯水溶解后定容至1 000 mL容量瓶。
(3)氢氧化钠溶液(1 mol/L):称取分析纯氢氧化钠4 g,用纯水定容于100 mL容量瓶,用纯水溶解后定容至1 000 mL容量瓶。
(4)氯标准溶液(1 000 mg/L):取市售次氯酸钠溶液1 mL,用纯水稀释定容至100 mL,再取此溶液1 mL用纯水稀释定容至100 mL,再取此溶液10 mL用纯水稀释定容至100 mL,再用便携式余氯检测仪重复测定,取平均值浓度为0.24 mg/L,得出市售次氯酸钠溶液浓度为24 g/L。取市售次氯酸钠溶液4.17 mL用纯水定容至100 mL。
1.2 方法
1.2.1 方案1
为了探究同一pH、温度、氨氮浓度,不同加氯量条件下,氨氮、游离余氯、总氯的浓度随时间推移的变化情况特设计以下方案。
准备序号分别为1~12(由于是六联搅拌装置,故试验实际分2批进行)的搅拌烧杯,各加入1 000 mL纯水、0.75 mL氨氮标准溶液,依次加入氯标准溶液0、0.5、1、2、3、4、5、6、7、8、9、10 mL,在45 r/min搅拌下,分别于0.5、1、2、3 h后检测余氯、总氯;于0.5、2 h后检测氨氮。
1.2.2 方案2
由方案1的试验可知,pH值=6.23、水温=12.7 ℃时,折点的氯与氨氮合适比例为8∶1,反应时间约为3 h。考虑到实际各供水单位原水pH及发生氨氮偏高时的水温不一样,分别设计以下试验。
(1)准备序号分别为1~6的搅拌烧杯,各加入1 000 mL纯水,使用硫酸及氢氧化钠分别调整pH值至6.0、6.5、7.0、7.5、8.0、8.5,再分别加入0.75 mL氨氮标准溶液、6 mL氯标准溶液,在45 r/min搅拌下,分别于3 h后检测余氯、总氯。
(2)准备序号分别为1~3的烧杯,各加入1 000 mL纯水,分3次置于恒温磁力搅拌器上,分别设置温度为15、20、25 ℃,每个烧杯中加入0.75 mL氨氮标准溶液、6 mL氯标准溶液,分别于0.5、1、1.5、2、3 h后检测余氯、总氯。
1.2.3 方案3
为验证方案1试验的结论,特设计以下方案:准备序号分别为1~6的搅拌烧杯,各加入6种实际样品各 1 000 mL,分别测定水温、pH、氨氮、耗氧量,按氨氮浓度的8倍加入一定的氯标准溶液,在45 r/min搅拌下,3 h测定总氯和游离余氯。
2 结果与讨论
2.1 氨氮的去除速度
研究表明,氨氮与氯反应的前段发生的是式(1)、式(2)代表的反应,此时随着加氯量的增加,化合氯成比例增加,水中氨氮逐渐减少[7]。如图1所示,在pH值=6.23、水温=12.7 ℃、氨氮初始浓度为0.75 mg/L的条件下,加入不同浓度的氯标准溶液,2 h与0.5 h测得的氨氮剩余浓度相差无几,说明此时氨氮与氯在0.5 h内就已经完成了式(1)、式(2)代表的反应。
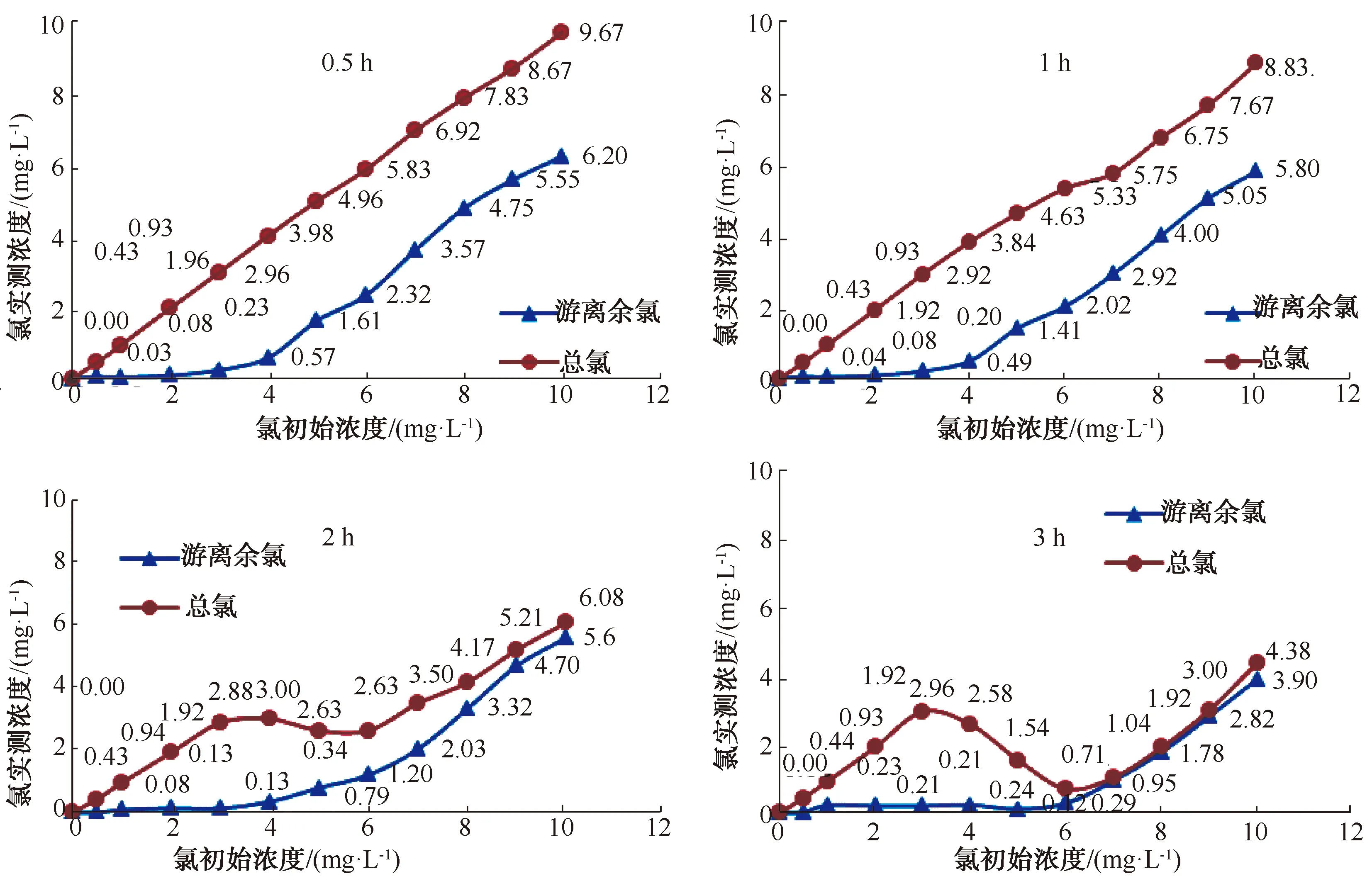
图1 0.5、1、2、3 h后氨氮浓度Fig.1 Ammonia Nitrogen Concentration after 0.5,1,2 h and 3 h

图2 同一氨氮浓度条件下,游离余氯与总氯随时间推移的变化情况Fig.2 Variation of Free Residual Chlorine and Total Chlorine with Time under the Same Ammonia Nitrogen Concentration
2.2 折点的判断与最适投加量
图2为不同加氯量条件下,游离余氯与总氯随时间推移的变化情况。由图2可知,3 h测定的游离余氯与总氯,或游离余氯浓度特别低,或游离余氯接近于总氯,此时式(3)~式(5)代表的反应缺少反应物,基本达到了反应终点。此时,总氯曲线在加氯量为6 mg/L的位置呈现一个典型的折点,游离余氯折点不明显。2016年,费明明等[8]在“折点加氯对微污染原水中氨氮去除效果的研究”一文中也反映了这一情况。
2.3 pH对折点加氯反应过程的影响
在水温=10.8 ℃、氨氮初始浓度为0.75 mg/L、氯初始浓度为6 mg/L、不同pH条件下,3 h后游离余氯与总氯检测结果如图3所示。由图3可知,随着pH的升高,氯与氨氮的反应速度逐渐下降。推测可能是OH-与HOCl反应,导致式(3)~式(5)反应速度减慢。

图3 不同pH条件下,3 h后游离余氯与总氯Fig.3 Free Residual Chlorine and Total Chlorine after 3 h under Different pH Values
2.4 温度对折点加氯反应过程的影响
如图4所示,不同温度对氯与氨氮的反应速度有极大的影响,达到了方案1试验中3 h的反应结果:15 ℃时,需2 h;20 ℃时,需1.5 h;25 ℃时,需1~1.5 h。25 ℃、1 h时,作为反应物之一的游离余氯已经明显下降,如果游离余氯的量足够,反应速度还会提升。从检测结果来看,随着温度的升高,反应终点时总氯的剩余量越来越多,即折点氯与氨氮的比例不再是8∶1,而是随着温度的升高而升高,这可能是由于温度的升高,氯气在水中的溶解度下降,逸散到空气中的速度加快,游离余氯浓度下降。
2.5 折点加氯投加量的验证
由表1可知,不同浓度的氨氮样品,加入8倍的氯标准溶液,3 h后均接近反应终点,且剩余反应物比例合适。此试验中各样品的耗氧量浓度差距较大,说明在无光照条件下,耗氧量所代表的一类物质不是主要耗氯物质。

图4 不同温度条件下,游离余氯与总氯随时间变化Fig.4 Variation of Free Residual Chlorine and Total Chlorine with Time under Different Temperature Conditions

表1 实际样品投加理论氯标准溶液效果Tab.1 Effect of Theoretical Chlorine Dosing on Standard Solution of Actual Sample
3 结论与建议
(1)在水温为12.7 ℃、pH值为6.23、只考虑氨氮单一耗氯物质的情况下,氯与氨氮的比例为8∶1,反应终点时间约为3 h。
(2)随着pH的升高,折点加氯反应终点的时间也逐渐增加。
(3)随着水温的升高,折点加氯反应终点时间显著减少,同时氯与氨氮的比例增大。
(4)在无光照的情况下,水中耗氯物质不包括耗氧量代表的一类还原性物质。
(5)实际生产中,若发现氨氮偏高,第一步应准确检测氨氮的量,再根据氨氮浓度投加一定量的滤前氯;水温较低时,取已加滤前氯反应池的水进行水浴加热后,测定余氯与总氯,可快速判断氯与氨氮的比例是否合适。

