化疗对肺癌患者营养及免疫功能的影响
胡 琴,殷 飞,张 涛,黄 浩,王可武
(芜湖第二人民医院肿瘤内科,安徽 芜湖 241000)
肺癌是临床工作中最常见的恶性肿瘤之一,其发病率及死亡率一直居高不下,目前仍为全球恶性肿瘤死因分类统计的第一位[1]。化疗仍为肺癌不可或缺的治疗手段,患者在化疗前后营养状况可能会发生不同程度的变化,从而对患者的生活质量和病情的预后造成一定的影响。选择合适的营养评价方法可及时了解患者营养状况,及早的营养干预可改善营养不良,减少化疗不良反应,提高患者化疗的耐受性。有研究表明合理有效的营养支持可显著降低恶性肿瘤患者的疾病并发症及感染性并发症的发生率[2-3]。有研究认为,肿瘤患者因化疗导致的长期营养不良可使患者免疫功能出现不同程度的降低,严重者产生口炎、咽喉炎、胃肠道黏膜炎性反应等疾病,从而使营养不良发生恶性循环[4]。免疫功能的稳定依赖于辅助性 T 细胞和抑制性 T 细胞之间的平衡,CD4+细胞具有促进效应细胞抗肿瘤的作用,CD8+细胞主要起免疫抑制作用,CD4+/CD8+比值能反映二者之间的平衡,也可作为衡量肿瘤患者免疫抑制程度的指标,低CD4+、CD4+/CD8+水平对机体免疫状态不利[5]。外周血检测T淋巴细胞亚群是观察机体细胞免疫的方法之一。本研究以我院初次入住肿瘤科的非终末期肺癌患者为研究对象,运用PG-SGA进行化疗前后营养评价及T细胞亚群检测,观察化疗对营养风险及免疫功能的影响。
1 资料与方法
1.1研究对象:收集本院2017年6月~2019年3月期间初次入住我科经病理证实为肺癌并有明确化疗指征的待化疗患者资料,共计52例,男27例,女24例,年龄31~75岁,平均(56.11±9.12)岁;腺癌28例,鳞癌15例,小细胞癌9例。所有患者在接受本次治疗前1个月内未接受放化疗及其他影响免疫功能的治疗手段。
1.2纳入标准:所有患者均有病理学诊断依据并预计生存期超过3个月,按我国卫生部诊疗规范进行术后辅助或者一线化疗,患者KPS评分≥70分;血常规、肝肾功能、心电图均无明显化疗禁忌;无严重基础疾病;经沟通后签署化疗知情同意书。
1.3化疗方案:本研究中所选化疗方案:鳞癌患者选择吉西他滨1.0 g/m2,第1天、第8天,顺铂 75 mg/m2第1天、第2天或卡铂AUC=5,腺癌患者选择培美曲塞600 mg/m2第1天顺铂 75 mg/m2第1天、第2天或卡铂AUC=5,小细胞癌患者选择依托泊甙100 mg/m2第1~3天+顺铂25~30 mg/m2第1~3天,每3周重复,化疗期间严密观察化疗副反应。治疗前均行基线检查,化疗每2周期疗效评价。
1.4研究方法:PG-SGA专门为肿瘤患者所设计,内容包括营养筛查和营养评估两部分,优点是使用简便、临床易操作实施,既可用于存在营养风险的患者,也可用于已经发生营养不良的患者。对于存在营养风险的患者通过PG-SGA进行营养评估、将患者的营养状况分为 A组(0~3分) (营养良好)、B组(4~8分)(可疑或中度营养不良)、 C组(≥9分)(重度营养不良)三个等级,≥9分则需要给予营养干预或改善症状的治疗。C组患者予以营养治疗改善后达到B组后再进行化疗,化疗前所有患者测定外周血T淋巴细胞亚群 (CD3+、CD4+、CD8+);于化疗2周期后重复上述内容,比较化疗前后营养状况及免疫功能影有无影响。

2 结果
2.1患者化疗前后营养状况PG-SGA分组构成比:52例患者中均至少完成化疗2周期,化疗前PG-SGA评分≥9 分2 例,予以营养干预后重新评分低于8分后行化疗。化疗前PG-SGA评分≥9 分6 例。见表1。

表1 研究组化疗前和化疗后PG~SGA分组构成比
2.2患者化疗前后免疫指标比较:52例患者化疗前、后免疫功能检测结果见表2,所有患者化疗后CD8+表达均升高,NK细胞表达均下降,与化疗前相比差异无统计学意义(P>0.05);28例化疗有效患者化疗后CD4+、CD4+/CD8+表达升高,化疗前相比有差异有统计学意义(P<0.05),CD8+表达与化疗前相比明显升高,NK细胞表达下降,但与化疗前比差异无统计学意义(P>0.05)。24例化疗无效病例化疗后NK细胞、CD4+、CD4+/CD8+表达下降,与化疗前相比,差异有统计学意义(P<0.05),CD8+化疗后表达无显著性差异(P>0.05),NK细胞表达下降,与化疗前相比,差异有显著统计学意义(P<0.01)。见表2。
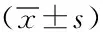
表2 患者化疗前后免疫指标比较
3 讨论
恶性肿瘤患者通常存在营养风险,营养风险会潜在影响并发症发生率、感染发生率、住院时间等[6],化疗副反应又会进一步影响患者的营养状况,进而可能影响患者的生活质量[7]。化疗在营养筛查的指导下针对性早期肠内营养可以提高患者的营养状况,减少化学治疗并发症,增强免疫功能,提高患者对化疗的耐受能力[8]。因此,目前对肿瘤患者围化疗期行营养支持,已成为研究的热点及重点[9]。肿瘤化疗患者普遍存在营养不良或营养代谢紊乱,与以往研究结果一致[10-11]。对于肿瘤患者如果发现有营养风险并存在营养不良,应及时营养治疗给予纠正,否则机体对化学治疗的耐受性将会降低。PG-SGA可以较好地反映常见消化道恶性肿瘤患者的营养状况,中国抗癌协会肿瘤营养与支持治疗专业委员会推荐使用[12]。本组资料对于行PG-SGA发现营养评分≥9分的患者先予以营养治疗,改善后直至低于8分再行化疗。患者化疗前PG-SGA A组的比例73.1% ,而化疗后PG-SGA A组的比例为61.5%,且重度营养不良发生率高,经统计学处理,差异有统计学意义(P<0.05),结果显示化疗后比化疗前营养不良发生率高。肿瘤患者营养不良的原因有心理因素、抗肿瘤治疗、肿瘤本身的消耗、能量消耗异常等。T 细胞及NK 细胞在抗肿瘤免疫中具有极其重要的作用。T 淋巴细胞亚群是具有特殊标志的人胸腺输出细胞,执行细胞免疫功能及免疫调节功能,其中CD3+细胞代表成熟淋巴细胞,是细胞免疫中主要的活性细胞。 根据 CD 表型可分为CD4+和CD8+两大亚群。在T 细胞网络中,CD4+和CD8+细胞处于调节枢纽地位,其数量和比值变化反映机体免疫功能状态[13]。本组资料结果显示,所有患者化疗后CD8表达均升高,NK细胞表达均下降,与化疗前相比差异无统计学意义(P>0.05);33例化疗有效患者化疗后CD4、CD4+/CD8+表达升高,与化疗前相比,差异有统计学意义(P<0.05),CD8表达与化疗前相比明显升高,NK细胞表达下降,但与化疗前比差异无统计学意义(P>0.05)。19例化疗无效病例化疗后NK细胞、CD4+、CD4+/CD8+表达下降,与化疗前相比,差异有统计学意义(P<0.05),CD8+化疗后表达无显著性差异(P>0.05),NK细胞表达下降,与化疗前相比,差异有显著统计学意义(P<0.01)。该结果提示对于恶性肿瘤患者,合理有效的治疗方案因减少肿瘤负荷可能会降低肿瘤对机体免疫系统的抑制作用,通过增强T淋巴细胞的免疫效应,改善机体的免疫功能状态。有研究认为化疗后CD3+、CD4+均明显增高,与化疗前比较,差异有统计学意义(P<0.05)。NK细胞又称自然杀伤细胞,除具有杀伤功能外,还对细胞免疫应答具有重要的调节作用。从本组资料来看,NK细胞在化疗后呈明显下降趋势,尤其在化疗无效组表达明显,提示对化疗无效的患者,化学治疗可能会抑制NK细胞的活性,而对于化疗有效的患者,这种抑制作用较轻。由于本资料样本量较少,还有待于临床进一步观察。
综上所述,肺癌患者存在一定的营养风险,且化疗反应可能会加重消化系统负担,对营养产生一定影响,另一方面虽然化疗药物可能对免疫系统有抑制作用,但只要选择合理有效的治疗,不但不会影响肿瘤患者营养状况,还有可能提高其免疫系统功能,从而有助于增强机体的抗肿瘤能力,改善患者生活质量,以期延长患者生存时间。

