射频消融治疗桥本甲状腺炎合并微小乳头状癌的有效性及安全性
杨明,罗渝昆,张艳,谢芳,张颖,冀波
解放军总医院第一医学中心超声医学科,北京 100853; *通讯作者 罗渝昆 lyk301@163.com
桥本甲状腺炎(Hashimoto's thyroiditis,HT)是以自身甲状腺组织为抗原的特异性自身免疫性疾病,又称为自身免疫性甲状腺炎,是较常见的甲状腺炎症。射频消融(radiofrequency ablation,RFA)是一种甲状腺结节微创治疗方法,已广泛应用于治疗甲状腺良性结节[1]。既往已有关于甲状腺微小乳头状癌(papillary throidmicrocarcinoma,PTMC)微创治疗的报道[2-3];但关于超声引导下RFA 对HT 合并PTMC 的有效性及安全性鲜有报道。本研究拟探讨RFA治疗HT 合并PTMC 的可行性及安全性。
1 资料与方法
1.1 研究对象 回顾性纳入2017年1月—2018年1月在解放军总医院第一医学中心行RFA治疗的76例患者共76枚结节,其中男11例、女65例,平均年龄(45±9)岁,结节最大径均≤1 cm,平均最大径(0.62±0.19)cm,平均体积(0.10±0.09)cm3。合并HT 38例,其中男4例、女34例,单发结节28例,合并其他结节10例;未合并HT 38例,其中男7例、女31例,单发结节14例,合并其他结节24例。所有患者均行血常规、凝血功能及甲状腺功能检查,并行灰阶超声、超声造影、超声引导下组织或细胞学活检。研究组及对照组内进一步分为单发组和多发组。纳入标准:①病理证实为PTC,且最大径≤1 cm;②超声未发现颈部肿大及异常淋巴结;③因自身条件不能耐受或拒绝手术切除治疗者;④研究组患者甲状腺超声检查为甲状腺实质回声呈弥漫性改变,抗甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)及抗甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)均>60 IU/ml,病理证实为间质淋巴组织增生伴淋巴滤泡形成;⑤对照组患者甲状腺超声检查为甲状腺实质回声均匀,TgAb 及TPOAb均<60 IU/ml。排除标准:①甲状腺被膜受侵犯;②超声造影剂过敏及存在凝血功能障碍;③重症高血压控制不佳或存在严重心肺疾病;④颈部皮肤存在严重感染灶;⑤病灶对侧声带功能不良;⑥不能耐受术中疼痛者。本研究经本院医学伦理委员会审核通过;所有患者行超声造影检查、穿刺活检及RFA治疗前均签署知情同意书。
1.2 仪器与方法
1.2.1 仪器 使用西门子Acuson Sequoia 512 超声诊断仪,15L8W型高频线阵探头;或飞利浦iU22 超声诊断仪,L12-5型高频线阵探头。超声引导下穿刺活检及RFA治疗使用西门子Acuson Sequoia 512 超声诊断仪,6L3型高频线阵探头;超声造影剂采用声诺维(SonoVue),以5 ml 0.9%氯化钠溶液稀释,使用前充分振荡摇匀,经肘前静脉团注2.4 ml;RFA治疗使用奥林巴斯Celon AG型射频消融治疗系统,采用一次性双极18G 射频针,有效消融裸区长约9 mm。
1.2.2 超声检查 观察甲状腺的大小、实质回声、血流以及结节部位、形态、大小、血流、结节数目(患者甲状腺单侧叶实质内仅存在欲行RFA 手术病灶即为单发,如有其他结节者即为多发)。确定目标结节,选取病灶最大切面测量最大直径,计算体积。确认颈部有无可疑淋巴结。超声造影通过前臂肘静脉获得静脉通道,机械指数0.19~0.24,推注SonoVue 2.0~2.4 ml,并以5 ml 生理盐水冲洗。造影后对实性结节行超声引导下粗针穿刺活检或细针抽吸细胞学检查,送检标本进行BRAF V600E 检测。
1.2.3 射频消融术 患者取平卧位,充分暴露颈前区,消融前由操作者仔细评估结节与颈部关键结构的关系,设计最佳穿刺点及进针路径。超声实时监测针道及针尖位置,常规消毒铺巾,以1%盐酸利多卡因局部浸润麻醉。如目标结节与颈部关键结构(气管、血管、食管、喉返神经)的距离<5 mm,注射生理盐水形成隔离带,使目标结节距离关键结构≥1 cm,为穿刺及RFA 营造安全区间以保护周围重要结构。然后对较小结节采用固定消融,对较大结节使用多点移动消融技术,功率为3 W。如5~10 s 内针尖尖端未形成瞬态高回声,则射频功率增加至5 W,直至结节及边缘均已转变为瞬态高回声区时终止消融,RFA 范围超过肿瘤边缘,防止残留和复发。
消融后即刻使用超声造影对消融区进行评估,查看是否消融完全。若有残留灶,及时进行补充消融。记录手术过程中有无并发症、患者体征、RFA 使用时间及能量。操作结束后对穿刺点及针道走行部位进行局部按压,观察1~2 h 以监测生命体征有无异常。复查超声,观察皮下有无出血。确认无出血、声音嘶哑等并发症后,患者方可离开。
1.3 随访与疗效评价 分别于术后1、3、6、12个月进行随访。通过超声造影评估消融区域,测量结节3条最大径线,分别以a、b、c表示,并根据公式(1)、(2)计算消融前后结节体积(V)及缩小率。采用超声造影评价消融灶消融及复发情况。观察颈部是否存在异常淋巴结,并对可疑淋巴结进行超声引导下穿刺活检。术后3个月分别对消融灶中央、两侧缘及其旁甲状腺组织进行超声引导下穿刺活检,并进行BRA V600E 检测,明确有无残留及复发。

术后1、3、6、12个月分别比较研究组及对照组结节缩小率。两组内分别按多发、单发分为亚组,并比较体积缩小率。
1.4 统计学方法 采用SPSS 17.0 软件,计数资料组间比较采用χ2检验;计量资料以±s或M(Q25,Q75)表示,组间比较采用t检验或两独立样本比较的秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况比较 研究组、对照组患者性别、年龄、结节最大径、结节体积差异均无统计学意义(P>0.05),见表1。两组患者TgAb、TPOAb 差异均有统计学意义(U=64.000,P=0.000;U=34.000,P=0.000)。两组术后3个月穿刺活检未见癌细胞,术前BRAF V600E 检测阳性者,术后3个月穿刺活检BRAF V600E 为阴性。
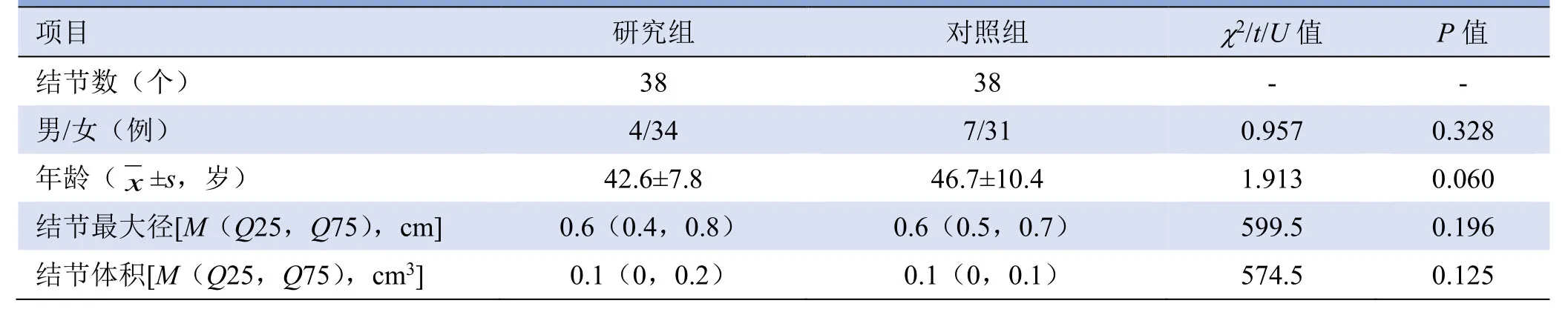
表1 研究组与对照组患者基本资料比较
2.2 病灶缩小情况 研究组术后1个月和3个月消融灶缩小率小于对照组,差异有统计学意义(P<0.05);术后6个月和12个月缩小率差异无统计学意义(P>0.05)。组内单发、多发2个亚组消融灶缩小率差异无统计学意义(P>0.05),见表2、3及图1。
2.3 并发症、射频消融治疗时间及能量比较 两组病例均未发生严重并发症。6例术后有不同程度疼痛,对症处理后缓解;2例发生短暂的声音嘶哑,术后30 min内恢复。研究组、对照组RFA 时间[(194.5±96.6)s比(156.2±83.1)s]及使用能量[0.9(0.5~1.0)kJ 比0.8(0.4~1.0)kJ]比较,差异均无统计学意义(P>0.05)。
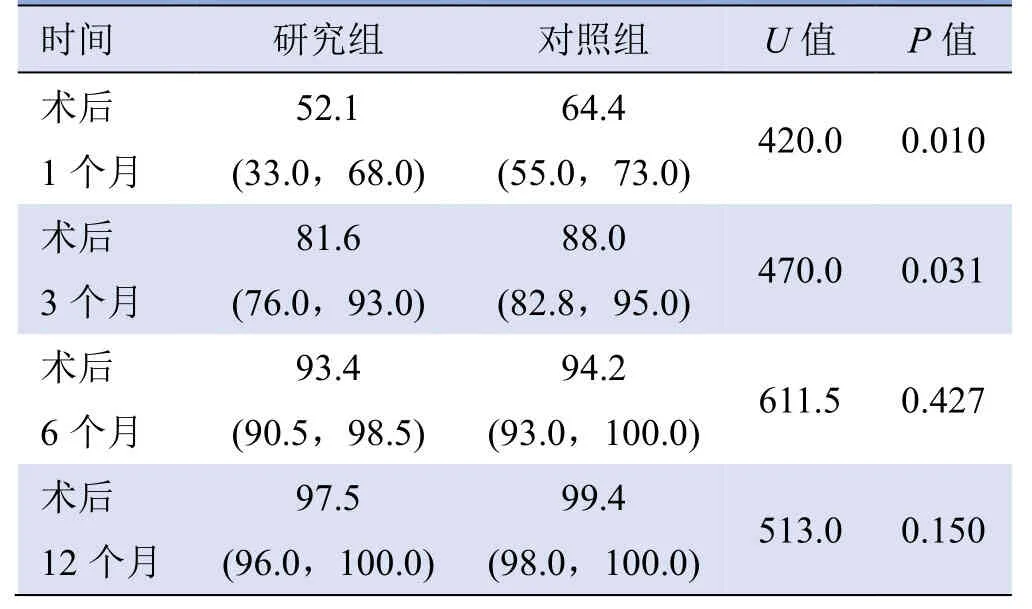
表2 研究组与对照组患者术后不同时间结节体积缩小率变化[M(Q25,Q75),%]
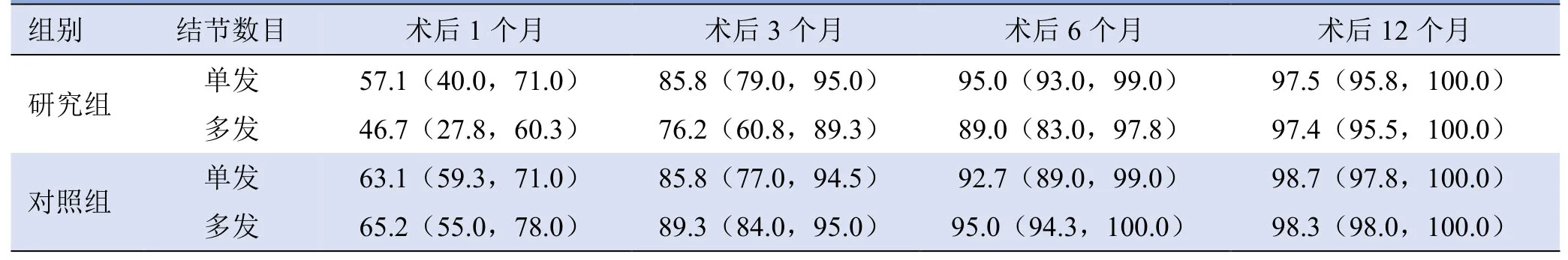
表3 单发、多发结节术后不同时间缩小率比较[M(Q25,Q75),%]
3 讨论
甲状腺乳头状癌是最常见的甲状腺癌,其与HT之间的关系是目前研究的热点[4]。既往研究认为HT是PTC 的前期病变,其癌变率是其他甲状腺疾病的3 倍[5]。合并HT 的PTC 预后较好,颈部淋巴结和远处转移率及复发率较低[6-7]。Marotta 等[8]报道HT 的淋巴细胞浸润对PTC 的预后具有保护作用,推测其原因为HT 的慢性炎症及甲状腺实质的纤维化限制了恶性结节纵向的生长趋势。HT 是一种进展性疾病,患者易出现甲状腺功能减低症状,手术会导致甲状腺功能受损,过度的手术将加速甲状腺功能减低的发展,故患者尽量不行手术治疗[9]。

图1 女,49岁,射频消融治疗HT 合并PTMC。甲状腺右叶中部背侧低回声结节,大小约0.8 cm×0.8 cm×0.7 cm,消融术后即刻,超声造影示消融灶内无造影剂灌注,大小约1.4 cm×1.1 cm×0.9 cm,该区域大于初始肿瘤大小(A);术后1个月结节缩小率约65%(B);术后3个月,结节缩小率约78%(C);术后6个月,灰阶超声及超声造影未显示消融灶(D)
RFA治疗甲状腺结节能够迅速原位灭活肿瘤,并发症少,复发率低,最大程度地保留了甲状腺的功能,能够降低治疗的侵略性。既往研究显示,PTMC 在进行热消融术后的短期随访中未发现局部肿瘤复发或颈部淋巴结转移,无重大手术相关并发症,热消融与手术治疗效果相当[3,10]。
TH 合并PTMC 较低的转移及复发率提高了RFA治疗的可行性[6-8]。本研究中,研究组术后1个月和3个月缩小率小于对照组,推测其原因为甲状腺实质存在慢性炎性改变,以及间质纤维组织增生,吸收较正常组织慢,降低了坏死组织的吸收清除速度;但术后6个月和12个月缩小率差异无统计学意义,可能是HT 背景下启动免疫机制较正常组织慢,后期启动了免疫机制,吞噬坏死物,促进吸收,与张颖等[11]的研究结果有一定的差异,但最终的平均缩小率均超过90%。
章建全[12]报道在探索PTC 热消融治疗时,建议选择低风险患者,如微小、单发、无淋巴结转移、潜伏时间久的病灶。在微创治疗前,务必对颈部淋巴结进行全面评估。本研究中术者对患者严格筛查甲状腺内有无其他病灶,观察颈部淋巴结极为仔细,对超声工作者在操作技巧、颈部解剖等方面均有较高的要求。本组病例除术后1、3、6、12个月常规检查颈部淋巴结外,还在3个月复查时对消融灶中心部位及其周边进行超声引导下细针穿刺活检或细胞学检查,病灶中心可见滤泡退变、坏死,间质纤维组织增生伴慢性炎症细胞浸润,病灶周边可见少许滤泡结构,间质纤维增生伴多核巨细胞反应。可见癌细胞已经完全灭活,被纤维组织增生及炎症细胞浸润取代,通过一定时间的恢复,病灶会被逐渐吸收甚至消失。
本研究中,两组RFA 使用时间及使用能量无显著差异,提示RFA 产生的热量对桥本背景下炎症细胞浸润、纤维组织增生等组织及正常甲状腺组织均产生同等的热效能。
甲状腺相邻结构复杂且重要,血供相对较为丰富,介入性操作具有较高的风险。超声引导下的RFA治疗有超声全程引导与监测,依托液体隔离法的钝性分离作用,使得消融手术有更为安全的穿刺路径和消融操作间距,最大限度地减少了并发症的发生[13]。田文等[14]报道RFA 术后局部组织水肿、坏死,与神经、气管、血管等周围组织粘连,类似肿瘤浸润表现,会严重影响再次外科手术的安全性。液体隔离法使消融灶与周围组织粘连的可能降至最低。本组病例均未出现严重并发症,6例术后有不同程度的疼痛,给予对症治疗后缓解;2例有短暂的声音嘶哑,术后30 min 内恢复。
本研究存在一定的局限性:①样本量较小,RFA治疗HT 合并PTMC 的可行性及安全性还需更大样本研究进行验证;②未对术前及术后甲状腺功能进行对比研究,需进一步完善。
总之,RFA 对于HT 合并PTMC 具有较好的治疗效果,可使肿瘤迅速原位灭活,消除隐患,并发症少,最大程度地保留了甲状腺功能,较外科手术有更大优势。因此,对于HT 背景下的PTMC,超声引导下的RFA 可能成为手术治疗的替代方法。

