腹腔镜下Kimura法与Warshaw法治疗对胰腺癌患者围术期指标及术后并发症的影响
新乡医学院第一附属医院肝胆外科 (河南 卫辉 453100)徐红伟 王大军 游 焜 王 迎 王建国
胰腺癌是常见的消化道恶性肿瘤疾病,居癌因死亡第四位[1]。手术切除是治愈胰腺癌的唯一可能的治疗方案。当前研究认为,对良性及术前根据美国癌症联合会(AJCC)临床分期为Ⅰ期、Ⅱ期,术前影像学考虑无脾门淋巴结转移的胰体尾癌均可将腹腔镜作为治疗方案之一[2-3]。孙志鹏等[4]对腹腔镜保脾胰体尾整块切除手术患者的预后进行了分析,结果显示病患1、3、5年总生存率与同期开腹胰体尾手术报道差异并无统计学意义,证实对此类患者开展腹腔镜保脾胰体尾整块切除手术具有可接受的近远期肿瘤学预后及手术合并症发生率。保留脾血管保脾(Kimura法)与离断脾血管保脾(Warshaw法)是保脾胰体尾整块切除手术中常用的保脾方式[5-6],但究竟何种保脾方式可取得最佳获益仍有待探究。基于此,本研究采集资料并拟通过对照研究方式分析腹腔镜下Kimura法与Warshaw法治疗对胰腺癌患者围术期指标及术后并发症的影响,旨在为胰腺癌的手术治疗提供参考依据。
1 资料与方法
1.1 纳入与排除标准纳入标准:胰体尾癌患者;术前AJCC临床分期为Ⅰ期、Ⅱ期;无脾门淋巴结转移;手术方式为腹腔镜保留脾脏的胰腺远端切除术(laparoscopic spleenpreserving distal pancreatectomy, LSPDP);临床资料保存完整;随访资料无缺失;术式选择遵循患者知情自愿原则。排除标准:术前AJCC临床分期>Ⅱ期;不符合腹腔镜保脾胰体尾整块切除术指征;合并胰腺癌以外的其他恶性肿瘤疾病;肿瘤直径>5cm;embedded型脾动静脉,且存在脾脏病变;局部严重炎症反应,脾静脉与肿瘤分离难度大;脾脏肿大。
表1 两组一般手术情况比较(±s)
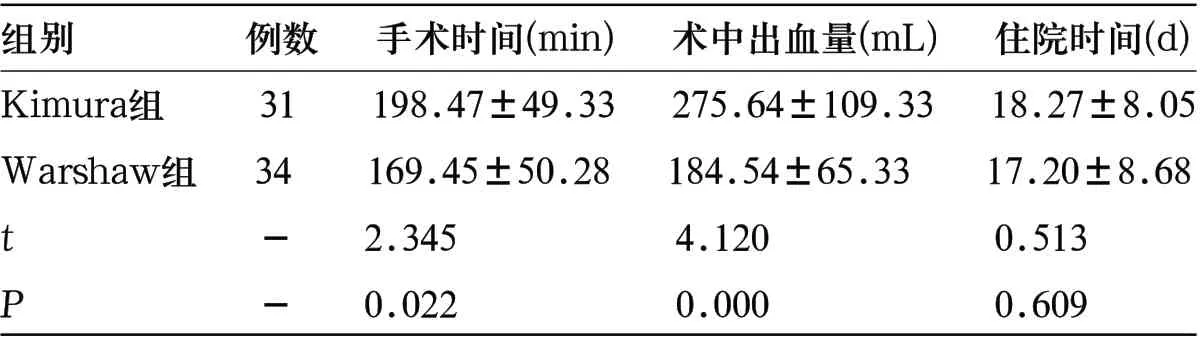
表1 两组一般手术情况比较(±s)
组别 例数 手术时间(min) 术中出血量(mL) 住院时间(d)Kimura组 31 198.47±49.33 275.64±109.33 18.27±8.05 Warshaw组 34 169.45±50.28 184.54±65.33 17.20±8.68 t - 2.345 4.120 0.513 P - 0.022 0.000 0.609
1.2 一般资料本研究为回顾性分析。研究对象为2010年1月至2014年8月在本院接受腹腔镜保脾胰体尾整块切除术的胰腺癌患者。65例符合纳入与排除标准的患者中,31例采用Kimura法保脾、34例为Warshaw法保脾,分别对应Kimura组、Warshaw组。Kimura组男19例,女12例,年龄29~62岁,平均(47.25±18.01)岁;身体质量指数(BMI)(24.32±3.75)kg/m2;美国麻醉师协会(ASA)分级Ⅰ级11例、Ⅱ级20例;头部17例,体尾14例;脾脏大小(11.05±1.07)cm;肿瘤直径(2.27±1.45)cm。Warshaw组男17例,女17例,年龄30~60岁,平均(48.17±17.89)岁;BMI(24.40±3.60)kg/m2;ASA分级Ⅰ级15例、Ⅱ级19例;头部19例,体尾15例;脾脏大小(10.94±1.55)cm;肿瘤直径(2.25±1.41)cm。两组一般资料比较差异无统计学意义(P>0.05)。研究已通过医院伦理委员会审核。
1.3 方法 两组均采用LSPDP术。于脐部下缘作10mm切口建立CO2气腹(气腹压力12mmHg),穿刺套管,30°腹腔镜探查腹腔内有无腹水、肝脏及腹盆腔及腹盆腔有无转移结节;分别于左锁骨中线肋弓下缘、右腹直肌外侧缘肋弓下缘、左腋前线肋缘下、剑突下分别做5~12mm、5mm、5mm、5mm切口,置入trocar;超声刀打开胃结肠韧带,显露远端胰腺,明确病灶位置及其与周围脏器、血管的关系,若有必要可应用腹腔镜超声(LUS)定位病灶位置,超声刀打开胰腺下缘侧后腹膜,充分显露脾静脉。Kimura组在显露脾静脉后游离胰腺上缘并游离脾静脉,上下交替游离出胰体尾约1~2cm,胰颈后方游离一条胰腺上下缘、脾血管主干前方贯通的隧道;将脾动静脉分别上吊,8号导尿管于脾动静脉前方吊起胰腺,病灶右侧2cm处以腹内切割闭合器(Endo-GIA)离断胰腺,保证闭合器在视野范围内,避免周围血管损伤;而后胰腺断面确切止血,提起胰腺断端向左侧翻起,沿脾动静脉游离胰腺体尾部完全将脾动静脉游离后,继续游离胰体尾部与脾门之间的结缔组织,完整的保留脾血管主干、脾门分支及脾脏。若术中中转Warshaw法,此例患者仍纳入Kimura组。Warshaw组术中辨别脾动脉起始部、走形路线,仔细游离后将其起始部夹闭离断,肠系膜下静脉汇入脾静脉较远处离断脾静脉,腔内切割闭合器横断胰腺,将远端胰腺向左侧翻起后,将胰体尾及脾动静脉一并从右向左游离,从脾血管进入脾门前夹闭离断;切除远端及脾血管,将脾脏完整保留。离断脾血管后观察脾脏血运,手术结束后于胰腺断端及腋窝处各放置一根腹腔引流管。两组术后均常规心电监护、禁饮食、使用生长抑素抑制胰酶分泌,并预防抗生素感染,确保胰腺断端引流管引流通畅,并进行补液、营养支持等对症支持,待患者肠鸣音恢复后考虑流质饮食,逐渐过渡至普通饮食。若术后腹部CT检查胰腺周围及腹腔无积液则可逐渐退管后7~10d拔除引流管。
表2 两组术后病理结果比较 [±s,n(%)]

表2 两组术后病理结果比较 [±s,n(%)]
组别 例数 肿瘤组织分型 UICC分期 导管腺癌 乳头状癌 黏液性癌 IA期 IB期 ⅡA期 ⅡB期Kimura组 31 12(38.71) 14(45.16) 5(16.13) 4(12.90) 6(19.35) 2(6.45) 19(61.29)Warshaw组 34 14(41.18) 15(44.12) 5(14.71) 5(14.71) 7(20.59) 3(8.82) 19(55.88)χ2- 0.050 0.250 P - 0.975 0.969

表3 两组并发症比较(n,%)
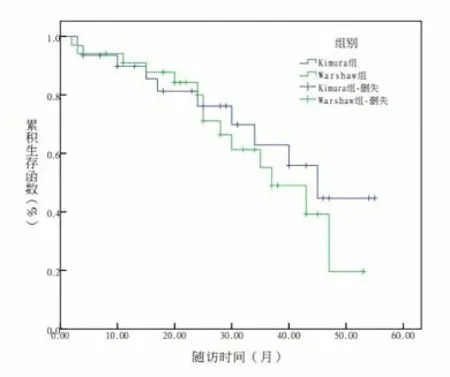
图1 两组远期预后比较(Kaplan-Meier分析)。
1.4 观察指标1)围术期指标:(1)两组手术一般情况,包括手术时间、术中出血量、脾脏大小、肿瘤直径及住院时间;两组术后病理结果,包括手术切缘、肿瘤组织分型及病理分期。2)并发症,包括术后感染、腹腔出血、胰瘘、脾脏梗死、胃底静脉曲张等。3)远期预后:所有患者均予以持续随访,以疾病进展(疾病复发、进展或因疾病复发进展死亡)或失访为随访终点事件,绘制Kaplan-Meier生存曲线比较两组生存率。
1.5 统计学分析SPSS19.0软件进行统计学分析,符合正态分布且方差齐的计量资料用(±s)描述,否则用中位数(四分位数)描述,若符合正态分布且方差齐则进行t检验,否则采用非参数秩和检验;计数资料用n(%)描述,χ2检验、连续校正χ2检验或Fisher精确概率法检验;Kaplan-Meier生存曲线对两组生存情况进行分析,生存率的比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组围术期指标比较
2.1.1 两组一般手术情况比较:两组住院时间比较差异无统计学意义(P>0.05),但Kimura组手术时间显著长于Warshaw组,术中出血量显著低于Warshaw组,差异有统计学意义(P<0.05),见表1。
2.2 两组术后病理结果比较两组患者手术切缘均为阴性,肿瘤组织分型、病理分期比较差异均无统计学意义(P>0.05),见表2。
2.3 两组并发症比较两组并发症发生率比较差异无统计学意义(P>0.05),见表3。
2.4 两组远期预后情况比较所有患者均获得术后随访;Kimura组随访期间复发10例,复发率32.25%,累积1年、3年进展生存率分别为81.30%、55.90%;Warshaw组随访期间复发14例,复发率41.17%,累积1年、3年进展生存率分别为84.20%、61.30%;且两组复发率、总生存率比较差异无统计学意义(χ2=0.438、0.553,P=0.508/0.456)。见图1。
3 讨 论
脾脏是人体内最大的淋巴器官,与机体免疫功能密切相关。随着腹腔镜外科的不断发展,LSPDP的适应症也逐渐从良性胰尾良性肿瘤、交界性肿瘤逐渐扩至低恶性程度的胰尾癌[7]。Kimura法则是当前临床常用的保留脾脏的方式,并已成为胰尾良性或交界性胰腺病变的行业标准,但存在操作难度达、技术要求高的局限性[8]。Warshaw法则无需保留脾脏血管,仅保留胃区动脉,通过胃区动脉在胃后动脉逆行灌注脾脏,也能在一定程度上维持脾脏血液供应,保留基本的脾脏生理功能[9]。但当前在胰腺癌LSPDP术中,究竟采用何种保脾方式仍尚未达成统一共识。而本研究中,两组脾脏大小、肿瘤直径及住院时间比较差异无统计学意义,但Kimura组手术时间显著长于Warshaw组,术中出血量显著低于Warshaw组。同时,术后病理结果显示,两组患者手术切缘均为阴性,肿瘤组织分型、病理分期比较差异均无统计学意义,提示LSPDP中不论采用何种保脾方式均可获得良好的切除效果,且基于两组肿瘤组织分型、病理分期具可比性条件下,Kimura法具更长的手术时间及更多的术中出血量。这与眭昕等[10]的研究结论相符,分析原因是Kimura法需要保留完整的脾动静脉,操作难度更大、操作更精细,从而导致手术时间越长,出血量也随之增多有关。但王栋等[11]报道Kimura法、Warshaw法在手术时间、术中出血量上并无显著差异。分析造成研究结论出现差异的主要原因还是与术者手术技术技巧有关。
而在术后并发症上,本研究主要以感染、腹腔出血、脾脏梗死、胰瘘、胃底静脉曲张为主。其中Kimura组发生1例腹腔出血,系因该例患者在术中剥离脾静脉时损伤了脾静脉。此外,胰瘘也是术后最为常见的并发症之一,但往期研究多认为胰瘘的发生与手术技术技巧密切相关[12],也正因Kimura法术式复杂,因此临床还需加强Kimura法的临床实践,提升术者手术技术技巧。且Kimura组中脾脏梗死发生率也略低于Warshaw组,分析或因Warshaw法切除了脾动静脉有关[13]。同时,本研究中Warshaw组发生2例胃底静脉曲张,分析或因离断脾动静脉的脾脏供血主要来源于胃短血管,脾脏血管侧支循环的建立便是出现胃底静脉曲张甚至出血的主要原因[14]。但本研究中,两组并发症总发生率差异无统计学意义。这与周尊强等[15]的报道结论存在一定差异,其报道Kimura组脾梗死发生率显著低于Warshaw组。分析或因样本量差异有关,其报道中Kimura组样本量有146例。此外,本研究手术也并非由同一手术团队完成,可能存在手术技术技巧差异。为进一步明确Kimura法与Warshaw法的临床价值,本研究还统计了两组随访资料,结果显示两组随访期间复发率比较差异无统计学意义,累积1年无进展生存率分别为81.30%、84.20%,3年无进展生存率分别为61.30%、55.90%,且两组总生存率比较差异也无统计学意义。综上,两组远期预后相当。
综上所述:LSPDP术中,无论采用Kimura法或是Warshaw法均是安全、有效的方式,并具有可接受的近远期获益,不失为治疗胰腺癌的有效方案,但需严格掌握手术指征,且Kimura法解剖更精细。Kimura法虽然操作难度更大,但最大程度上保留了脾脏器官功能,可能降低术后脾脏梗死及胃底静脉曲张风险。

