基于网络药理学探讨西黄丸治疗前列腺癌潜在机制
游旭军,田雪飞,吴泳蓉,高瑞松,周兴,周青,傅伟
基于网络药理学探讨西黄丸治疗前列腺癌潜在机制
游旭军1,2,田雪飞1,吴泳蓉1,高瑞松1,3,周兴3,周青3,傅伟2
1.湖南中医药大学,湖南 长沙 410006;2.深圳市宝安中医院(集团),广东 深圳 518101;3. 湖南中医药大学第一附属医院,湖南 长沙 410011
采用网络药理学方法研究西黄丸治疗前列腺癌的作用靶点和相关信号通路,进一步分析其治疗前列腺癌的理论基础及潜在机制。应用中药系统药理学数据库与分析平台(TCMSP)、中药分子机制的生物信息学分析工具(BATMAN-TCM)获取西黄丸的活性成分和作用靶点,通过GeneCards、OMIM数据库获取前列腺癌的疾病靶点,筛选出与西黄丸共同的靶点,利用String构建共同靶点蛋白相互作用网络,应用Cytoscape3.7.1软件构建成西黄丸活性成分-前列腺癌-靶点交集网络,通过R语言软件对共同靶点进行GO分析和KEGG通路富集分析,筛选出潜在信号通路并分析其作用机制。共获得西黄丸生物活性成分27个,通过筛选得到西黄丸作用于前列腺癌的靶点40个,出现频次较高的有CCND1、EGFR、ESR1、MYC等,主要涉及蛋白体泛素化、蛋白异二聚活性、转录因子活性等生物过程,主要富集在PI3K-Akt、MAPK、AGE-RAGE等信号通路。西黄丸治疗前列腺癌具有多成分、多靶点、多通路的特点,本研究预测的西黄丸治疗前列腺癌机制可为后续实验研究提供理论基础和参考。
网络药理学;西黄丸;前列腺癌;作用机制
前列腺癌是常见的男性恶性肿瘤之一。中医药治疗前列腺癌尤其是中晚期前列腺癌具有提高患者生活质量、延长生存期等优势[1]。西黄丸是治疗早期恶性肿瘤的经典名方,由清代医家王维德所创,原载于《外科治疗汇要》,具有清热解毒、化痰散结、活血消肿、祛瘀止痛等功效,辨证用于多种类型恶性肿瘤早期的辅助治疗。研究表明,西黄丸具有诱导肿瘤细胞凋亡[2]、抑制肿瘤细胞增殖[3]、调节肿瘤内环境[4]、增强机体免疫功能[5]等作用,临床用于乳腺癌、肝癌等可提高患者的生活质量并延长生存时间[6-9],与内分泌结合治疗具有良好的临床疗效[10-12]。
目前西黄丸治疗肿瘤的药效研究仍处于基础阶段,作用靶点及分子机制的研究多为单角度研究,该方治疗前列腺癌的机制研究尚未见报道。本研究以网络药理学为切入点,探讨西黄丸治疗早期前列腺癌的有效活性成分和作用靶点,揭示其可能的分子作用靶点和通路,为深入探讨其作用机制和药效物质基础提供依据。
1 资料与方法
1.1 西黄丸活性成分筛选
应用中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)及中药分子机制的生物信息学分析工具(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm/)检索西黄丸方中牛黄、乳香、没药、麝香的所有活性成分。以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为条件进行筛选,得到西黄丸的生物活性成分。
1.2 活性成分-靶点网络构建
应用TCMSP和BATMAN-TCM数据库检索西黄丸所有活性成分的靶基因,通过Cytoscape3.7.1软件(https://cytoscape.org/)构建活性成分-靶点网络,以探究西黄丸的药理学作用机制。
1.3 前列腺癌疾病靶点筛选
通过GeneCards(https://www.genecards.org/)和OMIM数据库(https://www.omim.org/),设置检索词为“prostate cancer”,检索前列腺癌的疾病靶点,并应用Uniprot数据库(https://www.uniprot.org)对疾病靶点进行标准化,获得Swiss-Prot ID。
1.4 活性成分与疾病共同靶点筛选及蛋白相互作用网络构建
明确前列腺癌相关靶点与西黄丸潜在靶点之间的相互作用,应用R语言(https://www.r-project.org/)软件及Perl语言程序将疾病靶点与药物靶点取交集。应用String(https://string-db.org/)数据平台构建共同靶点蛋白相互作用(protein-protein interaction,PPI)网络,将蛋白种类设置为“Homo sapiens”,将Settings设为“high confidence:0.7”,其他参数保持默认设置,获得PPI网络。应用count.R插件获得共同蛋白靶点出现的频次。
1.5 活性成分-疾病-靶点网络构建
应用Cytoscape3.7.1软件的merge功能构建活性成分-疾病靶点网络。网络图中“node”代表活性成分和靶点,“edge”代表活性成分-前列腺癌-靶点之间的相互关系。基于构建的网络探讨西黄丸治疗前列腺癌的潜在机制。
1.6 GO分析和KEGG通路富集分析
应用R语言(https://www.r-project.org/)软件中clusterProfilerGO.R插件及Perl语言对西黄丸活性成分与前列腺癌的共同靶点进行GO分析,GO分析主要用于描述基因产物的功能,包括细胞组分、分子功能和生物过程。并应用clusterProfilerKEGG.R插件进行KEGG通路富集分析。根据富集因子值分析富集程度,探究西黄丸治疗前列腺癌可能的生物功能及信号通路机制。
2 结果
2.1 西黄丸活性成分
通过TCMSP、BATMAN-TCM数据库对西黄丸组成药物已报道的活性成分进行检索,并以OB≥30%和DL≥0.18为条件进行筛选,去掉重复成分后得到27个生物活性成分,结果见表1。
2.2 活性成分-靶点网络
西黄丸27个生物活性成分的不重复作用靶点共206个,构建活性成分-靶点网络。degree值高的活性成分有可能在西黄丸的药理功能中发挥着较为重要的作用,居前3位的成分分别为槲皮素(quercetin,degree=77)、β-谷甾醇(beta-sitosterol,degree=16)、豆甾醇(Stigmasterol,degree=13)。
表1 西黄丸的主要活性成分
分子编号活性成分OB/%DL MOL001002ellagic acid43.060.43 MOL001004pelargonidin37.990.21 MOL001006poriferasta-7,22E-dien-3beta-ol42.980.76 MOL001026myrrhanol C39.960.58 MOL001028(8R)-3-oxo-8-hydroxy-polypoda-13E,17E,21- triene44.830.59 MOL001029myrrhanones B34.390.67 MOL001031epimansumbinol61.810.40 MOL001033Diayangambin63.840.81 MOL001040(2R)-5,7-dihydroxy-2-(4-hydroxyphenyl) chroman-4-one42.360.21 MOL001045(13E,17E,21E)-8-hydroxypolypodo-13,17, 21-trien-3-one44.340.58 MOL001061(16S, 20R)-dihydroxydammar-24-en-3-one37.340.78 MOL00106215α-hydroxymansumbinone37.510.44 MOL00106328-acetoxy-15α-hydroxymansumbinone41.850.67 MOL001095isofouquierone40.950.78 MOL001126[(5aS,8aR,9R)-8-oxo-9-(3,4,5-trimethoxyphenyl)- 5,5a,6,9-tetrahydroisobenzofurano[6,5-f][1,3] benzodioxol-8a-yl] acetate44.080.90 MOL001131phellamurin_qt56.600.39 MOL0011563-methoxyfuranoguaia-9-en-8-one35.150.18 MOL001175Guggulsterone42.450.44 MOL000358beta-sitosterol36.910.75 MOL000449Stigmasterol43.830.76 MOL000490petunidin30.050.31 MOL000098quercetin46.430.28 MOL008839Methyl desoxycholate34.630.73 MOL008845Deoxycholic Acid40.720.68 MOL008846ZINC0128036546.380.49 MOL000953CLR37.870.68 MOL001295phyllocladene33.400.27
2.3 前列腺癌疾病靶点
通过检索GeneCards、OMIM数据库并设置Relevance score≥17.0筛选,删去重复靶点,共得到485个前列腺癌的疾病治疗靶点。
2.4 共同靶点及蛋白相互作用网络
将485个前列腺癌疾病治疗靶点与药物活性成分作用靶点85个(含重复)应用R语言软件及Perl语言程序共筛选出40个共同靶点,输入String数据平台,在“high confidence:0.7”模式下构建PPI网络,见图1。应用count.R插件统计出现频次居前30位的蛋白靶点,出现频次较高的有CCND1、EGFR、ESR1、MYC等,可作为西黄丸治疗前列腺癌的潜在靶点,见图2。
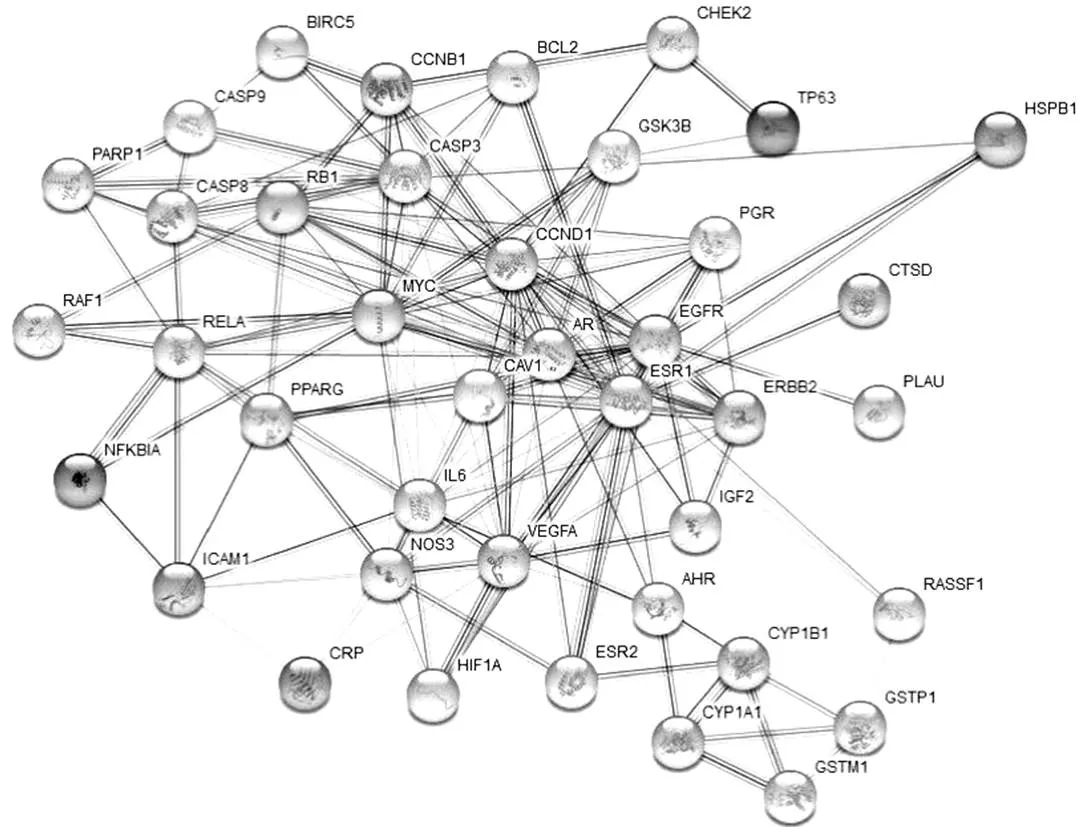
图1 西黄丸治疗前列腺癌药物活性成分-疾病共同靶点PPI网络

图2 西黄丸治疗前列腺癌药物活性成分-疾病共同蛋白靶点出现频次(前30位)
2.5 活性成分-疾病-靶点网络
采用Cytoscape3.7.1软件在活性成分-疾病-靶点网络中获得69个节点(靶点40个,活性成分27个,疾病和药物各1个)和147条边,见图3。
2.6 西黄丸治疗前列腺癌GO分析及核心通路筛选
共同靶点GO分析柱状图和气泡图见图4。其中,生物过程主要涉及蛋白体泛素化、蛋白异二聚活性、转录因子活性等。这体现了西黄丸可能通过调控多个复杂的生物过程治疗前列腺癌。靶点KEGG通路富集分析结果见图5,节点大小表示富集的靶点数量,节点颜色由红色至深蓝色表示值由小到大,因此红色节点越大表示信号通路的显著性越高,该条信号通路越重要。排除广泛通路后,富集靶点数目≥5的信号通路见表2。通过分析,40个共同靶点主要分布在PI3K-Akt、MAPK、AGE-RAGE、HIF-1、Estrogen等多条信号通路中,提示西黄丸通过作用于多条信号通路治疗前列腺癌。以PI3K-Akt信号通路为例,西黄丸治疗前列腺癌的潜在靶点和作用机制见图6。
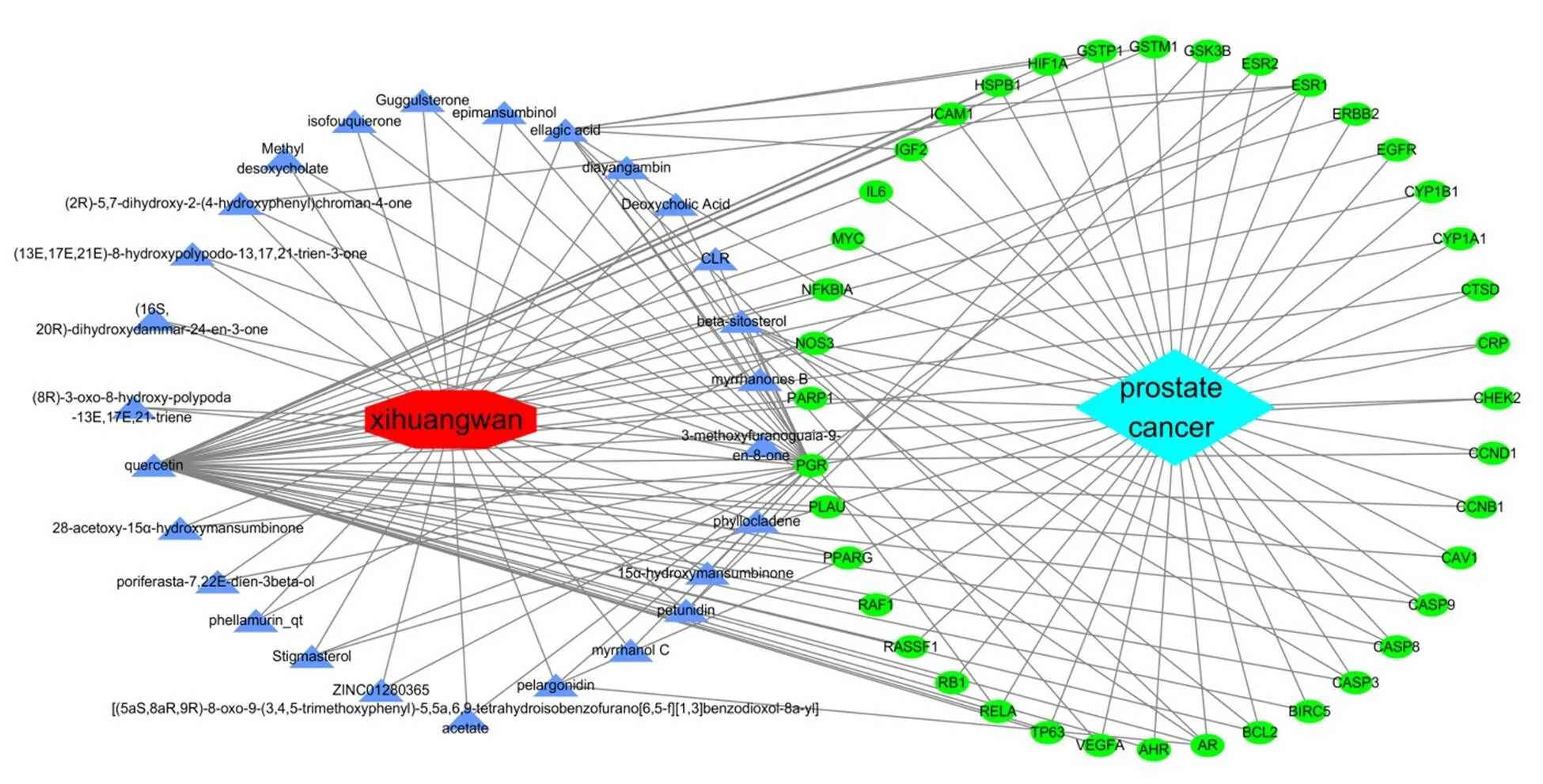
注:红色代表西黄丸,淡蓝色代表前列腺癌,蓝色代表西黄丸活性成分,绿色代表西黄丸活性成分与前列腺癌共同靶点

图4 西黄丸治疗前列腺癌靶点GO分析

图5 西黄丸治疗前列腺癌靶点KEGG富集分析
表2 西黄丸治疗前列腺癌KEGG富集靶点数目≥5的信号通路
ID号信号通路基因数量基因 hsa04151PI3K-Akt signaling pathway13RELA,VEGFA,IGF2,BCL2,CASP9,GSK3B,EGFR,CCND1,IL6,RAF1,ERBB2,MYC,NOS3 hsa04010MAPK signaling pathway9RELA,VEGFA,IGF2,CASP3,EGFR,RAF1,ERBB2,MYC,HSPB1 hsa04933AGE-RAGE signaling pathway indiabetic complications8RELA,VEGFA,BCL2,CASP3,CCND1,IL6,ICAM1,NOS3 hsa04066HIF-1 signaling pathway8RELA,VEGFA,BCL2,EGFR,IL6,HIF1A,ERBB2,NOS3 hsa04915Estrogen signaling pathway8ESR1,PGR,BCL2,ESR2,EGFR,RAF1,NOS3,CTSD hsa04115p53 signaling pathway7BCL2,CASP9,CASP3,CASP8,CCND1,CCNB1,CHEK2 hsa04919Thyroid hormone signaling pathway7ESR1,CASP9,GSK3B,CCND1,RAF1,HIF1A,MYC hsa04917Prolactin signaling pathway6ESR1,RELA,ESR2,GSK3B,CCND1,RAF1 hsa04657IL-17 signaling pathway6RELA,NFKBIA,CASP3,CASP8,GSK3B,IL6 hsa04064NF-kappa B signaling pathway6RELA,NFKBIA,BCL2,PLAU,ICAM1,PARP1 hsa04668TNF signaling pathway6RELA,NFKBIA,CASP3,CASP8,IL6,ICAM1 hsa04926Relaxin signaling pathway6RELA,VEGFA,NFKBIA,EGFR,RAF1,NOS3 hsa04630JAK-STAT signaling pathway6BCL2,EGFR,CCND1,IL6,RAF1,MYC hsa04014Ras signaling pathway6RELA,VEGFA,IGF2,EGFR,RAF1,RASSF1 hsa04370VEGF signaling pathway5VEGFA,CASP9,RAF1,NOS3,HSPB1 hsa04012ErbB signaling pathway5GSK3B,EGFR,RAF1,ERBB2,MYC hsa05235PD-L1 expression and PD-1 checkpoint pathway in cancer5RELA,NFKBIA,EGFR,RAF1,HIF1A hsa04625C-type lectin receptor signaling pathway5RELA,NFKBIA,CASP8,IL6,RAF1 hsa04071Sphingolipid signaling pathway5RELA,BCL2,RAF1,NOS3,CTSD hsa04722Neurotrophin signaling pathway5RELA,NFKBIA,BCL2,GSK3B,RAF1 hsa04068FoxO signaling pathway5EGFR,CCND1,IL6,RAF1,CCNB1 hsa04390Hippo signaling pathway5GSK3B,CCND1,MYC,BIRC5,RASSF1 hsa04621NOD-like receptor signaling pathway5RELA,NFKBIA,BCL2,CASP8,IL6

注:红色节点代表西黄丸作用的潜在靶点及与潜在靶点相关的酶和化合物
3 讨论
前列腺癌属中医学“积聚”“血淋”范畴,其病理因素以痰、瘀、毒为主,治法常以抗癌解毒、活血消癥为主[13]。对于早期前列腺癌患者,临床常在单纯内分泌治疗的基础上运用活血化瘀通窍法。西黄丸由麝香、牛黄、乳香、没药组成,方中牛黄能清心火、解热毒、豁痰、开窍;麝香芳香走窍,能通经络、散瘀消肿、破积聚;乳香与没药相互配合,活血化瘀、消肿定痛。全方共奏活血化瘀通窍、攻毒软坚消积作用,临床用于早期肿瘤的治疗。
本研究从网络药理学入手,初步挖掘、探讨西黄丸治疗前列腺癌的作用机制,为西黄丸多成分、多靶点、多通路的治疗机制提供参考。本研究检索数据库并筛选得到西黄丸的27个生物活性成分,通过活性成分-靶点网络构建得知关键活性成分为槲皮素、β-谷甾醇、豆甾醇等。研究显示,槲皮素可能通过靶向调控核因子-κB相关信号通路而发挥对口腔黏膜鳞状细胞癌的化学预防作用[14];通过抑制Wnt/β-catenin信号通路活化,抑制宫颈癌细胞的增殖和迁移[15];抑制Siha细胞生长、增殖、迁移和侵袭并靶向调控miR-23b/MAPK1轴[16];还能抑制人乳腺癌细胞株T47D的增殖、促进其凋亡[17];通过诱导p53非依赖性G2/M细胞周期阻滞和细胞凋亡,实现对肿瘤细胞增殖的抑制作用[18]。β-谷甾醇通过PI3K/AKT/mTOR通路诱导细胞自噬,抑制胃癌细胞增殖并促进其凋亡[19];对H22荷瘤小鼠具有一定的抑瘤作用,其机制可能与对白细胞介素-6、干扰素-γ和血管内皮生长因子(VEGF)表达的调节有关[20];可诱导人肺腺癌A549细胞G2/M期细胞周期阻滞,并引起细胞凋亡性死亡[21];能有效诱导腔鳞状细胞癌SCC9细胞凋亡[22]。豆甾醇具有抑制人肝癌细胞SMMC-7721的增殖和诱导细胞凋亡的作用[23]。总之,西黄丸的主要活性成分可通过相关信号通路抑制肿瘤细胞的生长或促进其凋亡。
对西黄丸与前列腺癌的共同靶点进行PPI映射并构建活性成分-前列腺癌-靶点网络,对网络进行分析后发现,出现频次较高的关键靶点有CCND1、EGFR、ESR1、MYC、VEGFA、CASP3、AR、IL6等,可作为西黄丸治疗前列腺癌的潜在靶点。CCND1是一种原癌基因[24],其过度表达可致细胞增殖失控而恶性化,在多种肿瘤中发现了CCND1基因过表达和基因扩增等[25]。研究表明,在许多实体肿瘤中存在表皮生长因子受体(EGFR)的高表达或异常表达[26],EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关[27-28];此外,对EGFR与肿瘤的血管生成、高侵袭性及转移关系的研究发现,EGFR可以通过对血管内皮生长因子等水平的调节而影响肿瘤血管生成[29]。MYC基因扩增与肿瘤的关系研究认为,胃癌、乳腺癌、结肠癌、宫颈癌及头部肿瘤等都有MYC基因的扩增或过度表达[30-31]。此外,血管内皮生长因子A(VEGFA)与肿瘤侵染性相关,CASP3基因多态性与前列腺癌风险呈正相关[32]。本研究通过GO分析和KEGG核心通路筛选明确共同靶点在前列腺癌治疗中的生物学作用及信号通路。其中生物过程主要涉及蛋白体泛素化、蛋白异二聚活性、转录因子活性、RNA调控、核受体调节、细胞凋亡等,表明西黄丸可能通过调控多个复杂的生物过程治疗前列腺癌。基因富集分析表明,40个共同靶点主要富集到与癌症相关的通路上,包括前列腺癌通路、蛋白聚糖癌症通路、MiRNAs通路、乳腺癌通路、大肠癌通路等,其主要调控通路有PI3K-Akt、MAPK、AGE-RAGE、HIF-1、Estrogen、p53等,表明西黄丸通过作用于多条信号通路治疗前列腺癌。
研究表明,西黄丸可上调MEKK1、SEK1mRNA和蛋白而诱导肿瘤细胞凋亡[33],作用于STAT3信号通路抑制肿瘤细胞增殖[3],作用于Akt/mTOR/FOXO1通路调节肿瘤内环境[4],降低外周血白细胞介素-17、白细胞介素-6水平而有效调节机体免疫功能等[5]。另外,根据KEGG富集分析结果推断,西黄丸的生物有效成分可能通过作用于与癌症直接相关的通路,从而对多种癌症起到治疗作用,并减轻放化疗术后不良反应,与临床报道[5-12]相符。PI3K-Akt信号通路共富集13个靶基因,与相关研究报道[4]基本一致,显示KEGG富集结果具有可靠性。
本研究通过网络药理学探讨西黄丸治疗前列腺癌的作用机制,结果显示西黄丸中27个生物活性成分通过调控40个靶点、主要参与PI3K-Akt等信号通路作用于前列腺癌,揭示了西黄丸可能的分子作用通路及机制,可为深入探讨其药效物质基础提供可靠的理论依据。
[1] 李小江,牟睿宇,邬明歆,等.中医药治疗去势抵抗性前列腺癌的研究进展[J].中草药,2019,50(4):1007-1011.
[2] 何丽娟,李晋生,陈霞,等.西黄丸含药血清对人乳腺癌细胞株MDA-MB- 435和MCF-7细胞增殖的影响[J].中国中药杂志,2018,43(13):2784- 2788.
[3] 朱正春,姚梦群,严芳莉,等.西黄丸对肝癌HepG2细胞增殖、侵袭及STAT3信号通路的影响[J].安徽医科大学学报,2018,53(12):1875-1878.
[4] SHAO M, HE Z Q, YIN Z X, et a1.pill induces apoptosis of human glioblastoma U-87 MG cells via targeting ROS-mediated Akt/mTOR/FOXO1 pathway[J]. Evidence-Based Complementary and Alternative Medicine,2018,2018:6049498.
[5] 张晓玲,邢荣格,苗志刚,等.西黄胶囊辅助化疗治疗结肠癌术后肝转移疗效及对患者外周血IL-17和IL-6的影响[J].中草药,2015,46(6):871-874.
[6] 芦琴,项景芳,张秉.西黄丸/胶囊辅助治疗乳腺癌有效性和安全性Meta分析[J].中国老年学杂志,2015,35(24):7092-7094.
[7] 周璇,廖盼丽,吴文英,等.西黄胶囊联合GP方案对中晚期乳腺癌患者血清TNF-α,VEGF,MMP-2,MMP-9水平的影响[J].现代生物医学进展, 2017,17(23):4525-4528.
[8] 刘利娜,裘兴栋,王建中,等.西黄胶囊对肝癌术后放化疗不良反应的影响[J].新中医,2019,51(6):240-242.
[9] 王宏岩,彭艳,王大鹏,等.西黄胶囊对妇科恶性肿瘤盆腔淋巴结清扫术后淋巴潴留囊肿的疗效观察[J].中医药信息,2018,35(2):70-74.
[10] 薛小超.西黄胶囊在局部进展期食管鳞癌新辅助放化疗中的应用价值[J].河南医学研究,2019,28(1):130-132.
[11] 陈桂明,彭冰,朱江,等.西黄丸联合三维适形放疗治疗骨转移癌痛的临床观察[J].中医临床研究,2017,9(32):120-121.
[12] 程志强.西黄丸治疗晚期原发性肝癌23例疗效观察[J].中华中医药杂志,2010,25(1):52-54.
[13] 傅伟,杨世坚.陈志强教授应用扶正抑瘤法治疗Ⅳ期前列腺癌浅谈[J].新中医,2013,45(9):165-166.
[14] 章雯,范媛,郑阳玉,等.槲皮素调控NF-κB信号通路对口腔黏膜鳞状细胞癌的化学预防作用[J].南京中医药大学学报,2019,35(2):171-174.
[15] 王香青,马振军,包洪云,等.槲皮素通过抑制β-catenin入核抑制人宫颈癌细胞增殖、迁移的实验研究[J].天津中医药,2019,36(2):195- 199.
[16] 种楠,李勤,冯艳红,等.槲皮素抑制宫颈癌Siha细胞增殖和侵袭实验研究[J].中华实用诊断与治疗杂志,2019,33(2):113-116.
[17] 牟成金,潘武,汪静.槲皮素调控EGFR/AKT/mTOR信号通路对人乳腺癌细胞株T47D增殖和凋亡的影响[J].临床和实验医学杂志,2019,18(14):1460-1464.
[18] 王梓萱,周静,唐玥,等.槲皮素诱导肿瘤细胞P53非依赖的G2/M周期阻滞和凋亡[J].中国药理学与毒理学杂志,2018,32(10):790-796.
[19] 孙玉成,刘晓巍,片光哲.β-谷甾醇诱导人胃癌细胞自噬与凋亡的作用及机制研究[J].中国医师杂志,2019,21(6):866-871.
[20] 林明珠,赵岩,蔡恩博,等.β-谷甾醇对H22荷瘤小鼠体内抗肿瘤作用[J].中国公共卫生,2017,33(12):1797-1800.
[21] 周玲玉,徐彩,王乐琴,等.β-谷甾醇对人肺癌A549细胞增殖及凋亡的影响[J].国际检验医学杂志,2016,37(7):865-867.
[22] 裴浩,李海朋,黄莹莹,等.β-谷甾醇诱导口腔鳞状细胞癌SCC9细胞凋亡及机制研究[J].口腔医学研究,2019,35(1):42-45.
[23] 李庆勇,姜春菲,张黎,等.β-谷甾醇、豆甾醇诱导人肝癌细胞SMMC-7721凋亡[J].时珍国医国药,2012,23(5):1173-1175.
[24] HAN D M, WANG J F, CHENG G H. LncRNA NEAT1 enhances the radio-resistance of cervical cancer via miR-193b-3p/CCND1 axis[J]. Oncotarget,2018,9(2):2395-2409.
[25] LAN F J, ZI T Z, ZHENG L L, et a1. Downregulation of miR-503 promotes ESCC cell proliferation, migration, and invasion by targeting cyclin D1[J]. Genomics, Proteomics & Bioinformatics, 2017,15(3):208-217.
[26] 赵岳阳,张海霞,韩晨冉,等.胃癌中EGFR表达与预后关系的Meta分析[J].宁夏医科大学学报,2017,39(5):550-554.
[27] 李召卿,周旋,张仑.表皮生长因子受体在人头颈部鳞状细胞癌中的作用研究进展[J].中国肿瘤临床,2018,45(6):301-305.
[28] YANG Z, YANG J Q, CHEN Y D, et a1. Acquired EGFR L718V mutation as the mechanism for osimertinib resistance in a T790M-negative non-small-cell lung cancer patient[J]. Targeted Oncology,2019, 14(4):1-6.
[29] 王瑞玥.EGFR和VEGF联合检测在乳腺癌中表达的临床意义[J].中国医药指南,2019,17(23):69.
[30] MINORU K, JOAQUIM C, YARA Y K, et a1. A case of diffuse large B-cell lymphoma with MYC gene cluster amplification related to chromothripsis[J]. Leukemia & Lymphoma,2018,59(10):2460-2464.
[31] KARIM R, ROBERTA A, MICHELANGELO F, et a1. MYC amplification as a potential mechanism of primary resistance to crizotinib in ALK-rearranged non-small cell lung cancer:a brief report[J]. Translational Oncology,2019,12(1):116-121.
[32] LOPPEZ T N, AGUIN N, CASTUERA I P, et a1. Association of CASP3 genetic polymorphisms rs1049216, rs2705897 and rs4647603 with the risk of prostate cancer in Galicia (NW Spain)[J]. Gene,2018.DOI:10.1016/j.gene.2018.08.073.
[33] 江一鸣,苏亮,徐钰,等.西黄丸调节MEKK1/SEK1通路抑制小鼠乳腺癌生长机制研究[J].现代中药研究与实践,2019,33(1):24-29.
Discussion on Potential Mechanism ofPills in Treatment of Prostate Cancer Based on Network Pharmacology
YOU Xujun1,2, TIAN Xuefei1, WU Yongrong1, GAO Ruisong1,3, ZHOU Xing3, ZHOU Qing3, FU Wei2
To study the therapeutic targets and related signaling pathways ofPills in the treatment of prostate cancer by network pharmacology; To further analyze the theoretical basis and potential mechanism for the treatment of prostate cancer.The active ingredients and targets ofPills were obtained by using Traditional Chinese Medicine System Pharmacology Database and Analysis Platform (TCMSP) and Bioinformatics Analysis Tool for Molecular Mechanism of Traditional Chinese Medicine (BATMAN-TCM). The targets of prostate cancer were obtained through GeneCards and OMIM database; the common targets withPills were screen out. String was used to build a common target protein interaction network. Cytoscape 3.7.1 software was used to construct a network of active ingredients ofPills -prostate cancer -target intersection. GO analysis and KEGG analysis were conducted for common targets through R language software, the potential pathways were screened out, and their mechanism of action were analyzed.A total of 27 bioactive components were obtained fromPills, and 40 common targets ofPills for prostate cancer were obtained by screening intersection. The most frequent occurrences were CCND1, EGFR, ESR1, MYC, etc. These targets were mainly involved in biological processes, such as ubiquitination, protein heterodimerization, and transcription factor activity, and were mainly concentrated in PI3K-Akt, MAPK, AGE-RAGE and other signaling pathways.Pills treats prostate cancer has characteristics of multi-component, multi-target and multi-pathway. The predicted mechanism ofPills in the treatment of prostate cancer can provide a reliable theoretical basis and reference for subsequent experimental research.
network pharmacology;Pills; prostate cancer; mechanism

R273.72;R285.5
A
1005-5304(2020)10-0092-07
10.19879/j.cnki.1005-5304.201910428
国家自然科学基金(81573988);国家中医药管理局中医男科重点学科(2012年);湖南省科技计划项目(2015JC3075);湖南省高层次卫生人才“225”工程培养项目(2019年);深圳市科技计划项目(JCYJ20180302144752020)
周青,E-mail:supergoon@163.com
(2019-10-28)
(2019-11-21;编辑:陈静)

