CO2激光犬声带全切除后不同时间细胞外基质表达△
汪斌如 张莹莹 杨丽萍 刘莉 陈始明 梁耕田
声带固有层主要由细胞外基质(extracellular matrix, ECM)组成,其组织结构决定了声带的振动特性和粘膜波功能,是正常发声的基础[1,2]。正常情况下,ECM的合成和降解处于动态平衡,以维持声带的发声功能;在手术、感染、外伤等病理情况下,ECM的动态平衡受到破坏,就会出现声带瘢痕而引起永久性声嘶甚至失声[3,4]。目前有关声带损伤后ECM中相关因子表达致声带瘢痕的具体发病机制尚不清楚,其可能是声带瘢痕形成和难以治愈的原因之一[2~4]。前期研究显示,犬声带损伤后12 w时声带固有层ECM胶原纤维过度无序增生和弹性纤维减少,出现了声带瘢痕[5]。赖氨酰氧化酶(lysyl oxidase, LOX)、基质金属蛋白酶(matrix metalloproteinases, MMPs)和缺氧诱导因子-1α(hypoxia inducible factor 1α, HIF-1α)在ECM的合成和伤口愈合中发挥重要作用[6~8],其中,LOX参与ECM胶原蛋白和弹性蛋白的翻译后修饰过程,MMPs参与ECM各种蛋白的降解、血管形成,MMPs的异常表达是组织损伤后不能自我修复的重要原因;HIF-1α参与了组织损伤后的蛋白合成和微血管形成等过程。有关研究显示,调节LOX基因和MMP基因的表达对韧带和心肌损伤修复具有重要的影响[9~11]。目前有关LOX、MMPs和HIF-1α在声带修复中的研究较少,推测LOX、MMP-1可能在声带损伤后创面自身愈合及瘢痕形成中发挥着不同的作用。故本研究拟采用CO2激光切除犬双侧声带,观察术前和术后不同时间段声带形态学、ECM中LOX、MMP-1和HIF-1α在声带创面愈合过程中的动态表达特点,探讨声带损伤后的修复机制。
1 材料与方法
1.1实验动物及分组 5只健康成年雄性中华田园犬(湖北省瑞科森试验动物有限公司提供,体重12~15 kg),数字表法随机分为实验组(4只,8侧声带)和对照组(1只,2侧声带)。实验组分别行支撑喉镜下CO2激光双侧声带切除术,于术后6 h、3 w、8 w和12 w分别处死1只犬于声带取材,对照组不做特殊处理。所有实验操作均符合武汉市第三医院动物伦理委员会要求。
1.2主要器材及试剂 Lumenis型贝多芬智能CO2激光(美国科医人),IX51型倒置显微镜和CX-21型普通光学显微镜(日本OLYMPUS),显微喉钳、支撑喉镜、高清喉内窥镜及视频记录系统、冷光源、0°内窥镜镜头(德国karl Storz),anti-LOX抗体,anti-MMP-1抗体和anti-HIF-1α抗体(北京Bioss)。
1.3CO2激光犬声带全切除术 实验组动物术前禁食12 h,称重,左后肢肌肉注射麻醉(速眠新0.1 mg/kg+戊巴比妥钠0.8 mg/kg),在支撑喉镜下暴露双侧声带,应用CO2激光6焦耳/秒行双侧声带全切除深达肌层,清除创面碳化组织,充分止血。术后软食,1 w后改正常饮食。对照组在支撑喉镜下观察声带形态后不作任何处理,清醒后正常进食。
1.4犬声带形态学观察 对照组和实验组犬分别于术前及术后6 h、3 w、8 w和12 w肌肉注射麻醉(方法同上)后,于支撑喉镜下观察声带创面愈合情况,并于各时间点取一只犬实施安乐死,双侧声带多点取材进行HE染色和免疫荧光染色检查。
1.5HE染色 声带标本用4%甲醛固定,石蜡包埋切片,片厚4 μm,HE染色。光学显微镜下观察声带各层炎症反应、纤维结构变化以及瘢痕形成情况。
1.6免疫荧光染色 声带标本石蜡切片,烘片脱蜡。PBS冲洗3次。EDTA缓冲液微波修复。PBS洗3次各5 min,甩干,5% BSA封闭20 min。去除BSA液,每张切片加50 μl一抗,覆盖组织,4 ℃过夜。PBS洗三次,各5 min,加二抗,37 ℃孵育50 min;PBS 洗三次,各5 min;防淬灭剂封片。每个标本随机取1张切片,每张片任选2~3个视野,视野面积为0.51 mm×0.40 mm。荧光显微镜下观察声带LOX、MMP-1和HIF-1α蛋白表达部位和量,以及声带瘢痕的形成情况。高倍镜(×400)下取3个不重叠视野,矫正光密度后对各组图像选色,采用Image-Pro Plus 6.0软件分析系统测量图像共定位区域累积光密度值(integrated optical density index, IOD值),反映共定位区域面积和荧光强度。
1.7统计学方法 以IBM SPSS Statistics 22.0行统计学分析,图像采集的IOD值用均数±标准差表示。各组数据呈正态分布并经方差齐性检验后,多组间比较用One-Way ANOVA中的LSD或Dunnett检验,采用Pearson进行相关分析,检验水准α=0.05。
2 结果
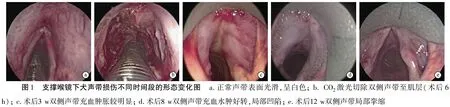
2.1对照组及实验组犬声带形态学观察结果 支撑喉镜下犬正常声带表面呈白色,可见血管纹,粘膜光滑,声门闭合及发音功能良好(图1a);CO2激光切除犬双侧声带至肌层(图1b,术后6 h);术后3 w声带创面见较明显的充血水肿及炎性分泌物(图1c);术后8 w双侧声带充血水肿试验,声带局部凹陷(图1d);术后12 w双侧声带充血水肿消失,表面光滑,无粘连和肉芽,声带局部挛缩,双侧声带闭合不全,声嘶明显(图1e)。
2.2犬声带组织HE染色结果 术前声带分层清晰,由被覆复层鳞状上皮层、结缔组织层、肌层构成(图2a);术后6 h,声带创面大量红细胞和炎性细胞浸润,细胞充血水肿明显(图2b);术后3 w,声带创面上皮下固有层仍有炎症细胞浸润,新生微血管形成,成纤维细胞增生,无序排列,间质水肿(图2c);术后8 w,声带创面炎性细胞浸润减少,无明显红细胞渗出,血管增粗,各层纤维组织增生,呈束状或团状紊乱排列(图2d);术后12 w,声带上皮层大部分缺失,复层鳞状上皮细胞层数增多;固有层血管或腺体减少或消失,腺体内有黏蛋白积聚;固有层胶原纤维增厚、增多,纤维组织团状或束状紊乱排列,较多不规则纤维裂隙;肌层可见散在紊乱的胶原纤维束(图2e)。
2.3免疫荧光染色结果
2.3.1ECM相关因子阳性细胞表达 由图3可见,LOX、MMP-1和HIF-1α均定位于细胞核和细胞浆,术前(对照组)和术后(实验组)声带均呈程度不一的阳性反应。术前阳性细胞主要位于固有层全层,浅层含量略多。术后6 h和3 w,双侧声带创面上皮细胞和纤维层的炎性细胞、血管内皮细胞和腺体内阳性细胞表达较强烈;术后8 w和12 w,双侧声带创面阳性细胞逐渐减少,恢复至术前水平。
2.3.2IOD值分析 术前及术后6 h、3 w、8 w和12 w各因子IOD值见表1,可见各时间点LOX、MMP-1比较差异有统计学意义(P<0.05);除术后12 w与术前比较外,其余各时间点HIF-1α比较差异有统计学意义(P<0.05)。
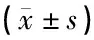
表1 各相关因子在犬声带损伤不同时间段免疫荧光IOD值比较


3 讨论
徐文等[12]报道声带损伤后3个月声带瘢痕基本形成。本研究实验组犬CO2激光声带全切除后支撑喉镜下显示,CO2激光手术创面位于双侧声带,深达肌层,术后3 w,声带创面仍有充血水肿,术后8 w声带创面充血水肿减轻,表面凹陷,术后12 w声带创面不规则瘢痕基本形成。组织学观察显示声带损伤早期(术后3 w),创面较多炎性渗出,间质充血水肿,新生血管形成;损伤中期(术后8 w),创面炎症反应明显减少,纤维组织增生明显;损伤后期(术后12 w),创面纤维组织大量增生,呈团状或束状排列紊乱,较多不规则间隙,排列结构紊乱,提示声带瘢痕形成。
LOX促进ECM胶原和弹性蛋白的翻译后修饰过程,同时维持ECM内环境免受金属蛋白酶的降解,在ECM的生长、重塑、稳定和伤口愈合中发挥重要作用[5,6];LOX过表达时,引起ECM的过度交联,引发不可逆的渐进性的组织纤维化。MMPs是胶原和弹性纤维降解的主要蛋白酶,参与ECM的降解、促进新生血管的形成、调节细胞间粘附等;MMP-1由成纤维细胞、巨噬细胞、内皮细胞等多种细胞分泌,主要降解Ⅰ、Ⅱ、Ⅲ、Ⅵ、Ⅹ型胶原并促进新生血管形成[7,10]。本研究结果显示,LOX、MMP-1和HIF-1α定位于细胞浆和细胞核,大多在炎性细胞,血管内皮细胞和腺体内表达较强烈。声带损伤早期(术后6 h)LOX表达稍有下降,此后其合成不断增加,损伤中后期(术后3~12 w)时仍维持较高水平;MMP-1在声带损伤早期(术后6 h)表达较术前下降,声带损伤中期(术后3 w)升高达最高值,至声带损伤后期(术后12 w)达较低水平,这与部分学者报道前交叉韧带损伤后成纤维细胞中LOX基因表达上升、MMP-1主要基因表达下降的结果一致[11,13]。即MMP-1主要在声带瘢痕形成早期发挥作用,而LOX主要在声带瘢痕形成中后期发挥作用,但MMP-1在声带瘢痕形成全程中的表达量明显少于LOX,不足以对抗LOX的纤维化作用。低氧环境是瘢痕形成的重要因素,声带创伤早期,组织缺氧会影响成纤维细胞的活性,胶原的合成与降解、生长因子的分泌。HIF-1α是缺氧的特异感受因子,通过协助蛋白合成、血管再生促进创面愈合。文中结果显示,声带损伤早期(术后6 h),HIF-1α迅速增加至峰值,中后期(术后3~12 w)逐渐恢复至正常水平;HIF-1α在术后12 w和术前相比未见明显统计学差异,说明HIF-1α主要在声带损伤早中期(8 w内)发挥作用。需要指出的是,由于IOD值仅间接反映阳性目标总的表达强度,加之本研究观察标本数量较少,损伤的程度和个体愈合的机制可能有所不同[14],这些因素均可能导致上述结果存在一定的误差。
较多学者认为声带术后15 d内处于极度活跃增生状态,3个月后瘢痕组织趋于稳定[1,15]。文中结果显示术后6 h、3 w和8 w LOX、MMP-1和HIF-1α表达差异有统计学意义,即LOX、MMP-1和HIF-1α在术后早中期(<8 w)表达较活跃,至术后12 w时随着创面基本愈合其表达也趋于稳定。LOX、MMP-1在术前和术后不同时间段表达有统计学差异,尤其是术后12 w时仍未回复至术前水平,说明术后12 w时LOX、MMP-1仍处于较高表达状态,声带瘢痕仍未完全稳定,也间接证实了部分学者报道的声带损伤后6~12个月时声带瘢痕中纤维蛋白表达量较术前仍有增加[12,16]。
综上所述,正常声带ECM中LOX、MMP-1和HIF-1α的表达很低,在创伤时,声带组织发生应激反应,由成纤维细胞、巨噬细胞、内皮细胞合成的MMP-1增加,促进ECM中各种胶原降解、细胞黏附[5,7],HIF-1α等物质合成增加也会直接或间接参与微血管形成[8]。但由于MMP-1和HIF-1α在声带损伤早中期表达量较少,发挥的作用有限,对声带瘢痕的预防和治疗效果尚不明显。在声带损伤中后期,LOX过度表达,参与ECM纤维蛋白的翻译后修饰过程,导致大量的胶原纤维过度分泌和无序沉积,以及弹性纤维减少,促进了声带瘢痕形成[9,14,17]。故探讨靶向促进MMP-1和HIF-1α的表达,同时靶向抑制LOX的合成,可能为声带瘢痕的防治提供新的研究思路[9~11]。

