即食鸭制品大肠埃希菌污染状况、毒力基因和耐药特征分析
杨 华,马 艳,刘秀婷,吕文涛,卢立志,肖英平,*
(1.省部共建农产品质量安全危害因子与风险防控国家重点实验室(筹),浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021; 2.浙江正明检测有限公司,浙江 宁波 315200; 3.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021)
大肠埃希菌(Escherichiacoli)是革兰氏阴性菌,属于肠杆菌科埃希氏菌属,在食品卫生上常被作为检测指标,是人和动物肠道中大量分布的一种细菌。大肠埃希菌病作为一种潜在的人兽共患病[1],有重要的流行病学及公共卫生学意义[2]。鸭大肠埃希菌病是指由禽致病性大肠埃希菌(APEC)引起的感染性疾病,在临床上有大肠埃希菌性败血症、呼吸道型大肠埃希菌病、肿头综合征、腹膜炎、滑膜炎、腹水症和鼻窦炎等多种病型[3]。由于大肠埃希菌种类繁多,血清型较复杂,给免疫防治带来一定的困难,因此,药物防治是目前控制该病的主要手段[4]。但随着药物的大量及不合理使用,加快了大肠埃希菌耐药性的产生[5],不仅影响抗菌药物在兽医临床上的疗效,而且其耐药菌株可通过食物链进入人体,对人类的健康安全造成威胁。
对于水禽中大肠埃希菌的研究主要集中于从活禽或者病料中分离获得大肠埃希菌来开展致病性和耐药性研究[6-9],而对于水禽产品如即食鸭制品中大肠埃希菌的毒力基因以及耐药特征研究甚少。本文旨在研究即食鸭制品中大肠菌群污染情况及分离出的大肠埃希菌的毒力基因和耐药特征,探讨其耐药基因多态性和遗传多样性,以期为即食食品中耐药菌株流行病学研究提供理论依据。
1 材料与方法
1.1 样品采集与菌株分离鉴定
分别在浙江、上海、福建、江苏、广东、北京、黑龙江、内蒙古、贵州、湖北和四川11个省份采集即食鸭制品491份,用于大肠埃希菌的分离。大肠埃希菌的分离方法参照GB 4789.6—2016《食品微生物学检验 致泻大肠埃希氏菌检验》进行。采用布鲁克microflex MALDI TOF/TOF 质谱仪进行菌株的分离鉴定。
质控菌株为大肠埃希菌ATCC25922。
1.2 耐药谱测定
大肠埃希菌的耐药谱采用梅里埃VITEK 2 Compact全自动细菌鉴定及药敏分析系统进行测定。测定的抗生素种类如下:青霉素类、头孢菌素类、单环β内酰胺类、碳青霉烯类、氨基糖苷类、喹诺酮类、甘氨酰四环素类、呋喃类和磺胺类。
1.3 基因组DNA提取
采用煮沸法提取大肠埃希菌基因组DNA,用于PCR反应[10]。
1.4 毒力基因分析
以提取的大肠埃希菌基因组DNA为模板,参照GB 4789.6—2016中大肠埃希菌紧密素基因(gene encoding intimin forEscherichiacoliattaching and effacing,eae),侵袭性质粒抗原H基因(invasive plasmid antigen H-gene,ipaH),侵袭性质粒调节基因(invasive plasmid regulator,invE),热不稳定性肠毒素基因(heat-labile enterotoxin,lt),集聚黏附菌毛调节基因(aggregative adhesive fimbriae regulator,aggR),肠定植因子基因(protein involved inintestinal colonization,pic),蛋白分泌物调节基因(gene encoding LEE-encoded type Ⅲ secretion system factor,escV),志贺毒素Ⅰ基因(Shiga toxin one,stx1),志贺毒素Ⅱ基因(Shiga toxin two,stx2)等毒力基因的引物序列(表1)进行PCR扩增,PCR扩增反应程序为95 ℃,5 min预变性;然后94 ℃,30 s,58 ℃,30 s;72 ℃,1 min,共32个循环。PCR产物在1.5%琼脂糖凝胶中进行电泳分析结果。

表1 毒力基因引物Table 1 Virulence gene primers
1.5 耐药基因分析
从磺胺类、喹诺酮类、四环素类、氯霉素类、大环内酯类、青霉素类、氨基糖苷类和多粘菌素类等8类抗生素耐药基因中共选取了18种典型的耐药基因进行大肠埃希菌分离株携带的耐药基因分析,参照王佩佩等[11]所用的引物,具体见表2。PCR扩增反应程序为95 ℃,5 min预变性;然后94 ℃,30 s,58 ℃,30 s;72 ℃,1 min,共32个循环。PCR产物进行琼脂糖凝胶电泳分析结果。

表2 耐药基因引物Table 2 Drug resistance gene primers

续表2 Continued Table 2
针对产超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)的大肠埃希菌进行β-内酰胺酶基因分析,参照文献[12]设计引物,具体引物序列见表3。

表3 β-内酰胺酶基因引物Table 3 β-lactamase gene primers
1.6 Ⅰ型整合酶基因和Ⅰ型整合子基因盒检测
以大肠埃希菌基因组DNA为模板,参照文献[6]所述的引物进行PCR扩增,Ⅰ型整合酶基因(Intl)引物为5′-CCTCCCGCACGATGATC-3′和5′-TCCACGCATCGTCAGGC-3′;Ⅰ型整合子基因盒引物为5′-GGCATCCAAGCAGCAAG-3′和5′-AAGCAGACTTGACCTGA-3′。反应条件为94 ℃,5 min;94 ℃,30 s;58 °C(Intl)或55 ℃(Ⅰ型整合子基因盒),30 s;72 ℃,1 min,共30个循环;72 ℃,10 min。PCR扩增后经1.5%琼脂糖凝胶电泳检测。
基因盒插入区PCR扩增产物经电泳分离后,采用AxyPrepDNA凝胶回收试剂盒回收纯化,连接于pMD18-T载体上并转入感受态细胞,由生工生物工程(上海)股份有限公司进行测序,并对测序结果进行BLAST比对分析。
2 结果与分析
2.1 不同地区大肠埃希菌检出情况
在全国11个不同省份共采集了491份样品,其中109份样品中检出大肠埃希菌,平均检出率为22.20%(表4)。
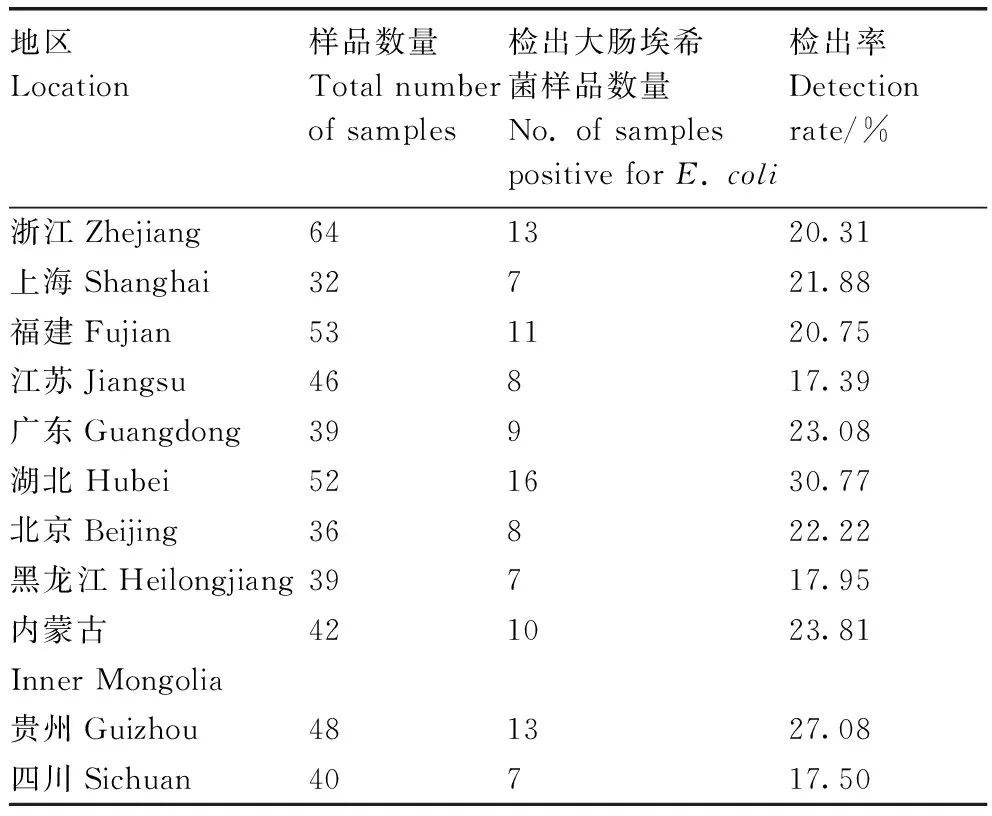
表4 不同地区大肠埃希菌检出情况Table 4 Detection percentage of E. coli in different areas
2.2 毒力基因分析
图1为大肠埃希菌9个毒力基因的检出率结果。在检测的9个毒力基因中,毒力基因escV的检出率最高,达7.34%,其次为pic,为6.42%,ipaH和aggR均为3.67%,stx2为2.75%,eae、lt和stx1均为1.83%,invE基因未检出。
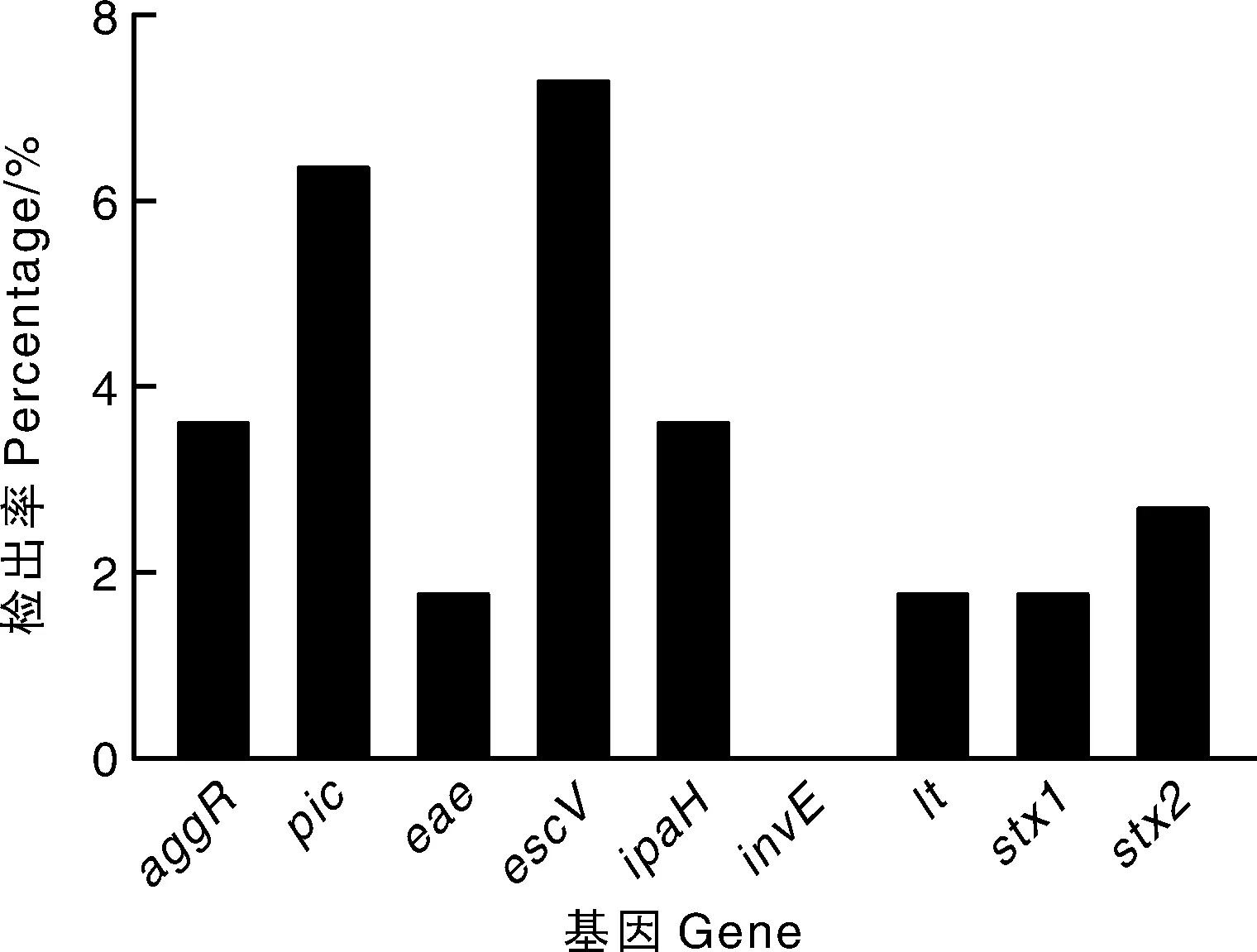
图1 大肠埃希菌的毒力基因检出率Fig.1 Percentage of virulence genes in E.coli
2.3 大肠埃希菌耐药表型分析
表5为109株大肠埃希菌的17种抗生素的耐药表型结果。大肠埃希菌对不同类型抗生素表现出不同程度的耐药。其中对于磺胺类中的复方新诺明耐药性最高,耐药率高达63.30%,其次为青霉素类中的氨苄西林,耐药率为61.47%,喹诺酮类中的环丙沙星为22.94%,氨基糖苷类中的庆大霉素和头孢菌素类中的头孢唑啉均为20.18%,头孢曲松为19.27%,左旋氧氟沙星为18.35%,妥布霉素为11.93%,氨曲南为10.09%,头孢西丁为3.67%,阿莫西林-棒酸为2.75%,呋喃妥因和头孢匹美均为1.83%,其余4种(哌拉西林-他唑巴坦、厄他培南、亚氨培南、替加环素)为0。
图2为分离的109株大肠埃希菌的多重耐药分布情况。其中耐药数为12和11的菌株比例均为2.75%(3/109,3/109),耐药数≥3的菌株株比例为60.55%(66/109)。
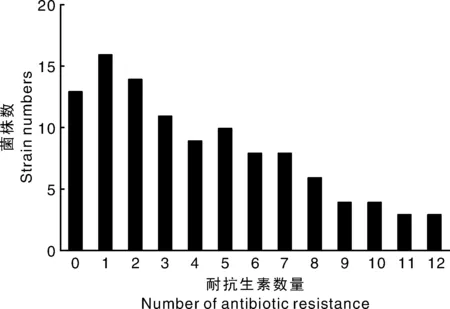
图2 大肠埃希菌的多重耐药分布情况Fig.2 Multi-drug resistance of isolated E.coli
2.4 耐药基因分析
图3为大肠埃希菌18种耐药基因的检出率结果。其中,大肠埃希菌磺胺类药物耐药基因sulⅠ和sulⅡ检出率最高,分别为100%和88.07%,喹诺酮类基因qnrS和qepA,氨基糖苷类耐药基因aadA1和mecC的检出率也较高,均在35%以上。
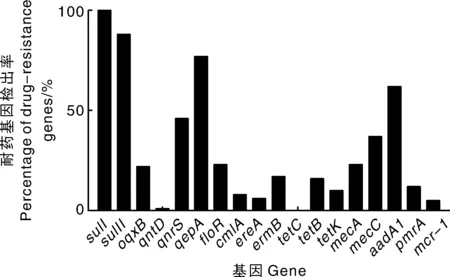
图3 大肠埃希菌耐药基因检出情况Fig.3 Percentage of drug-resistance genes of E.coli
2.5 β-内酰胺酶耐药基因分析
在109株分离的即食鸭制品大肠埃希菌中,其中24株产ESBLs。为了进一步探析其耐药基因携带情况,采用PCR对所有产ESBLs的大肠埃希菌进行β-内酰胺耐药基因检测,结果发现,CTX-M的检出率为100%(24/24),TEM、SHV、CTX-M-1、CTX-M-2、CTX-M-9和CTX-M-25的检出率分别为95.83%(23/24)、4.17%(1/24)、66.67%(16/24)、12.50%(3/24)、75.00%(18/24)和4.17%(1/24),CTX-M-8未检出(图4)。
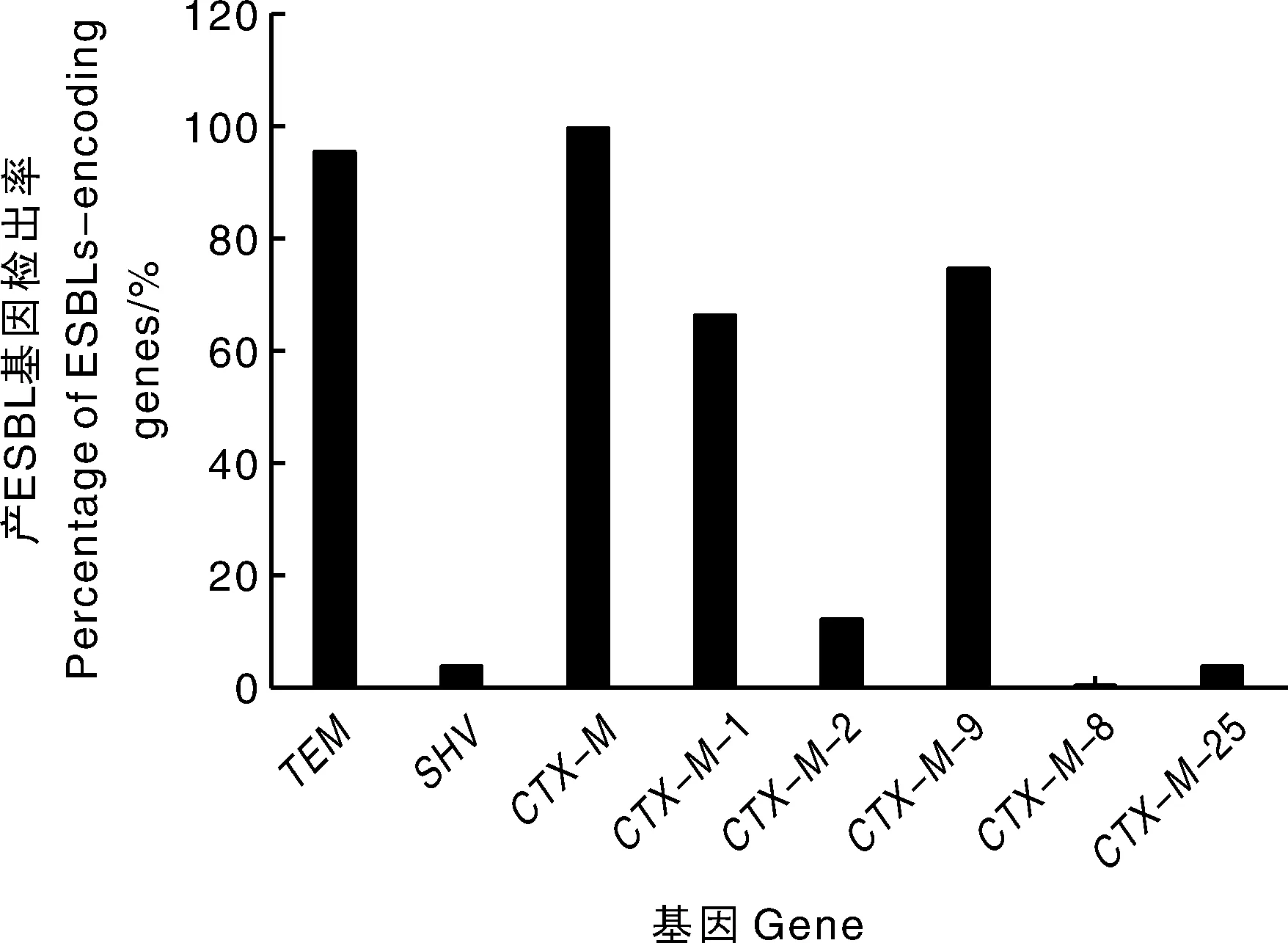
图4 ESBLs阳性大肠埃希菌β-内酰胺酶基因检出情况Fig.4 Percentage of β-lactamase drug-resistance genes in ESBLs-positive E.coli
2.6 Ⅰ型整合子和基因盒分析
检测109株大肠埃希菌的Ⅰ型整合子发现20株为Ⅰ型整合子阳性,检出率为18.35%。对20株Ⅰ型整合子阳性大肠埃希菌基因盒扩增产物电泳分析发现,7株携带3种不同大小基因盒插入片段,其中2株大肠埃希菌Ⅰ型整合子基因盒插入的为dfrA1-aadA1,4株为dfrA12-aadA2,另1株为aadA22。
3 讨论
大肠埃希菌的致病性是由多种毒力因子共同作用的结果,这些毒力因子之间相互协调,破坏宿主的防御系统,进而引起炎症反应。其中,肠定植因子基因pic使大肠埃希菌黏附于宿主肠粘膜而不被肠蠕动和肠分泌液所清除,是大肠埃希菌致病的首要因素[13]。本研究中即食鸭制品大肠埃希菌的毒力基因分析发现,毒力基因escV的检出率最高,其次为pic,ipaH、aggR、stx2、eae、lt和stx1也均有检出,说明即食鸭制品携带大肠埃希菌具有一定潜在的致病性。
本研究中分离的109株大肠埃希菌的耐药表型表明,分离株对复方新诺明、氨苄西林的耐药性最高,耐药率高达60%以上,对环丙沙星、庆大霉素、头孢唑啉耐药性较高,对头孢曲松、左旋氧氟沙星和妥布霉素等抗生素敏感,这些结果与赵燕等[6]和Soufi等[14]从活禽肉中分离出来的大肠埃希菌耐药表型较为一致。而邓伯雄等[15]通过对鸭致病性大肠埃希菌耐药研究后认为,较为敏感的环丙沙星和左旋氧氟沙星可以选择作为鸭场的首选药物,与本结果相悖,可能与养殖过程中使用药物情况有关。对于即食鸭制品大肠埃希菌的多重耐药分布情况,在本试验中耐药数最高为12,菌株比例为2.75%,另外,耐药数≥3的菌株比例为60.55%,显著高于赵燕等[6]从蛋鸭中分离的大肠埃希菌耐药数。
ESBLs是一类能水解青霉素类、头孢菌素类以及单环类抗生素的β-内酰胺酶,其活性可被β-内酰胺酶抑制剂抑制。能产生ESBLs的细菌,对β-内酰胺类、头孢类、青霉素类、氨基糖苷类、磺胺类等多种抗生素耐药。目前,产ESBLs的大肠埃希菌在美国、法国、加拿大、中国和日本等国家均有报道,尤其是CTX-M型ESBLs传播较快[16-18]。本试验即食鸭制品产ESBLs的大肠埃希菌阳性率为22.02%,高于赵燕等[6]和吴华等[19]对活鸭大肠埃希菌产ESBLs检出率,低于刘保光等[20]的活鸭大肠埃希菌产ESBLs检出率;检测出的β-内酰胺酶耐药基因主要是CTX-M、TEM、CTX-M-9和CTX-M-1。
大肠埃希菌主要通过获得性耐药产生耐药,借助于整合子、转座子和质粒等可移动元件进行耐药基因的传播[21]。整合子是含有能够整合、交换和表达基因盒的位点特异性重组系统的遗传元件,位于染色体、质粒或转座子等可移动元件上,可通过整合酶捕获或者整合耐药基因,传播耐药基因,介导细菌多重耐药[7,22-23]。大肠埃希菌中最常见的是Ⅰ型整合子[24],因此本研究着重分析了Ⅰ型整合子的携带状况,发现即食鸭制品大肠埃希菌Ⅰ型整合子的阳性检出率为18.35%。在不同源的大肠埃希菌分离株中,dfrA1-aadA1是最常监测到的基因盒[25],表明该基因盒在大肠埃希菌中的广泛选择和传播[26]。dfrA编码二氢叶酸还原酶,该酶能竞争性抑制磺胺类药物,使细菌对磺胺类药物耐药[7];aadA编码氨基糖苷腺苷酸转移酶,对氨基糖苷类药物关键位点具有化学修饰作用,阻断了药物与细菌16S rRNA结合,使细菌对氨基糖苷类药物产生耐药性[27]。本试验中7株携带Ⅰ型整合子阳性大肠埃希菌含有3种不同大小基因盒插入片段,其中2株大肠埃希菌Ⅰ型整合子基因盒插入的为dfrA1-aadA1,4株为dfrA12-aadA2,另1株为aadA22。结果提示,即食鸭制品中存在一定的大肠埃希菌污染,且部分污染的大肠埃希菌携带有毒力基因和具有耐药性。

