黄芪多糖通过抑制炎症反应降低SAH大鼠的脑损伤
秦 源,熊 宇,徐寅生,朱世杰,曹 峰
(1.贵州中医药大学,贵州 贵阳 550025;2.贵州理工学院医务室,贵州 贵阳 550003;3.西平中医院心脑病科,河南 驻马店 463900)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是临床常见的重症疾病之一,其病死率、致残率、复发率高,随着人口老龄化进程的加快,该病的发病率有上升和逐渐年轻化的趋势[1]。由于脑出血发病迅猛,病机复杂、病情变化多端,是临床治疗的难点,目前未有明显突破,因此也是目前国内外研究的热点之一。现代医学认为脑出血多数存在脑微循环和神经元内环境的变化、脑血流的动力学异常、免疫功能紊乱等,各种变化相互交织影响,最终可以引起细胞凋亡[2],继而引起脑功能损伤表现为偏瘫、意识和功能障碍,严重的即可引起人的死亡,其作用机制比较复杂,有待深入研究。
中药及其提取物因具有多靶点作用,所以常被临床医生用来治疗在诸多病因不明或病情复杂多变的疾病中,而黄芪多糖具有调节免疫力、抗炎、抑制肿瘤和保护脑神经等作用[3],但具体的作用机制不明。课题组前期证明黄芪多糖能影响转录因子κB和下游凋亡蛋白如Caspase-3、Bcl-2的表达发挥对SAH大鼠神经元凋亡的抑制作用,但黄芪多糖的具体作用机制是否通过调节NF-κB信号通路的表达来实现未被明确,且NF-κB能与环氧酶2(cyclooxygenase-2,COX2)基因启动子序列中位点结合进而调节COX2的表达,参与脑损伤相关疾病的病理过程[4-5]。故课题组拟通过大脑中动脉刺破法建立脑出血模型,进一步明确黄芪多糖调节NF-κB/COX2通路作用具体机制。
1 材 料
1.1 动物及分组
雄性SD大鼠 ,体重280~300 g,由重庆腾鑫比尔实验动物销售公司提供。合格证号SCXK(渝)2018-0005。将动物随机分为4组,即假手术组(A)、SAH模型组(B)、黄芪多糖组(C)和NF-κB抑制剂吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamateacid,PDTC)组即阻断剂组(D),黄芪多糖腹腔注射黄芪多糖40 mg/kg,阻断剂组腹腔给予8%PDTC,按0.25 mL/100 g,后再给予黄芪多糖40 mg/kg[6]。
1.2 主要试剂
黄芪多糖(APS)购于西安文竹生物科技公司,批号:HK-20171421,分子式
为C10H7ClN2O2S,分子量254.69,纯度90%,用时稀释为40mg/kg使用。
1.3 方法
(1)本实验采用颈内动脉刺破的方法制作模型,具体步骤参照 Bederson法[7],应用水合氯醛,浓度10%,计量1 ml/kg,经腹腔注射,大鼠仰卧固定,逐层钝性分离后在颈外动脉剪“V”型切口,一次性将4号尼龙线从切口导入到大脑中动脉与大脑前动脉分叉处至出现落空感后(深度20~22 mm),停约10 s,抽出并结扎颈外动脉,缝合消毒,术后黄芪多糖组和阻断剂组给予阻断剂8%PDTC腹腔注射黄芪多糖,剩余两组大鼠腹腔分别给予同剂量的生理盐水。假手术组在线栓遇到阻力后立即拔出[3]。
(2)空间探索实验(spatial probe test):该实验属于水迷宫(Morris water maze)实验,其目的是测定观察对象的空间记忆能力,与大鼠海马的功能有关。本实验观察的是急性损伤,所以仅选择了利用空间探索的行为实验反应各组大鼠海马功能的变化情况。在最后一次定位航行实验结束后进行相应处理第二天撤去平台,把大鼠放入原先平台象限的对侧水中,记录120s大鼠首次通过平台的时间、穿越平台的次数和游泳总路程作为检测指标。
(3)大鼠脑组织海马的病理形态学观察:治疗24h取各组大鼠,10%水合氯醛麻醉,用动物灌注针将0.9%生理盐水约300ml冲洗至流出的液体为清澈,用4%多聚甲醛约300 mL滴注10 min左右,然后快速断头取脑,放入4%多聚甲醛中后固定(上述液体剂量和灌注时间为每只大鼠所用)。常规石蜡包埋切片(厚度10 μm),采用HE染色,光镜观察各组大鼠脑组织海马区神经元的病理形态学变化。
(4)Western blotting:取四组大鼠海马放入蛋白提取试管中,超声粉碎,用BCA法测定蛋白浓度。电泳上样每孔的蛋白量为60 μg,10%SDS-PAGE分离蛋白质,电转移至PVDF膜(100 V,100 min),5%BSA室温封闭1 h,兔抗大鼠Caspase-3多克隆抗体(1∶500,abcam公司,货号:ab52237),等比例的兔抗大鼠Bcl-2多克隆抗体、NF-κB多克隆抗体和TNF-α等多克隆抗体和小鼠抗大鼠β-actin多克隆抗体(1∶4000,北京普利莱基因技术有限公司)过夜。复温1 h后分别加相应二抗,HRP标记兔抗小鼠、兔抗山羊和山羊抗兔抗体(1:200,北京普利莱基因技术有限公司),4℃孵育二天。洗涤后,在PVDF膜上滴加ECL发光液(北京普利莱基因技术有限公司),暗室曝光后将蛋白印迹条带扫描,经Image J图像软件分析读取灰度值并比较。
1.4 统计学方法
采用Sigma Plot 10.0统计学软件进行实验数据的统计分析,数据以均值±标准差(±s)表示。应用单因素方差分析(ANOVA)对空间探索数据和免疫蛋白印迹检测的蛋白条带灰度值进行组间比较,P<0.05表示差异有统计学意义。
2 结 果
2.1 黄芪多糖对SAH大鼠空间探索能力的影响
空间探索实验中,靶象限穿越平台的次数、总路程和首次穿越平台的时间数据分析均有统计学意义。与模型组相比,黄芪多糖组和阻断剂组的大鼠首次穿越平台所需时间和总路程均减少,差异有统计学意义(P<0.05),而黄芪多糖组与阻断剂组相比,阻断剂组首次穿越平台所需时间和路程要相对更少,阻断剂组所需时间平均为50.39 s;总路程中与假手术组相比,其他三组游泳路程均高,与模型组相比,黄芪多糖组与阻断剂组穿越平台的路程相对减少,差异有统计学意义(P<0.05),其中阻断剂组的路程平均最少为736.34 cm。在120 s内,穿越象限平台次数最多的为假手术组,平均为2.5次,与假手术组相比,其他三组穿越象限平台次数均下降,差异有统计学意义(P<0.05),而与模型组相比,黄芪多糖组与阻断剂组穿越象限平台次数有所上升,差异有统计学意义(P<0.05),其中阻断剂组与黄芪多糖组相比,上升明显,差异有统计学意义(P<0.05)。因大脑动脉刺破造模技术对出血量无法准确控制的原因造成每组大鼠数值波动较大。以上结果说明黄芪多糖组和NF-κB通路阻断剂能改善蛛网膜下腔出血大鼠的空间记忆能力,且阻断剂组大鼠的空间记忆能力改善更为明显。见表1。
表1 黄芪多糖对各组大鼠第1次通过平台的时间、总路程和次数的影响比较(±s,n=6)

表1 黄芪多糖对各组大鼠第1次通过平台的时间、总路程和次数的影响比较(±s,n=6)
注:与假手术组比较,*P<0.05;与模型组比较#P<0.05,与黄芪多糖组比较,*P<0.05
组别 剂量/(mg/kg) 时间/s 总路程/ cm 穿越平台次数假手术组 / 21.82±3.45 428.4±67.65 2.5±1.05模型组 / 69.28±3.71** 1188.94±72.32** 0.67±0.42**黄芪多糖组 40 56.02±4.70*# 932.30±38.80*# 1.16±0.75*#阻断剂组 40 50.39±4.83*#* 736.34±36.13*#* 1.33±1.03*#*
2.2 大鼠脑组织海马的病理形态学观察
假手术组大鼠海马HE染色观察CA1区锥体细胞体积完整,排列规则,胞核呈圆形或椭圆形,核仁明显,染色质质地均匀,细胞数量多,相比较模型组大鼠海马CA1区锥体细胞破碎不完整,坏死明显,结构松散,部分细胞肿胀明显,排列杂乱不规整,细胞数量明显减少;黄芪多糖组和阻断剂组大鼠正常细胞胞核呈圆形或椭圆形,核仁清晰,染色质丰富,排列较密,存在相对少量细胞核固缩而发生变性的神经元。见图1。
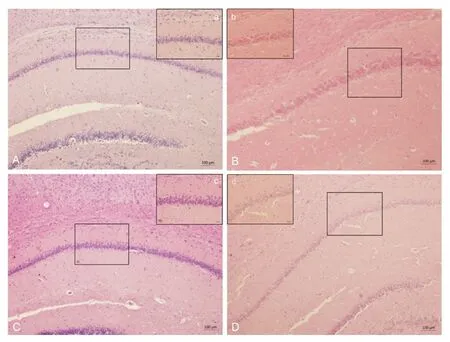
图1 黄芪多糖对各组大鼠海马CA1区神经元形态结构的影响
2.3 黄芪多糖对SAH大鼠NF-κB、COX2、TNF-α蛋白表达的影响(如图2)
与假手术组相比,黄芪多糖组及模型组大鼠海马NF-κB、COX2、TNF-α蛋白表达均显著增加,阻断剂组COX2、TNF-α蛋白表达也增强,差异有统计学意义(P<0.05),与模型组相比,黄芪多糖组和阻断剂组大鼠的COX2、TNF-α蛋白表达均显著性降低,差异有统计学意义(P<0.05);黄芪多糖组NF-κB蛋白表达也明显降低,而黄芪多糖组与阻断剂组比较,阻断剂组COX2、TNF-α蛋白表达相对下降显著,差异有统计学意义(P<0.05)。

图2 与假手术组比较,*P<0.01;与模型组比较#P<0.01,与黄芪多糖组比较,*P<0.01,A:假手术组;
2.4 黄芪多糖对SAH大鼠Bcl 2、Caspase3、IL-1β蛋白表达的影响(如图3)
与假手术组相比,黄芪多糖组、模型组及阻断剂组大鼠海马Bcl 2、Caspase3、IL-1β蛋白表达均显著增加,差异有统计学意义(P<0.05),与模型组相比,黄芪多糖组和阻断剂组大鼠的Bcl 2蛋白表达升高,而Caspase3、IL-1β蛋白表达均显著性降低(P<0.01);而黄芪多糖组与阻断剂组比较,阻断剂组Caspase3、IL-1β蛋白表达相对下降显著,Bcl 2蛋白表达升高显著,差异有统计学意义(P<0.05)。
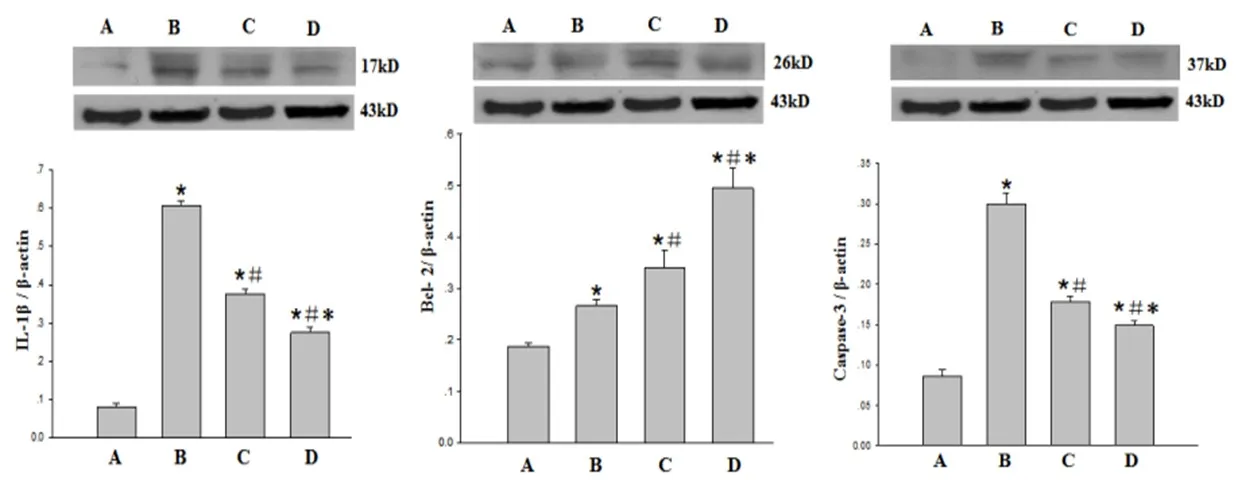
图3 与假手术组比较,*P<0.01;与模型组比较#P<0.01,与黄芪多糖组比较,*P<0.01,A:假手术组;
3 讨 论
蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)具有致死率高、致残率高及逐渐的年轻化等特点。目前的研究认为,蛛网膜下腔出血后出现的脑损伤可能是SAH后患者死亡或致残的主要原因[9],其涉及的病理机制复杂包括神经元凋亡、炎症反应、脑水肿等[10-12]。前期我们的研究证明黄芪多糖能通过影响NF-κB蛋白和凋亡相关蛋白的表达而起到抑制神经凋亡的发生,但是具体作用机制不清楚。
NF-κB是1986年由Sen和Baltimore发现提出,因可与kappa链基因结合,故命名为κ基因结合核因子。它不是一种单体蛋白质 ,而是一群功能密切相关的蛋白二聚体,其中在细胞中最常见的作用形式为p65及p50组成的异源二聚体,未受刺激时在细胞质中以非活化形式存在,当有损伤发生后,NF-κB可以活化转入核内调节一系列基因的表达,对酶类介质和细胞因子如炎性相关因子IL-1、TNF-α、COX2等起到激活作用[13-14]。COX2主要位于细胞浆及细胞核内,因启动子序列中含有NF-κB特异结合序列,能与NF-κB结合后可以促进COX2基因的转录,因此属于NF-κB通路的重要蛋白因子参与到凋亡及炎症反应中,对于神经元具有重要意义,有的研究显示NF-κB在肿瘤具有抗凋亡的作用,也有的研究认为NF-κB的活化会抑制肿瘤细胞的凋亡,促进肿瘤的扩散,通过抑制p65亚基而抑制NF-κB的活性,故而可以抑制肿瘤的增殖[15-16],且NF-κB/COX2通路在蛛网膜下腔出血的具体作用机制还未详细阐明。课题组研究显示与模型组相比,SAH大鼠腹腔注射黄芪多糖后能抑制NF-κB(p65)的激活,下调炎症因子IL-1β、TNF-α和促凋亡因子Caspase-3的表达,提高抗凋亡因子Bcl-2的表达,且应用NF-κB阻断剂后,作为NF-κB通路的重要蛋白因子COX2因子的表达显著下降,差异有统计学意义(P<0.05),相应的炎症反应的相关因子IL-1β、TNF-α及凋亡因子Caspase-3也均下降明显,说明黄芪多糖能通过NF-κB/COX2通路抑制SAH引起的大鼠脑部炎症因子的释放和神经元的凋亡,佐证了上述能通过抑制NF-κB通路中重要蛋白如p65及COX2蛋白的表达进而起到抑制SAH引起神经元凋亡的作用。
海马结构位于颞叶内侧面的基底部,是边缘系统的重要组成部分,具有多方面的生理功能,目前的研究已证明海马与学习记忆特别是空间认知功能有关,而Morris水迷宫是测试大鼠学习和记忆非常理想而有效的测试方法。SAH大鼠的空间探索实验结果表明:与模型组相比,黄芪多糖组与阻断剂组均能提高SAH大鼠的空间记忆能力,而形态学研究HE染色也表明给予黄芪多糖和阻断剂的大鼠能提高海马正常神经元的数量,维持神经元形态结构的完整和稳定。总之,黄芪多糖能通过调节NF-κB/COX2通路中NF-κB(p65)、COX2、IL-1β、TNF-α炎症相关因子表达而影响凋亡相关因子Caspase-3、Bcl-2的表达,进而可以降低蛛网膜下腔出血对大鼠神经元的损伤,提高其空间记忆能力。

