家蝇3种丝氨酸蛋白酶抑制剂(Serpin)基因在感染白色念珠菌后的表达
胡 亚,罗 嫚,魏川川,修江帆,吴建伟*
(1. 毕节市第一人民医院,贵州毕节 551700; 2. 贵州医科大学基础医学院,贵阳 550004; 3. 毕节市中医院,贵州毕节 551700; 4. 贵州省疾病预防控制中心,贵阳 550004)
昆虫的免疫系统主要依赖于黑化作用(李殿香等,2013)、体液免疫及细胞免疫三者相互作用的免疫应答反应。当机体受病原体感染后,昆虫体液免疫启动脂肪体细胞合成抗菌肽(裴志花等,2014;Osama等,2014)并分泌到血淋巴中杀死入侵的病原体,不同的病原体通过激活Toll信号通路(Wangetal., 2013;Qianetal., 2014)和IMD信号通路(Lemaitre and Hoffmann, 2007)来控制各类抗菌肽分子的产生,但昆虫先天免疫系统的抗菌肽表达等免疫应答反应,如果过度产生将会对宿主自身造成极大的损伤。因此对激活免疫应答的上游信号进行精确调节至关重要,而许多昆虫的免疫应答都是由丝氨酸蛋白酶(Serine Protease, SP)级联介导(Steven and Peter,2011)。
丝氨酸蛋白酶抑制剂(Serpin)蛋白家族是一个成员众多、分布广泛的蛋白酶抑制剂家族(Singh and Jairajpuri,2014),Serpin主要是通过使用自杀底物原理特异性地与靶酶形成稳定的共价复合物,导致靶酶失活,终止过度免疫应答反应,对宿主本身起着免受损伤的作用。其广泛存在于动物、植物和微生物中(Hibbettsetal., 1999),迄今已发现1 500多种Serpins(Lawetal., 2006),根据其功能的相似性与序列拓扑结构至少可将其分为20个家族,大多数是糖蛋白,具有免疫调节活性(黄薇和吴坤陆,2010;杨伟克等,2014)。它们能折叠成保守的空间结构,且具有特异的类自杀性底物抑制机制(Irvingetal.,2000;Rubyetal.,2006;魏川川等,2016)。在动物体中,Serpin是维持体内环境稳定的重要因素,一旦基因平衡失调即会导致多种疾病,任何影响其活性的因素也会造成严重的病理性疾病(满初日嘎等,2009; 张兵等,2014; 李冰等,2016)。Serpin可作为调节因子参与生理反应,可调节血液中的多种蛋白酶,调节酚氧化酶原活化反应,还参与调节机体多种非特异性免疫应答(Krowarschetal.,2003;张云,2006;韦双双等,2012;Gattoetal.,2013)。鉴于Serpin重要的免疫调节和生理功能,其功能研究一直倍受关注。
家蝇Muscadomestica是重要的媒介昆虫,并且分布广泛,隶属于昆虫纲双翅目Diptera蝇科Muscidae家蝇属Musca,具有强大的先天免疫系统及生长代谢调节功能(修江帆等,2014;彭传林等,2015;王宇等,2015;胡亚等,2016),已日益成为研究者们关注的焦点,为深入研究家蝇的先天性免疫防御机制,本研究通过白色念珠菌Canidiaalbicans刺激家蝇3龄幼虫,对家蝇中具有潜在免疫调节功能的3种Serpin基因的时空表达模式进行研究,旨在为今后研究Serpin基因的生物学功能提供依据。
1 材料与方法
1.1 材料
1.2.1动物材料与菌种
家蝇由贵州医科大学-基础医学院-病原生物学教研室保种,传代繁殖,饲养温度控制在25~28℃,保持相对湿度在70%~80%,光照周期为12 L ∶12 D;白色念珠菌由贵州医科大学-基础医学院-病原生物学教研室保存。
1.2.2主要试剂与仪器
PrimeScriptTMOne Step RT-PCR Kit试剂盒、DEPC水、SYBR Premix Ex TaqTM II (Perfect Real Time)试剂盒、总RNA提取试剂TRIzol Reagent均购自Takara公司;氯仿和异丙醇购自西陇科学;去RNA酶EP管(美国Axygen公司);PCR扩增仪(德国Eppendorf公司)、微量加样器(德国Eppendorf公司)、冷冻高速离心机(德国Eppendorf公司)、Milli-Q超纯水仪(法国Millipore Pharmacia公司)、核酸定量分析仪(GeneQuant公司)、ABI PRISM 7300 Fast real time PCR System(美国)、显微超微量注射仪(美国)。所用引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1引物设计
根据NCBI公布的GAPDH(内参基因)基因序列和家蝇Sp2、Sp13、Sp16基因预测序列,运用Primer 5.0软件设计引物。交由生工生物工程(上海)股份有限公司合成,其序列如下(表1):
表1 实验引物
1.2.2标本制备
以浓度为1×1010CFU/mL的白色念珠菌作为感染源,利用显微超微量注射仪注射家蝇3龄幼虫,每头注射210 nL,设置为感染组,同时以等体积的PBS缓冲液设为对照组,收集感染后不同时间点(3、6、12、24、36、48 h)和3、12、24、48 h各时间点的家蝇幼虫组织(马氏管、体壁、血淋巴、气管、唾液腺、脂肪体、中肠)标本,存于-80℃备用。
1.2.3提取总RNA及合成cDNA
对所有感染标本,利用TRIzol提取总RNA,电泳检测,运用GeneQuant公司核酸定量分析仪测定A260/280(1.8≤A260/280≤2.1)及浓度,以1 μg总RNA为模板合成cDNA第一链,置于-80℃待用。
1.2.4荧光定量PCR
取上述家蝇3龄幼虫感染后不同时间点(3、6、12、24、36、48 h)及3、12、24、48 h各时间点的家蝇幼虫组织(马氏管、体壁、血淋巴、气管、唾液腺、脂肪体、中肠)(感染组及对照组)cDNA(1 ∶10稀释)为模板,设GAPDH为内参基因,按照Takara SYBR Premix Ex TaqTM II (Perfect Real Time)试剂盒使用说明,利用ABI PRISM 7300(USA)进行qPCR,每个样品重复3×3次。反应体系为:2×SYBR premix EX Taq II 10 μL、上游引物(10 μmol/L)0.8 μL、下游引物(10 μmol/L)0.8 μL、ROX Reference Dye (50×) 0.4 μL、cDNA 1.0 μL, RNase Free dH20补足至20 μL。反应条件为:95℃预变性30 s;95℃ 5 s;60℃ 34 s;40个循环。反应结束确认qPCR的扩增曲线和溶解曲线。
1.2.5数据处理及分析
利用GAPDH作为内参照,其拷贝数作为校正基数,感染组样本中Serpin的△Ct值等于各样本中Serpin的Ct值减去同样本中GAPDH的Ct值;以对照组中△Ct值作为校正,得出△△Ct(感染组△Ct-对照组△Ct)值(胡亚等,2016),按目的基因表达量=2-△△Ct计算各感染样本中Sp2、Sp13、Sp16mRNA的相对表达量。采用Graphpad prism 6进行统计分析并绘图,通过方差分析进行组间比较,P<0.05时具有统计学意义。
2 结果与分析
2.1 qPCR产物分析
根据qPCR原理,Ct值(Cycle threshold)表示每个反应管内的荧光信号达到设定阈值时所经历的循环数,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,以Ct值来反映目的基因cDNA起始含量,起始拷贝数越多,Ct值越小(胡亚等,2016)。结果显示,所有样本中Sp2、Sp13、Sp16cDNA显示指数增长,其扩增曲线为典型的S型曲线并达到平台期,CT值线性范围为15~30(图1,图2,图3)。在熔解曲线中均可见单一的峰,产物特异性好(图4,图5,图6)。
2.2 感染组与对照组Sp2、Sp13、Sp16 mRNA水平
2.2.1 感染后不同时间点
白色念珠菌感染后,家蝇Sp2、Sp13、Sp16基因在不同时间点均显现出差异表达。家蝇Sp2基因在感染后3 h时表达量最高,其次为48 h和6 h,均具有显著性差异(P<0.05),而在感染后12 h、24 h、36 h表达量差异无统计学意义(P>0.05);家蝇Sp13基因在感染后6 h时表达量最高,而3 h和24 h时其表达量较对照组低,均具有显著性差异(P<0.01),在感染后12 h、36 h、48 h表达量差异无统计学意义(P>0.05);家蝇Sp16基因在感染后48 h时表达量最高,其次为24 h和6 h,而在感染后36 h时其表达量较对照组低,均具有显著性差异(P<0.01),在感染后3 h和12 h表达量差异无统计学意义(P>0.05)(图7)。
图1 Sp2扩增曲线 Fig. 1 Amplification of Sp2 注:A,感染后不同时间点;B,感染后3 h不同组织;C,感染后12 h不同组织;D,感染后24 h不同组织;E,感染后48 h不同组织。图2-图6同。Note:A,Time post infection;B,Different tissues at 3 h postinfection;C,Different tissues at 12 h postinfection;D,Different tissues at 24 h postinfection;E,Different tissues at 48 h postinfection.Same to Fig.2-6.
图2 Sp13扩增曲线 Fig.2 Amplification of Sp13
图3 Sp16扩增曲线 Fig.3 Amplification of Sp16
图4 Sp2溶解曲线Fig.4 Melting curve of Sp2
图5 Sp13溶解曲线Fig.5 Melting curve of Sp13
图6 Sp16溶解曲线Fig.6 Melting curve of Sp16
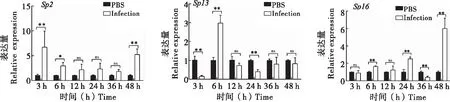
图7 家蝇3种Serpin基因在感染后不同时间点的表达Fig.7 Expression of three Serpin gene in different time after Canidia albicans infection of Musca domestica 注:*,P<0.05;**,P<0.01;***,P<0.0001
2.2.2感染后不同组织
通过白色念珠菌刺激家蝇幼虫,选择感染后3 h、12 h、24 h、48 h时间点,分析Sp2、Sp13、Sp16基因在各组织(马氏管、体壁、血淋巴、气管、唾液腺、脂肪体、中肠)中的表达情况。家蝇Sp2基因在感染后3 h时,在血淋巴中的表达量最高,其次是在脂肪体中,均具有显著性差异(P<0.05),在马氏管、气管和肠道中其表达量比对照组低,差异具有显著性(P<0.05);12 h时,在血淋巴中的表达量比对照组高,而在马氏管和唾液腺中其表达量比对照组低,均具有显著性差异(P<0.01);24 h时,在脂肪体中的表达量比对照组低,差异具有显著性(P<0.01);48 h时,在血淋巴中呈高表达,在唾液腺中的表达比对照组低,均具有显著性差异(P<0.01)(图8)。家蝇Sp13基因在感染后3 h时,在唾液腺和脂肪体中的表达量比对照组高,而在马氏管、体壁、血淋巴和气管中的表达量比对照组低,均具有显著性差异(P<0.05);12 h时,在血淋巴中呈高表达,而在体壁和脂肪体中表达量比对照组低,均具显著性差异(P<0.05);24 h时,在血淋巴、气管和唾液腺中其表达量比对照组高,在脂肪体中其表达量比对照组低,差异均具有显著性(P<0.05);48 h时,在马氏管、血淋巴、气管和脂肪体中其表达量比对照组高,而在体壁和唾液腺中其表达量比对照组低,均具有显著性差异(P<0.05)(图9)。家蝇Sp16基因在感染后3 h时,在马氏管和气管中的表达量比对照组低,差异具有显著性(P<0.01);12 h时,在马氏管和脂肪体中其表达量比对照组低,差异具有显著性(P<0.01);24 h时,其表达量在马氏管中比对照组高,在脂肪体中比对照组低,均具有显著性差异(P<0.01);48 h时,在血淋巴中呈高表达,而在马氏管中其表达量比对照组低,均具有显著性差异(P<0.01)(图10)。

图8 Sp2在感染后不同组织中的表达Fig.8 Expression of Sp2 in different tissues after Canidia albicans infection注:*,P<0.05;**,P<0.01;***,P<0.0001
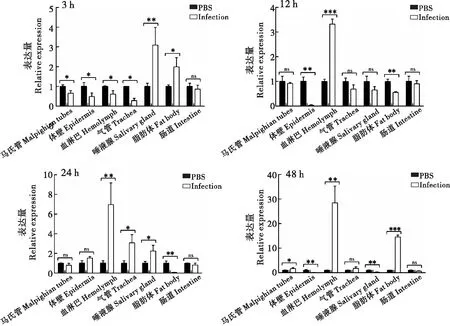
图9 Sp13在感染后不同组织中的表达Fig.9 Expression of Sp13 in different tissues after Canidia albicans infection注:*,P<0.05;**,P<0.01;***,P<0.0001
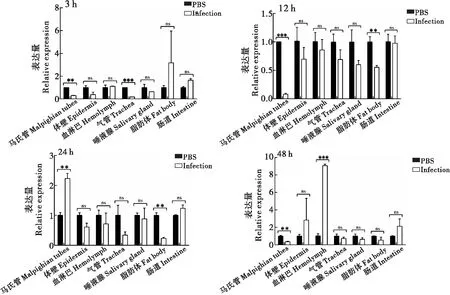
图10 Sp16在感染后不同组织中的表达Fig.10 Expression of Sp16 in different tissues after Canidia albicans infection注:*,P<0.05;**,P<0.01;***,P<0.0001
3 结论与讨论
家蝇孳生环境复杂,是重要的媒介昆虫,其很少感染病原微生物,这和它自身强大的先天性免疫系统有关(胡亚等,2016)。而大量研究表明Serpin作为重要的免疫调控因子在先天性免疫调控作用中发挥重要作用,如烟草天蛾ManducasextaSerpin6参与了酚氧化酶原的激活(Zou and Jiang,2005),家蚕Bombyxmori的Serpin家族中有5个基因已被证实具有免疫调节功能(郑青亮等,2010;李游山等,2012),且课题组前期构建系统发育树分析家蝇Serpin基因结果表明(魏川川等,2016),果蝇DrosophilaSerpin43Ac基因在机体发生过度免疫时,可通过抑制作用阻断Toll信号通路的信号传递,抑制抗菌肽Drosomycin(Jean-Marc and Reichhart,2005)的表达,进而终止过度的免疫反应,在机体抵抗外界微生物感染中起到非常重要的作用(Greenetal.,2000),它与家蝇Sp13和Sp16基因的亲缘关系最接近。家蝇Sp2与黄粉虫TenebriomolitorSerpinN48和SerpinN40亲缘关系最近,而SerpinN48和SerpinN40已被证实为黄粉虫天然免疫的重要负调控因子(Jiangetal.,2009;魏川川等,2016),这为今后研究家蝇Sp2、Sp13和Sp16基因的生物学功能奠定了基础。
本研究利用白色念珠菌刺激家蝇幼虫,采用qPCR技术成功检测了家蝇3种SerpinmRNA在家蝇幼虫感染后不同时间点及不同组织中的表达情况。结果表明,家蝇3种Serpin基因在不同时间点呈现差异表达,家蝇Sp2基因在感染后3 h时表达量最高,其次是48 h和6 h,Sp13基因在感染后6 h表达量最高,而在3 h和24 h时其表达量比对照组低,Sp16基因在感染后48 h时表达量最高,其次是24 h和6 h,而36 h时其表达量比对照组低。以上结果分析表明,家蝇3龄幼虫时期是家蝇整个生长发育过程中生长最快和最活跃的阶段,当受到病原微生物刺激时,家蝇幼虫却能正常生长,推测Serpin基因可能参与了家蝇的个体生长发育,在抵抗外来微生物免疫防御过程中发挥着重要的作用,但3种Serpin基因在各时间点的表达各有差异,推测各Serpin基因之间能够协同调控对外来微生物的免疫反应。
家蝇Sp2、Sp13和Sp16基因在家蝇幼虫不同组织(马氏管、体壁、血淋巴、气管、唾液腺、脂肪体、中肠)中均有不同程度的表达,感染后Sp2和Sp13mRNA的表达量在血淋巴和脂肪体中普遍比对照组高,Sp13mRNA在3 h和24 h时在唾液腺中的表达量比对照组高,Sp16mRNA在24 h时,其表达量在脂肪体中比对照组低;48 h时,在血淋巴中呈高表达。有研究表明脂肪体和血淋巴是昆虫的主要免疫器官,参与昆虫的先天性免疫应答反应,唾液腺是昆虫主要的消化器官,能够分泌多种消化酶,在昆虫的免疫防御系统中扮演着重要的角色。病原微生物感染家蝇时,通过信号通路调节抗菌肽的产生,当抗菌肽过度表达时,各免疫器官在相应时间高表达Serpin,通过其特异的类自杀性底物抑制机制终止过度免疫应答反应,使宿主内环境保持平衡,使得家蝇在感染病原体后能够安然地生长繁殖,说明Sp2、Sp13、Sp16可能在家蝇的免疫防御系统中起着重要作用,同时3种Serpin基因在各组织中不同感染时间呈现出差异性表达,说明3种Serpin基因之间在家蝇免疫防御过程中有协同调节的可能。
通过qPCR结果分析,推测家蝇Sp2、Sp13、Sp16基因在免疫防御过程中担当着重要角色,3种Serpin基因在各时间点不同组织中的表达各有差异,推测各Serpin基因之间具有协同调节作用,这为今后研究Serpin的生物学与免疫学功能打下坚实的基础。

