阿帕替尼与依托泊苷治疗复发难治小细胞肺癌的效果比较
石玲 王志 左宏波

[摘要]目的 比較阿帕替尼与依托泊苷治疗复发难治小细胞肺癌(SCLC)的临床效果。方法 选取2016年1月~2018年1月九江市第一人民医院收治肿瘤科的98例复发难治SCLC患者作为研究对象,采用计算机将其随机分为阿帕替尼组(52例)与依托泊苷组(46例)。阿帕替尼组患者口服阿帕替尼500 mg/d,依托泊苷组患者口服依托泊苷胶囊175 mg/d,共10 d,每21天为1个疗程。按照RECISIT 1.1标准评价疗效,包括客观缓解率(ORR)及疾病控制率(DCR);检测血清神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(ProGRP)水平变化;对患者进行随访,计算中位无进展生存期及中位总生存期;对治疗期间的不良反应发生情况进行评价。结果 阿帕替尼组患者的ORR、DCR均高于依托泊苷组,差异有统计学意义(P<0.05)。治疗前,两组患者的NSE、ProGRP水平比较,差异无统计学意义(P>0.05);两组患者治疗后的NSE、ProGRP水平均低于治疗前,且阿帕替尼组低于依托泊苷组,差异有统计学意义(P<0.05)。阿帕替尼组患者的中位总生存期、中位无进展生存期(5.2、4.2个月)长于依托泊苷组(3.9、3.0个月),差异有统计学意义(P<0.05)。阿帕替尼组患者的乏力、骨髓抑制、胃肠道反应、肝肾功能损害及心脏毒性发生率均低于依托泊苷组,高血压、蛋白尿发生率均高于依托泊苷组,差异有统计学意义(P<0.05);两组患者的手足综合征发生率比较,差异无统计学意义(P>0.05)。结论 阿帕替尼治疗复发难治SCLC的效果优于依托泊苷,可作为复发难治SCLC靶向治疗的新选择。
[关键词]小细胞肺癌;阿帕替尼;依托泊苷
[中图分类号] R737.9 [文献标识码] A [文章编号] 1674-4721(2020)9(a)-0009-05
[Abstract] Objective To compare the clinical effect of Apatinib and Etoposide in the treatment of relapsed and refractory small cell lung cancer (SCLC). Methods Ninety-eight patients with relapsed and refractory SCLC addmited to the Department of Oncology in Jiujiang No.1 People′s Hospital from January 2016 to January 2018 were selected as research objects and randomly divided into Apatinib group (52 cases) and Etoposide group (46 cases) by computer. Patients in the Apatinib group received Apatinib 500 mg/d orally, and patients in the Etoposide group received Etoposide Capsules 175 mg/d orally for 10 days, with a course of treatment every 21 days. According to RECISIT 1.1 standard, the efficacy was evaluated, including objective response rate (ORR) and disease control rate (DCR). Serum levels of neuron-specific enolase (NSE) and gastrin-releasing peptide precursor (ProGRP) were detected. The patients were followed up to calculate median progression-free survival and median overall survival. The occurrence of adverse reactions during treatment was assessed. Results The ORR and DCR of the Apatinib group were higher than those of the Etoposide group, and the differences were statistically significant (P<0.05). Before treatment, there were no statistically significant differences in the levels of NSE and ProGRP between the two groups (P>0.05). The NSE and ProGRP levels of the two groups after treatment were lower than those before treatment, and those in the Apatinib group were lower than those in the Etoposide group, the differences were statistically significant (P<0.05). The median overall survival and median progression-free survival (5.2, 4.2 months) of patients in the Apatinib group were longer than those in the Etoposide group (3.9, 3.0 months), and the differences were statistically significant (P<0.05). The incidences rates of fatigue, bone marrow suppression, gastrointestinal reactions, liver and kidney damage, and cardiotoxicity in the Apatinib group were lower than those in the Etoposide group, and the incidence rates of hypertension and proteinuria were higher than those in the Etoposide group, with statistical significances (P<0.05). There was no statistically significant difference in the incidence of hand-foot syndrome between the two groups (P>0.05). Conclusion Apatinib is more effective in the treatment of relapsed and refractory SCLC, and can be used as a new choice for targeted therapy for relapsed and refractory SCLC.
[Key words] Small cell lung cancer; Apatinib; Etoposide
小细胞肺癌(small cell lung cancer,SCLC)是一种生长快、易转移的神经内分泌肿瘤,倍增时间短,病情进展迅速。初期对放化疗敏感,疗效尚可,但二、三线治疗后易出现耐药及复发[1]。患者后续治疗常常面临无药可医的状态。研究发现80%的SCLC表达血管内皮生长因子(vascular endothelial growth factor,VEGF),并对SCLC进行了大量抗血管生成药的研究,如CALGB30306试验为一项贝伐珠单抗对广泛期SCLC的Ⅱ期临床试验,显示了良好疗效,患者无进展生存期明显延长[2-5]。虽然抗血管生成药物较多,如索拉菲尼、舒尼替尼、西地尼布、凡的他尼等,但尚没有研究发现在SCLC中发挥疗效[6-8]。阿帕替尼为VEGF-2抑制剂,高度选择性竞争细胞内VEGFR-2的ATP结合位点,进一步阻断下游的信号转导,从而抑制肿瘤新血管生成。研究显示,SCLC患者血液中的VEGF水平显著高于正常人[9]。阿帕替尼可通过控制SCLC血管生成从而控制肿瘤。基于此理论基础,本研究探讨阿帕替尼治疗复发难治SCLC的临床效果,现报道如下。
1资料与方法
1.1一般资料
选取2016年1月~2018年1月九江市第一人民医院肿瘤科收治的98例经支气管镜检查、CT引导下经皮穿刺活检等方法病理确诊的复发难治SCLC患者作为研究对象。纳入标准:①病理诊断明确,影像学有可测量病灶者;②均为二、三线药物化疗失败且病情进展的SCLC患者;③预计生存期>3个月者;④体能状态(ECOG)评分<2分者;⑤年龄18~75岁者;⑥自愿参加本研究并签署知情同意书。排除标准:①严重心、脑、肝、肾功能不全及不可控制高血壓者;②合并其他恶性肿瘤患者;③有精神病不能配合者;④消化道溃疡、穿孔、肠梗阻患者;⑤有药物过敏患者。采用计算机将其随机分为阿帕替尼组(52例)及依托泊苷组(46例)。两组患者的性别、年龄、ECOG评分、接受放疗情况、转移部位、接受化疗情况等一般资料比较,差异无统计学意义(P>0.05)(表1),具有可比性。本研究经九江市第一人民医院医学伦理委员会审批通过。
1.2治疗方法
阿帕替尼组患者给予甲磺酸阿帕替尼(艾坦,江苏恒瑞医药股份有限公司,生产批号:19050908,规格:250 mg/片)500 mg/d,餐后30 min口服,口服至疾病进展或出现不可耐受的不良反应,每4周进行1次疗效评价,如患者耐受且未见肿瘤进展则继续口服。
依托泊苷组患者给予依托泊苷胶囊(威克,江苏恒瑞医药股份有限公司,生产批号:070502,规格:50 mg/粒)175 mg/d,共10 d,口服,每21天为1个疗程。
两组患者均口服药物直到疾病进展或无法耐受不良反应而停药,若出现Ⅲ级以上不良反应,酌情暂停用药或调整用药剂量。
1.3观察指标及评价标准
1.3.1血清神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(ProGRP)检测 首次化疗前1周内,第2次化疗结束后21 d,采静脉血5 ml(不含抗凝剂),离心10 min后放入-20℃冰箱保存。采用美国Molecular De-vice公司SPECTA MAX190型酶标仪、双抗体夹心酶联免疫吸附测定(ELISA)法,严格按照说明书检测波长在450 nm处各孔的光密度(D)值。
1.3.2疗效及不良反应 阿帕替尼组每4周,依托泊苷组每2个疗程复查胸部增强CT,参照实体瘤RECISIT 1.1疗效评价标准[8],分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。CR:全部病灶消失,所有目标结节缩小至正常大小(短轴≤10 mm);PR:所有可测量目标病灶的直径总和缩小≥30%;SD:靶病灶减小的程度没达到PR,增加的程度没有达到PD水平,介于两者之间。以直径之和的最小值为参考;PD:以所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%。客观有效率(ORR)=(CR+PR)例数/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)例数/总例数×100%。按照美国国立卫生研究院(NIH)和美国NIC-生物医学信息学和信息技术中心(CBITT)通用不良事件术语标准(CT-CAE)4.0版标准对治疗期间不良反应进行评价,分为1~5级。
1.3.3随访 所有患者治疗后均有专人随访,采用来院复查、电话、微信或QQ交流等方式进行随访,随访至患者疾病进展或病死,末次随访时间为2019年1月31日。
1.4统计学方法
采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,不符合正态分布的转换为正态分布后行统计学分析或采用中位数表示行非参数检验;计数资料采用率表示,组间比较采用χ2检验,等级资料采用秩和检验;采用Kaplan-Meier法对无进展生存期及总生存期进行计算,比较采用log-rank检验,以P<0.05为差异有统计学意义。
2结果
2.1两组患者近期疗效的比较
阿帕替尼组患者的ORR、DCR均高于依托泊苷组,差异有统计学意义(P<0.05)(表2)。
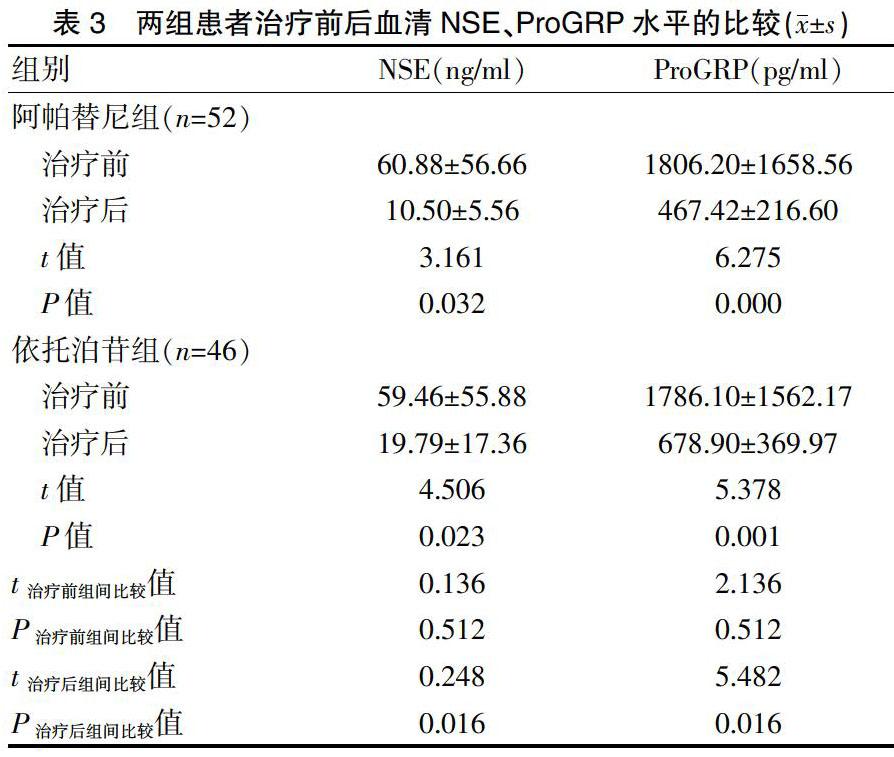
2.2两组患者治疗前后血清NSE、ProGRP水平的比较
两组患者治疗前的NSE、ProGRP水平比较,差异无统计学意义(P>0.05);两组患者治疗后的NSE、ProGRP水平均低于治疗前,且阿帕替尼组低于依托泊苷组,差异有统计学意义(P<0.05)(表3)。
2.3两组患者生存期的比较
阿帕替尼组和依托泊苷组分别有2例及3例因失访、死亡等原因终止试验。阿帕替尼组随访时间为3.6~12.6个月,依托泊苷组随访时间为3.8~8.9个月。阿帕替尼组患者的中位总生存期为5.2个月,长于依托泊苷组的3.9个月,差异有统计学意义(HR=0.75, 95%CI:0.58~0.92,P=0.000)。阿帕替尼组患者的中位无进展生存期为4.2个月,长于依托泊苷组的3.0个月,差异有统计学意义(HR=0.70,95%CI:0.60~0.94,P=0.000)。
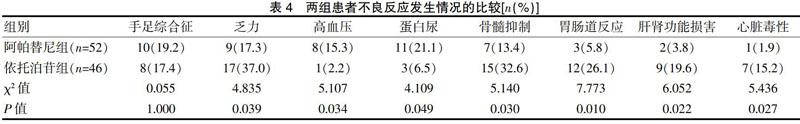
2.4两组患者不良反应发生情况的比较
两组患者的手足综合征发生率比较,差异无统计学意义(P>0.05);阿帕替尼组患者的乏力、骨髓抑制、胃肠道反应、肝肾功能损害及心脏毒性发生率均低于依托泊苷組,高血压、蛋白尿发生率均高于依托泊苷组,差异有统计学意义(P<0.05)(表4)。阿帕替尼组中有1例患者出现Ⅳ度骨髓抑制,反复便血,通过将阿帕替尼使用剂量500 mg/d减量至250 mg/d,患者不良反应明显减轻,其余骨髓抑制均为Ⅰ~Ⅲ度骨髓抑制,患者耐受性良好。
3讨论
SCLC是侵袭性最强的肺亚型,占肺癌的15%,多年来SCLC治疗进展甚微。最重要的一个原因是经过一、二线治疗进展后出现耐药性,导致后续缺乏有效的药物治疗。因此急需新研究探索新的药物进行有效的后续治疗。
研究显示,VEGF在SCLC中广泛表达,通过RNAi抑制肿瘤内VEGF的表达,抑制肿瘤细胞的侵袭和增殖,以对SCLC在机体的内生长及转移进行控制[9]。VEGF及其家族成员作为重要的细胞因子在调节肿瘤形成中起到重要作用,可促进肿瘤新血管生成及促进肿瘤的生长、转移[10]。Lucchi等[11]研究显示,SCLC患者肿瘤转移与血管生成有关,VEGF高表达的患者,其生存期较低表达者明显缩短,提示抗血管生成药对SCLC疗效显著。随着SCLC基因遗传突变及生理病理机制的进一步深入研究,已研制出血管生成抑制剂、蛋白酶体抑制剂、凋亡通路抑制剂等,其中血管生成抑制剂显示出了良好的抗肿瘤效果。
阿帕替尼是新一代VEGF受体2(VEGFR-2)酪氨酸激酶抑制剂,高度选择性抑制VEGFR-2激酶活性,并对VEGF结合后信号传导进行阻断,从而较好地抑制肿瘤血管的生成。在第16届世界肺癌大会(WCLC)中,Hong等[12]对阿帕替尼在二线或三线化疗失败后广泛期SCLC单中心回顾性研究进行报道,该研究发现阿帕替尼中位无进展生存期为2.8个月,疗效评价中PR为18.2%,SD为63.6%,DCR为81.8%,表明阿帕替尼治疗多线治疗后耐药SCLC取得了较好的DCR及疗效。毒副反应主要为口腔黏膜炎(9.1%)、乏力(9.1%)、高血压(27.3%),患者耐受良好。曲范杰等[13]对阿帕替尼联合多西他赛治疗广泛期SCLC进行了1例病案报道,该患者治疗1个月后疗效达到了PR,肿瘤病灶明显缩小,症状得到迅速改善。李芳芳等[14]报道了阿帕替尼对多重治疗后SCLC患者的挽救治疗,该患者获得了PR,无进展生存期为5个月,不良反应为手足综合征、声音嘶哑、2级高血压。Yan等[15]的一项单中心回顾性研究是关于广泛期SCLC的维持治疗,研究共纳入23例患者,经阿帕替尼维持治疗后,患者中位总生存期为12.5个月,中位无进展生存期为4.1个月,患者的生存期得到明显延长,并且该研究发现脑转移与总生存期存在明显相关性,其最常见的不良反应为手足综合征、2级高血压、乏力、恶心、蛋白尿。以上研究均表明阿帕替尼在SCLC中能得到确切的临床疗效。
本研究结果显示,阿帕替尼组的ORR高于依托泊苷组,DCR亦高于依托泊苷组,差异有统计学意义(P<0.05)。提示阿帕替尼在治疗效果方面较依托泊苷组有优势,疗效显著。NSE作为一种神经酶分泌的标志物,对SCLC的诊断有较高的特异度及灵敏度[16];而ProGRP为SCLC疗效监测及预后评估理想的循环标志物[17-18]。经治疗后,NSE、ProGRP的变化可间接反映治疗效果及疾病进程情况[19]。本研究中,阿帕替尼组患者治疗后的血清NSE、ProGRP下降趋势较依托泊苷组明显(P<0.05),阿帕替尼可有效降低复发难治SCLC患者肿瘤负荷,这与影像学检查结果吻合,提示阿帕替尼治疗复发难治SCLC的效果良好。本研究还对98例患者进行定期随访,随访2年多,阿帕替尼组及依托泊苷组分别有2例及3例失访,失访原因多为失联及非肿瘤原因死亡,结果显示,阿帕替尼组患者的中位总生存期为5.2个月,长于依托泊苷组的3.9个月,中位无进展生存期为4.2个月,长于依托泊苷组的3.0个月,差异有统计学意义(P<0.05)。Yan等[15]研究的中位总生存期较本研究延长,考虑与本研究纳入患者脑转移偏多有关。复发难治SCLC总体生存期偏短,而本研究中阿帕替尼组中位总生存期及中位无进展生存期分别延长了1.3、1.2个月,生存期得到延长。药物安全性方面,阿帕替尼的主要不良反应为手足综合征、乏力、口腔黏膜炎、高血压、蛋白尿、骨髓抑制,其中有1例老年患者因血小板低下出现反复便血,通过对阿帕替尼使用剂量500 mg/d减量至250 mg/d,不良反应逐步减轻,患者尚耐受。但剂量降低后患者的治疗效果则相应的降低,该患者减量后2个月出现疾病进展,但总体药物耐受性良好。与依托泊苷组比较,阿帕替尼组患者乏力、口腔黏膜炎、骨髓抑制、胃肠道反应、肝肾功能损害及心脏毒性发生率均偏低,但患者高血压、蛋白尿发生率较依托泊苷组高(P<0.05)。故使用阿帕替尼过程中定期检测血压及尿液,控制不良反应。
综上所述,阿帕替尼在治疗复发难治SCLC中显示出确切的效果,能延长患者的无进展生存期及总生存期,毒副反应耐受,整体效应及不良反应均较依托泊苷组优。本研究为复发难治SCLC患者的后续治疗提供新的药物临床数据,为SCLC提供靶向治疗的可能。鉴于研究纳入患者例数有限,阿帕替尼在复发转移SCLC治疗的研究还需在更大人群、更深入的临床研究中进一步论证。
[参考文献]
[1]Liu B,Qin JW,Zhou JM.Advances in the treatment of relapsed small cell lung cancer[J].Zhongguo Fei Ai Za Zhi,2017,20(3):192-198.
[2]Horn L,Dahlberg SE,Sandler AB,et al.Phase Ⅱ study of cisplatin plusetoposide and bevacizumab for previously untreated,extensive-stage small-cell lung cancer:Eastern Cooperative Oncology Group Study E3501[J].J Clin Oncol,2009, 27(35):6006-6011.
[3]Ready NE,Dudek AZ,Pang HH,et al.Cisplatin,irinotecan,and bevacizumab for untreated extensive-stage small-cell lung cancer:CALGB 30306,a phase Ⅱ study[J].J Clin Oncol,2011,29(33):4436-4441.
[4]Tiseo M,Boni L,Ambrosio F,et al.Italian,Multicenter,Phase III,Randomized Study of Cisplatin Plus Etoposide With or Without Bevacizumab as First-Line Treatment in Extensive-Disease Small-Cell Lung Cancer:The GOIRC-AIFA FARM6PMFJM Trial[J].J Clin Oncol,2017,35(12):1281-1287.
[5]Spigel DR,Townley PM,Waterhouse DM,et al.Randomized phase Ⅱ study of bevacizumab in combination with chemotherapy in previously untreated extensive-stage small-cell lung cancer:Results from the SALUTE Trial[J].J Clin Oncol,2011, 29(16):2215-2222.
[6]Noda K,Nishiwaki Y,Kawahara M,et al.Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J].N Engl J Med,2002,346(2):85-91.
[7]Hom L,Dahlberg SE,Sandler AB,et al.Phase Ⅱ study of cisplatin plus etoposide and bevacizumab for prevjously untreafed,extensive-stage small-cell lung cancer:Eastem Coop-emtive Oncology Gmup Study E3501[J].J Clin Oncol,2009, 27(35):6006-6011.
[8]Spigel DR,Greco FA,Zubkus JD,et al.Phase II trial of irinotecan,carboplatin,and bevacizumab in the treatment of patients with extensive-stage small-cell lung cancer[J].J Thorac Oncol,2009,4(12):1555-1560.
[9]呂立丽.血管内皮生长因子在小细胞肺癌血清中的表达及意义[J].研究与临床,2013,25(1):51-52.
[10]Peifer M,Fernandez-Cuesta L,Sos ML,et al.Integrative genome analyses identify key somatic driver mutations of small-cell lung cancer[J].Nat Gene,2012,44(10):1104-1110.
[11]Lucchi M,Mussi A,Fontanini G,et al.Small cell lung carcinoma(SCLC):the angiogenic phenomenon[J].Eur J Cardiothorac Surg,2002,21(6):1105-1110.
[12]Hong W,Li H,Jin X,et al.P1.07-053 Apatinib for Chemotherapy-Refractory Extensive Stage SCLC: Results from a Single-Center Retrospective Study[J].J Torac Oncol,2017,12(1):S729.
[13]曲范杰,于韦韦,张捷.阿帕替尼联合化疗治疗晚期小细胞肺癌1例报告及文献复习[J].中国肿瘤生物治疗杂志,2017,24(8):923-925.
[14]李芳芳,陶海涛.阿帕替尼用于小细胞肺癌多线治疗后的挽救治疗[J].中国肺癌杂志,2018,21(7):565-570.
[15]Yan X,Wang Q,Wang H,et al.Apatinib as maintenance therapy in extensive-stage small-cell lung cancer:results from a single-center retrospective study[J].J Cancer Res Clin Oncol,2019,145(1):235-240.
[16]Molina R,Augé JM,Bosch X,et al.Usefulness of serum tumor markers,including progastrin-releasing peptide,in patients with lung cancer:correlation with histology[J].Tumour Biol,2009,30(3):121-129.
[17]Huang Z,Xu D,Zhang F,et al.Pro-gastrin-releasing peptide and neuron-specific enolase:useful predictors of response to chemotherapy and survival in patients with small cell lung cancer[J].Clin Transl Oncol,2016,18(10):1019-1025.
[18]Wojcik E,Kulpa JK.Pro-gastrin-releasing peptide(Pro-GRP)as a biomarker in small-cell lung cancer diagnosis monitoring and evaluation of treatment response[J].Lung Cancer(Auckl),2017,8:231-240.
[19]Petrovic M,Bukumiric Z,Zdravkovic V,et al.The prognostic significance of the circulating neuroendocrine markers chromogranin A,progastrin-releasing peptide and neuron-specific enolase in patients with small-cell lung cancer[J].J Med Oncol,2014,31(2):823.
(收稿日期:2019-05-15)

