重视结核性胸膜炎的综合诊断
陈效友
结核性胸膜炎(tuberculous pleurisy)是由于结核分枝杆菌直接感染和(或)胸膜对结核分枝杆菌菌体成分产生迟发型变态反应而发生的炎症。部分患者表现为咳嗽、发热、胸痛甚至呼吸困难,以及少至中等量的胸腔积液;少数患者可出现大量胸腔积液[1]。2018年,我国对结核病进行了重新分类,将结核病分为结核分枝杆菌潜伏性感染者、活动性结核病和非活动性结核病等3个类型,并把结核性胸膜炎重新划归为第5型肺结核[2-3]。结核性胸膜炎在我国患病数量较高、确诊困难,而延迟治疗将导致胸膜肥厚、引发呼吸功能障碍,少数患者可发展成为结核性脓胸,故需要对其进行关注。
结核性胸膜炎分为干性胸膜炎和渗出性胸膜炎。干性胸膜炎为胸膜的早期炎性反应,通常无明显的影像学异常表现;渗出性胸膜炎主要表现为胸腔积液,且胸腔积液可表现为少量或中等及大量的游离积液,或存在于胸腔任何部位的局限性积液,吸收缓慢者常发生胸膜增厚粘连,也可演变为胸膜结核瘤及脓胸等[3]。结核性胸膜炎的诊断分为疑似患者、临床诊断患者和确诊患者。干性胸膜炎因极难获得病原学证据,最后只能进行临床综合诊断。渗出性胸膜炎的确诊,需要从胸腔积液中获得结核分枝杆菌菌体或核酸成分检测阳性的确证证据,或胸膜活检组织标本符合典型的结核病理学改变方能明确。无论是胸腔积液还是胸膜活检组织标本,获得典型确诊证据的机会相对较小,换句话说也就是目前常用的单一检测技术的敏感度均较低,需要结合临床症状和实验室检查的多项结果进行综合诊断。
常用的实验室检测项目与技术
一、胸腔积液的常规和生化检查
1.外观和气味:结核性胸腔积液多呈草黄色稍浑浊,可有凝块,少数患者呈血性;结核性胸腔积液少有明显的气味(并发其他细菌感染者除外)。
2.细胞数量及分类[4]:结核性胸腔积液的细胞总数多为(1~6)×106/L,早期可以中性粒细胞为主(病程1周以内),随后以单个核淋巴细胞为主,约占总数的50%以上,多数患者达75%以上。如果嗜酸粒细胞超过10%或间皮细胞超过5%,往往提示结核性胸膜炎的可能性较小。
3.pH值[4]:结核性胸膜炎的胸腔积液系渗出液,pH值通常>1.018以上,多数达7.3以上。
4.蛋白质含量:渗出液的蛋白质含量较高,通常>30 g/L,胸腔积液总蛋白与血清总蛋白质的比值>0.5。Tong等[5]报道, 对25例结核性胸膜炎患者的胸腔积液进行蛋白质检测,结果显示平均为(67.98±16.86) g/L。
二、腺苷脱氨酶(adenosine deaminase, ADA)检测
ADA是一种与机体细胞免疫活性有关的嘌呤代谢酶,广泛存在于人体各组织中,以盲肠、肠系膜、脾、胸腺中含量最高;ADA主要的同工酶有ADA1和ADA2,ADA2在结核性胸腔积液中升高,而ADA1在其他细菌性脓胸中升高。
Sivakumar等[6]报道,在132例胸腔积液患者中,临床确诊结核性胸膜炎27例和其他病因性胸膜炎105例;胸腔积液中ADA的临界值(cut-off值)取30 IU/L时,诊断结核性胸膜炎的敏感度和特异度分别为96.3%和83.8%,阳性预测值和阴性预测值分别为60.5%和98.9%,曲线下面积达0.934。尽管如此,当胸腔积液ADA≥30 IU/L时,仍然需要结合患者的临床症状、影像学检查资料及胸腔积液的生化指标进行综合判断。
Wang等[7]通过回顾性分析72例结核性胸腔积液(tuberculous pleural effusion,TPE)和47例肺炎旁胸腔积液(parapneumonic pleural effusion,PPE)患者中的乳酸脱氢酶(LDH)和ADA检测结果发现,作为独立指标,LDH在PPE患者[4037 (103~48 730) U/L]中的检测结果明显高于TPE患者[364.5 (55~1154) U/L];然而ADA在两组患者中检测结果差异并无统计学意义。通过进一步分析发现,LDH/ADA在TPE和PPE患者中分别为10.88 (3.65~21.81)和66.91 (9.04~411.40),差异有统计学意义;ROC曲线分析,当LDH/ADA的cut-off值小于16.2时,诊断TPE的敏感度和特异度分别为93.62%和93.06%,阳性似然比和阴性似然比分别为13.48和0.068,曲线下面积达0.9663,可以很好地区分TPE和PPE。
Aggarwal等[8]荟萃分析了174个研究、包含10 696例结核性胸膜炎和16 313例其他病因性胸腔积液患者,胸腔积液ADA检测用于诊断结核性胸膜炎的汇总敏感度和汇总特异度分别为0.92(0.90~0.93)和0.90 (0.88~0.91),尽管结果显示其具有很好的敏感度和特异度,但所有纳入研究的数据均存在偏倚。
三、γ-干扰素释放试验(interferon gamma release assay, IGRA)
Aggarwal等[9]于2015年荟萃分析了IGRA用于胸腔积液检测诊断结核性胸膜炎,其结果明确提示商业化的IGRA的检测无论用于全血还是胸腔积液对结核性胸腔积液的诊断价值有限。
Luo等[10]在武汉和广州2家医疗机构分别对218例和210例胸腔积液患者应用结核感染T淋巴细胞斑点试验(T-SPOT.TB)技术检测胸腔积液进行诊断性评价,2个中心的胸腔积液T-SPOT.TB检测的敏感度和特异度均在90%左右;但由于2个中心的患者例数较少,仍需要扩大多中心研究参与单位以便纳入更多患者进一步做出评价。
四、Xpert MTB/RIF检测技术
Akhter等[11]在134例结核性胸膜炎和64例其他病因性胸膜炎患者中,Xpert MTB/RIF检测的敏感度和特异度分别为52.2%和100.0%,尽管其敏感度不高,但其展现了良好的特异度。Han等[12]连续入组300例胸腔积液患者,应用包括Xpert MTB/RIF在内的多种检测技术进行诊断评价,最后可用于分析的265例患者中,包括223例结核性胸膜炎和42例其他病因性胸膜炎患者,其诊断的敏感度和特异度分别为27.4%和100.0%,阳性预测值为100.0%。基于较低的敏感度,作者不推荐在胸腔积液中首先采用该技术。
结核性胸膜炎常规实验室检测技术存在的不足
结核性胸腔积液标本进行抗酸染色涂片的阳性率不足10%,改良罗氏培养的阳性率不足30%[13]。目前常用的实验室技术中,ADA的敏感度和特异度均能达到80%以上,但ADA的在结核性胸膜炎的诊断价值需要结合当地的结核病流行病学状态进行综合判断[14],其自身不具有确诊的价值。
Xpert MTB/RIF对继发性肺结核患者的痰和(或)病理组织标本检测结核分枝杆菌DNA的敏感度和特异度均较为理想。Zong 等[15]的一项荟萃分析共纳入97个研究的26 037份痰标本,无论是高收入国家还是中低收入国家,其诊断结核病及对利福平耐药的敏感度均超过90.0%以上,其特异度达到98.0%。因此,Xpert MTB/RIF在诊断继发性肺结核时可作为首选的检测项目;但Xpert MTB/RIF对结核性胸腔积液标本检测的敏感度几乎很难达到50%。
鉴于目前常用的实验室诊断技术敏感度和(或)特异度低,不能满足临床需要,亟待开发新的诊断技术。
近年来几项新的诊断技术
随着分子生物学技术的发展,近年来有学者将两项新检测技术用于TPE的诊断,使诊断的敏感度有了较大提高。
一、 Xpert MTB/RIF Ultra检测技术
Xpert MTB/RIF Ultra检测技术在Xpert MTB/RIF的基础上进行了技术改良,使得检测靶标的极限提高;检测极限由原来Xpert MTB/RIF的112.6 菌落形成单位(CFU)/ml 提高到15.6 CFU/ml[16],这无疑增加了对标本检测的敏感度。笔者的团队采用Xpert MTB/RIF Ultra与Xpert MTB/RIF头对头地检测108份TPE标本,其敏感度分别为61.11%和34.26%,两者的特异度差异无统计学意义,分别为96.75% 和98.37%[17]。我们后续在北京4家医疗机构按照纳入标准收集的胸腔积液患者应用Xpert MTB/RIF Ultra和Xpert MTB/RIF头对头进行比较[18],在117例病原学及(或)病理学确诊的结核性胸膜炎患者中,Xpert MTB/RIF Ultra和Xpert MTB/RIF检测胸腔积液的敏感度和特异度分别为63.25%和43.19%;在91例临床诊断为结核性胸膜炎患者中,两者检测的阳性率分别为19.78%和0.00%;两者在84例其他病因性胸膜积液患者中特异度评价均为98.81%。由此推测,未来Xpert MTB/RIF Ultra 可考虑优先用于结核性胸膜炎患者的早期诊断。
二、游离DNA(cell-free DNA,cfDNA)检测技术
cfDNA是一种由细胞分泌到体液中的短片段DNA。cfDNA是由Mandel和Metais于1948年在系统性红斑狼疮患者的免疫复合物中被首次发现,其是一些存在血液或其他体液中的核酸片段[19]。这些核酸的片段来源于人体或微生物体死亡的细胞释放到体液中的,cfDNA与基因组DNA相比非常之小,血浆中的cfDNA长度70%小于300 bp,一般平均在170 bp左右[20-22]。1997年Lo等[23]发现孕妇血液中能够检测到胎儿的cfDNA,并将cfDNA的检测技术推向了临床诊断。在感染性疾病中,应用cfDNA技术已有数十年,如在鼻咽癌患者中检测EB病毒及真菌感染[24],其他的病原微生物包括疟原虫、锥虫、利什曼原虫、血吸虫、钩端螺旋体等[25]。
笔者团队在国际上首次应用cfDNA检测技术对32例结核性胸膜炎确诊患者、28例临床诊断患者、18例其他病因性胸膜炎患者进行检测,结果cfDNA检测技术诊断结核性胸膜炎的敏感度为75%,特异度为100%[26]。近期,笔者团队在前期研究的基础上,进一步扩大样本量,连续入组胸腔积液患者286例,其中包括确诊结核性胸膜炎患者122例、临床诊断患者99例和其他病因性胸膜炎患者65例;结果cfDNA检测技术诊断结核性胸膜炎的敏感度、特异度、阳性预测值和阴性预测值分别为79.5%、100.0%、100.0%和72.2%;进一步分析发现,在40~<60岁患者中敏感度达到80%以上[27]。从笔者团队的两项研究结果来看,cfDNA检测技术有望未来作为结核性胸膜炎诊断的首选检测技术。
综合诊断的价值
尽管近年来新出现的分子诊断技术较以往的检测技术在敏感度上有所提高,同时分子诊断阳性结果具有一定程度的确诊价值;但就目前来看,这些新技术的评价仅在单中心或为数不多的几家医疗机构开展,样本量仍然有限,需要扩大样本量做进一步评价。
正是由于结核性胸膜炎诊断较为困难,临床上需要开展多种技术联合或多种诊断要素联合来进行综合诊断。
一、渗出液或漏出液的区分
针对胸腔积液的患者,在无明显禁忌证的情况下首先需要进行胸腔穿刺,明确是渗出液还是漏出液。应用Light标准可以快速进行判断,Light标准[28]:(1)胸腔积液总蛋白与血清总蛋白的比值>0.5;(2)胸腔积液LDH与血清LDH的比值>0.6;(3)胸腔积液LDH绝对值>200 U/L或大于血清LDH正常值上限的2/3。符合上述3条中的任何一条标准,认定为渗出液;但在部分胸腔积液为漏出液的患者中,因利尿剂等药品的应用,大约25%的漏出液按照Light标准被判定为渗出液[29]。
二、胸腔积液的常规检查
主要包括胸腔积液的常规和生化检查、抗酸染色涂片、分枝杆菌的快速培养和菌种鉴定、腺苷脱氨酶检测等。在结核病高负担国家和地区,渗出性的胸腔积液,单个核淋巴细胞达75%以上,ADA≥40 U/L,可作为结核性胸膜炎的临床诊断患者[30]。
三、胸腔积液的分子生物学检查
在分子生物学检测技术中,由于Xpert MTB/RIF在国内多家结核病医疗机构可开展此项技术,因此可以选择该技术进行检测;有条件开展Xpert MTB/RIF Ultra或cfDNA检测技术的医疗机构,推荐首选该两项技术。
四、内科胸腔镜检查
内科胸腔镜检查是一项有创检查,其本身不具有明确的诊断价值,因该技术的应用可以通过肉眼观察胸膜腔内病变的位置、形态和范围,有助于术者能直接对胸膜上的病变进行活检,活检组织标本可以进行相关的实验室检查和(或)组织病理学检查。结合既往的研究资料和笔者团队开展的多中心研究评价,借助内科胸腔镜检查在不明原因胸腔积液患者中的确诊率可达到85%~90%。随着机器人的应用,可以辅助内科胸腔镜进行精准操作,其检测风险进一步降低。目前,该项技术是不明原因胸腔积液获得明确诊断的主要手段之一[31]。
五、结核性胸膜炎的诊断思路
任何一种疾病的诊断均需要从患者的病史、临床症状和体征入手,再结合胸部影像学特征及相关的实验室检查结果进行综合分析和判断。
结核性胸膜炎多急性起病,伴有发热(75%)、胸痛(50%~75%)和干咳(70%~75%)[14]。1/3患者的上述症状可持续1周,2/3患者则可持续1个月左右[14]。其他症状包括盗汗(50%),寒颤、呼吸困难(50%)和体质量减轻(25%~85%)[32]。
胸部影像学检查包括胸部X线摄影、胸部CT扫描和胸腔B超检查,其中以胸部CT和B超检查发现胸腔积液的敏感度最高,可发现极少量积液。胸腔积液以单侧多见,双侧少见。Kim等[33]报道,在106例结核性胸膜炎患者中,胸部CT扫描发现91例(86%)患者存在肺实质结核病灶;同时发现,106例结核性胸膜炎患者中,有33例(31%)患者的痰或支气管灌洗液标本行抗酸染色或结核分枝杆菌培养为阳性,可见结核性胸膜炎患者痰抗酸染色涂片或结核分枝杆菌培养对于其明确诊断具有一定的价值。
基于结核性胸膜炎的临床诊断思路,建议采用以下的诊断流程,见图1。
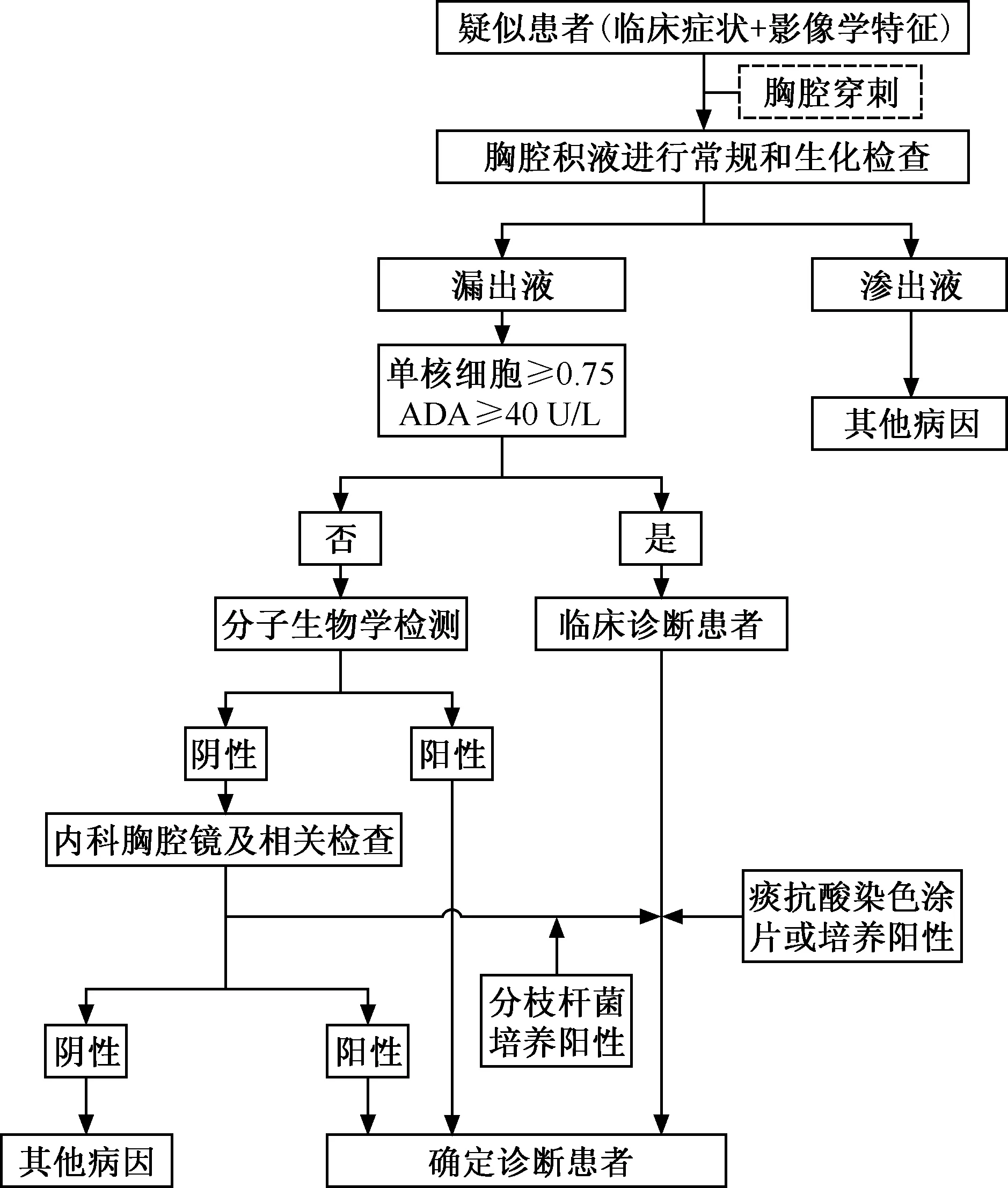
图1 结核性胸膜炎临床诊断流程
小 结
结核性胸膜炎确切的发病机制尚不完全清楚,主要有两种学说[34]:(1)结核分枝杆菌侵犯胸膜;(2)迟发性超敏反应。直接采用胸腔积液标本进行抗酸染色涂片或培养的阳性率低,且培养耗时长,难以满足临床需要;随着分子生物学技术的发展,病原学检测的阳性率有了较大的提高,但这些新技术尚无普遍推广;因此,其诊断仍然需要借助于临床相关的证据进行综合诊断,此点值得引起足够重视。其中,正确掌握结核性胸膜炎临床诊断流程显得格外重要。

