牦牛lncFAM200B的克隆鉴定、表达及生物信息学分析
赵丽玲,王 会,柴志欣,王吉坤,王嘉博,武志娟, 信金伟,钟金城,姬秋梅
(1.西南民族大学 青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,四川 成都 610041; 2.省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,西藏 拉萨 850000)
牦牛(Bosgrunniens)作为高原地区的特有牛种,耐粗饲,抗病能力强,能够在氧气稀缺,气候寒冷,牧草生长季短的高寒草地环境下生存繁衍[1]。牦牛独特的生存环境使其肉质具有高蛋白和低脂肪的特点,但由于脂肪含量低,导致牦牛肉口感较差。因此,研究影响牦牛肌肉和脂肪发育的分子机制对改善牦牛肉品质具有重要意义。
lncRNA是一类长度大于200 nt且多数不具有蛋白编码能力的RNAs[2],其物种间保守性差,可在不同层面发挥调控作用,主要作用机制:参与基因印记[3],通过染色质重塑[4]和组蛋白修饰[5]等方式从表观遗传水平调控基因表达;在转录水平,通过顺式作用影响邻近基因表达[6],作为诱饵分子招募转录因子[7]或RNA聚合酶Ⅱ[8]从而促进或抑制基因表达;lncRNA可在转录后水平通过招募蛋白质或与miRNA结合,从而影响靶基因的可变剪接、mRNA稳定性以及翻译过程[9-11]。Billerey等[12]采用RNA-seq技术在利木赞牛肌肉中鉴定出584个lncRNAs,预测这些lncRNAs在肌肉发育过程中起重要调控作用。Sun等[13]发现,lncMD与秦川牛骨骼肌分化相关,过表达lncMD促进肌细胞分化,抑制其表达则导致肌细胞分化相关标志基因MHC和MyoG表达量下降,进而影响肌肉发育。Li等[14]发现一个在胎牛和成年牛骨骼肌中差异表达的lncRNAMDNCR,MDNCR可通过吸附miR-133a促进牛成肌细胞分化并抑制细胞增殖。Chen等[6]研究发现,lncKBTBD10可通过影响其邻近基因KBTBD10表达,参与牛骨骼肌形成过程。Liang等[11]构建了一个影响牛乳脂肪合成的lncRNA-miRNA-mRNA表达网络,其中涉及41个lncRNA和11个miRNA。在牛脂肪细胞分化过程中,lncRNAADNCR作为ceRNA与miR-204结合,促进miR-204靶基因Sirt1表达,从而抑制脂肪细胞分化[15]。目前的研究主要关注牦牛繁殖性能[16]及乳腺发育[17]相关lncRNA,而对牦牛脂肪和肌肉发育相关lncRNA的报道较少。
研究发现,lncFAM200B在不同年龄秦川牛的肌肉和脂肪组织中差异表达,其第一内含子区域存在一个SNP位点,该多态位点与其体高、体斜长等生长性状显著相关[18]。然而,对于牦牛lncFAM200B序列特征的研究尚未见报道。本研究通过基因克隆和原核表达试验分析并鉴定了牦牛lncFAM200B的序列特征和蛋白编码能力;RT-qPCR检测lncFAM200B在牦牛不同组织中的表达水平,最后通过TargetScan 7.1和miRanda软件预测与lncFAM200B具有潜在相互作用miRNA的靶基因。为进一步解析该lncRNA在肌肉和脂肪发育过程中的功能及调控机制奠定基础。
1 材料和方法
1.1 样品采集
选取0.5,4.5岁健康的类乌齐母牦牛各3头,分别采集心脏、肝脏、脾脏、肺脏、臀肌和臀脂组织,用锡箔纸包裹并标记,迅速置于液氮中保存。
1.2 总RNA提取与cDNA合成
分别称取0.05~0.10 g牦牛心脏、肝脏、脾脏、肺脏、臀肌、臀脂组织于液氮中研磨,采用TRIzol法提取各组织总RNA,用NanoDrop 2000分光光度计和1%琼脂糖凝胶电泳检测其浓度和纯度。按照TaKaRa反转录试剂盒(PrimeScriptTM RT Reagent Kit with gDNA Eraser(Perfect Real Time))说明书进行cDNA合成。简要步骤: ①去除基因组DNA,反应体系为5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,总RNA 800 ng,加RNase Free H2O至10 μL,42 ℃反应2 min; ②反转录反应,反应体系为第①步反应液10 μL,RNase Free H2O 4 μL,5×Prime Script Buffer 2(for Real time)4 μL,PrimeScript RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,总体系20 μL。反应程序:37 ℃ 15 min,85 ℃ 5 s。所得cDNA置于-20 ℃保存备用。
1.3 lncFAM200B克隆
采用Primer Premier 5.0软件,根据张思欢[18]研究所得lncFAM200B序列设计克隆引物,克隆引物在牦牛基因组中的位置如图1所示。以克隆所得全长序列为模板设计实时荧光定量PCR引物,内参基因选择GAPDH(NM_001034034.2)、UXT(NM_001037471.2)和RPS9(NM_001101152.2),引物序列如表1所示。所有引物由北京擎科生物科技有限公司(成都分公司)合成。
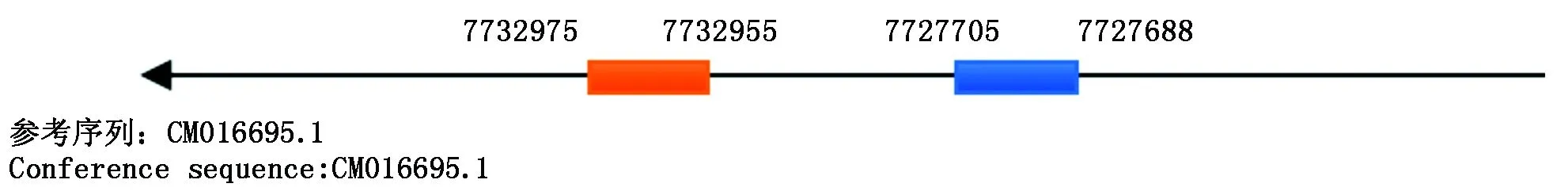
横线.牦牛基因组;橙色矩形.上游引物;蓝色矩形.下游引物。 The horizontal line represents the yak genome; The orange rectangle indicates forward primer; The blue rectangle indicates reverse primer.

表1 引物序列Tab.1 Sequence of primers
以牦牛臀肌cDNA为模板进行PCR扩增,扩增体系:2×Dream Taq Green PCR Master Mix 12.5 μL,cDNA模板1 μL,上下游引物各1 μL,加ddH2O至25 μL。反应程序:94 ℃ 4 min;94 ℃ 30 s,54.8 ℃ 30 s,72 ℃ 50 s,33个循环;72 ℃ 5 min。1%琼脂糖凝胶电泳检测目的片段,按照胶回收试剂盒说明书回收目的片段。将胶回收产物连接至pGEM-T载体,并转化DH5α感受态细胞,经菌液PCR鉴定的阳性质粒送北京擎科生物科技有限公司测序。
1.4 lncFAM200B ORF及编码能力预测
利用NCBI数据库Open Reading Frame Finder工具分析lncFAM200B全长序列,预测其开放阅读框。借助Coding Potential Calculator(CPC)网站(http://cpc.cbi.pku.edu.cn/)和Coding Potential Assessment Tool(CPAT)(http://lilab.research.bcm.edu/cpat/)在线预测工具预测其编码潜能,以蛋白编码基因GAPDH和已被验证的长链非编码RNAH19作为参照。
1.5 lncFAM200B原核表达
根据质粒提取试剂盒说明书提取质粒,使用Primer Premier 5.0分析lncFAM200B的酶切位点,选取pET-28a作为原核表达载体,将lncFAM200B全长序列亚克隆至pET-28a载体上。阳性对照选择青藏高原动物遗传资源保护与利用四川省、教育部重点实验室保存的CSN3-28a原核表达质粒。
含BamHⅠ和HindⅢ 2个酶切位点的lncFAM200B片段与pET-28a质粒同时双酶切,酶切体系:10×K Buffer 2 μL,BamHⅠ/HindⅢ各1 μL,pET-28a/lncFAM200B8 μL,加ddH2O至20 μL,37 ℃水浴3 h。酶切产物分别进行胶回收,采用T4DNA连接酶连接胶回收产物,连接产物转入BL21(DE3)感受态细胞,获得重组质粒lncFAM200B-28a表达菌种,提取质粒后进行双酶切和测序鉴定。
经双酶切和测序鉴定的阳性菌液,37 ℃摇床培养至OD值达到0.6~0.8时,以CSN3-28a为阳性对照,空载pET-28a为阴性对照,各加入终浓度为0.5,0.8,1.0 mmol/L IPTG溶液,诱导表达6 h。取1.5 mL诱导后的菌液沉淀,500 μL PBS缓冲液重悬沉淀,取12 μL菌液悬浮液与3 μL 5×SDS-PAGE Loading Buffer于沸水中煮沸10 min,菌体完全裂解后,取12 μL用于SDS-PAGE分析。凝胶经考马斯亮蓝R-250染色液染色,脱色液脱色,凝胶成像。
1.6 lncFAM200B组织表达谱
分别取0.5,4.5岁牦牛6个组织的cDNA,通过Real-time PCR反应检测lncFAM200B在牦牛各组织中的表达水平,反应体系:TB Premix Ex TaqTMⅡ5 μL,上下游引物各0.4 μL,cDNA模板1 μL,RNase-Free ddH2O 3.2 μL,总体系10 μL。反应条件:95 ℃预变性3 min;95 ℃变性5 s,55 ℃退火30 s,39个循环后制作溶解曲线,每个样品设置3个试验重复。
1.7 lncFAM200B靶基因预测
利用miRDB(http://mirdb.org/index.html)数据库筛选与lncFAM200B存在相互作用的miRNAs。结合生物学功能,选择在线预测软件TargetScan 7.1(http://www.targetscan.org/vert_71/)和miRanda(http://www.microrna.org/microrna/home.do)分别筛选与lncFAM200B存在相互作用miRNAs的靶基因,利用在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)取2个预测软件靶基因预测结果交集,通过DAVID在线软件(https://david.ncifcrf.gov/)对交集靶基因进行GO富集和KEGG信号通路分析;利用RBPDB(http://rbpdb.ccbr.utoronto.ca/)数据库预测可能与lncFAM200B结合的靶蛋白。
1.8 数据分析
选择GAPDH、UXT和RPS9几何平均值校正内参基因表达量[19],采用2-ΔΔCt法计算lncFAM200B在各组织中的相对表达量,用SPSS 18.0软件中的One-Way ANOVA方法进行显著性分析,并用LSD法进行检验。
2 结果与分析
2.1 lncFAM200B克隆
以牦牛臀肌cDNA为模板,PCR扩增后经电泳检测获得单一目的条带(图2)。测序结果表明,lncFAM200B全长大小为531 bp。
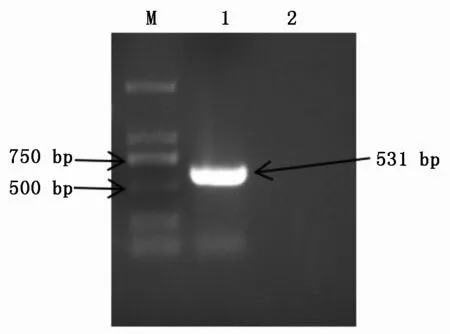
M.DNA Marker DL2000;1.lncFAM200B基因;2.阴性对照。 M.DNA Marker DL2000;1.lncFAM200B gene;2.Negative control.
2.2 lncFAM200B序列分析
采用DNAMAN软件进行牦牛、普通牛lncFAM200B序列相似性分析,发现牦牛lncFAM200B序列与普通牛序列的83~142 bp(约59 bp)存在差异(图3),共存在6个碱基差异位点。
利用NCBI-Open Reading Frame Finder预测lncFAM200B开放阅读框,得到35条预测结果,其中最长的开放阅读框包含174个碱基,编码57个氨基酸,小于一般编码基因的氨基酸数(100 aa),而该lncRNA长度大于200 nt,说明lncFAM200B可能是长链非编码RNA。利用在线编码能力预测工具CPC、CPAT对lncFAM200B、已知lncRNAH19和编码基因GAPDH的编码能力进行分析,如表2,3所示,lncFAM200B的注释结果均为非编码,进一步说明lncFAM200B可能为非编码RNA(表2,3)。

Bos grunniens lncFAM200B.牦牛lncFAM200B;Bos taurus lncFAM200B.普通牛lncFAM200B。

表2 CPC网站编码能力预测结果Tab.2 Coding capability prediction results of CPC

表3 CPAT网站编码能力预测结果Tab.3 Coding capability prediction results of CPAT
2.3 lncFAM200B原核表达分析
为进一步验证lncFAM200B是否具有编码能力,本研究构建了lncFAM200B原核表达载体,根据质粒提取试剂盒说明书提取重组质粒lncFAM200B-28a,使用BamHⅠ、HindⅢ酶进行双酶切鉴定。由图4可知,除5 369 bp载体片段外,lncFAM200B-28a还检测出一条531 bp大小的条带,通过测序确认成功构建lncFAM200B原核表达载体。
经不同浓度的IPTG诱导表达后,SDS-PAGE分析结果显示(图5),lncFAM200B-28a与阴性对照,即空载pET-28a表达情况一致,相同试验条件下,阳性对照CSN3-28a成功表达25.32 ku左右的蛋白(CSN3表达21.58 ku蛋白,载体可表达3.74 ku蛋白)。综合生物信息学分析结果及原核表达结果,确定lncFAM200B为长链非编码RNA。
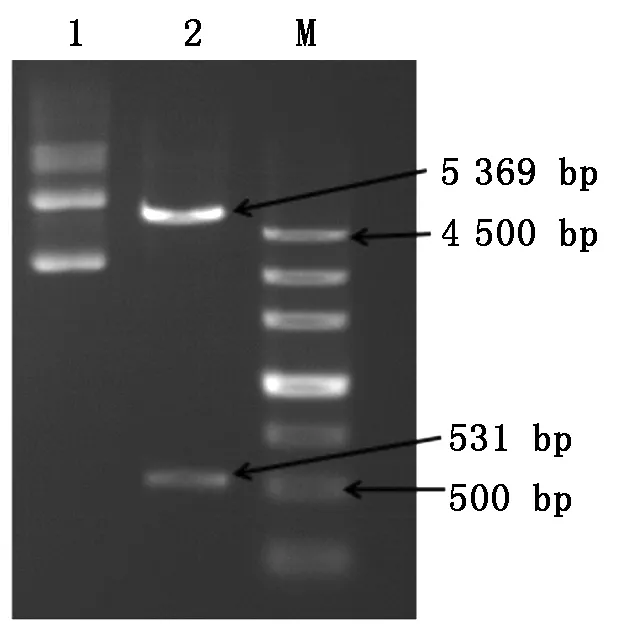
M.Marker Ⅲ;1.未酶切lncFAM200B-28a载体; 2.lncFAM200B-28a双酶切结果。 M.Marker Ⅲ;1.Undigested lncFAM200B-28a vector; 2.lncFAM200B-28a double digestion results.
2.4 lncFAM200B组织表达结果分析
采用RT-qPCR技术分别检测lncFAM200B在0.5,4.5岁牦牛心脏、肝脏、脾脏、肺脏、臀肌和臀脂中的相对表达量。RT-qPCR结果(图6)显示,lncFAM200B在0.5岁牦牛各组织中均存在表达,在肺脏中的表达水平显著高于其他组织(P<0.05),但在4.5岁牦牛中,肺脏、肝脏表达量与臀肌、臀脂表达量差异显著(P<0.05);lncFAM200B在4.5岁牦牛心脏、肝脏、脾脏3个组织中的表达量显著高于0.5岁,在肺脏中的表达量显著低于0.5岁,臀肌和臀脂中的表达量在2个年龄之间差异不显著(P>0.05)。
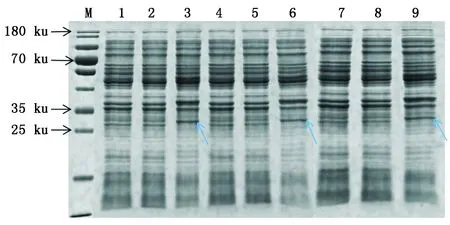
M.蛋白分子量标准;1-3.IPTG浓度0.5 mmol/L;4-6.IPTG浓度0.8 mmol/L;7-9.IPTG浓度1 mmol/L;1,4,7.空载体pET-28a;2,5,8.lncFAM200B-28a;3,6,9.CSN3-28a;蓝色箭头代表阳性对照CSN3-28a表达的25.32 ku蛋白位置。
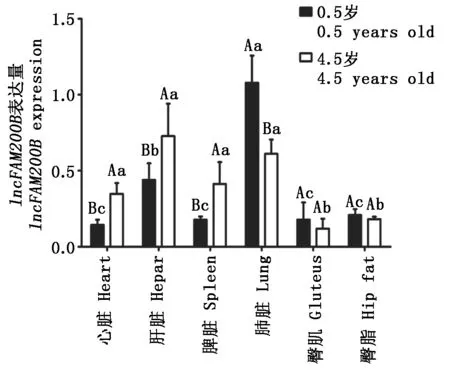
字母相同表示差异不显著(P>0.05);小写字母不同表示同年龄不同组织间差异显著(P<0.05);大写字母表示lncFAM200B表达量在2个年龄之间差异显著。
2.5 靶基因预测分析
利用miRDB数据库筛选出24个可能与lncFAM200B存在相互作用的miRNAs,查阅文献发现8个可能与肌肉及脂肪发育相关的miRNAs,分别是miR-411-5p[20]、miR-212-5p[21]、miR-138-5p[22]、miR-429[23]、miR-200b-3p[24]、miR-200c-3p[25]、miR-3613-3p[26]、miR-628-3p[27]。其中,miR-411-5p与lncFAM200B的结合位点位于101 bp处(图7),处于牦牛lncFAM200B相较于普通牛多出的59 bp内(图3)。采用TargetScan 7.1和miRanda分别对上述8个miRNAs筛选出1 626,1 575个潜在靶基因,其中包括与脂肪代谢相关的沉默信息调节因子基因(Sirt1)、肌钯蛋白基因(MYPN)、转录调节因子基因(KLF9)、硬脂酰辅酶5基因(SCD5)、磷酸酶基因及张力蛋白同源蛋白基因(PTEN)等。结合miRDB数据库及2个预测软件的分析结果,借助Cytoscape软件构建lncFAM200B-miRNA-mRNA靶向关系的网络调控图(图8)。

蓝色字体序列为miR-411-5p与lncFAM200B结合位点。 The blue font sequence is miR-411-5p and lncFAM200B binding sites.

图8 lncFAM200B与靶基因调控关系图Fig.8 Relationship between lncFAM200B and target gene
利用TargetScan 7.1和miRanda 2个工具对与lncFAM200B相互作用的靶基因进行预测并取交集(图9),共获得433个靶基因。对靶基因进行GO功能富集和KEGG信号通路富集分析。GO富集分析结果显示,靶基因参与80个功能分类,注释到生物学过程、细胞组分及分子功能3大类,其中生物学过程主要注释到RNA聚合酶Ⅱ启动子转录负调控、细胞分化、细胞迁移的负调控、小GTP酶介导的信号转导等,细胞组分主要涉及细胞质、核、核质、核染色质、粘着斑等,分子功能主要涉及染色质结合、核苷酸结合、RNA聚合酶Ⅱ转录因子活性、mRNA结合等(图10)。KEGG通路分析结果显示,靶基因共富集到9个通路上,其中富集程度最高的通路是癌症中的microRNAs(图11)。利用RBPDB数据库预测出55个可能与lncFAM200B结合的靶蛋白(表4),具有多个结合位点的靶蛋白包括EIF4B、RBMX、SFRS1、KHDRBS3、ELAVL1等蛋白,其中HNRNPA1[28]、FUS[29]、Pum2[30]、MBNL[31]4个靶蛋白可能与肌肉和脂肪发育相关。
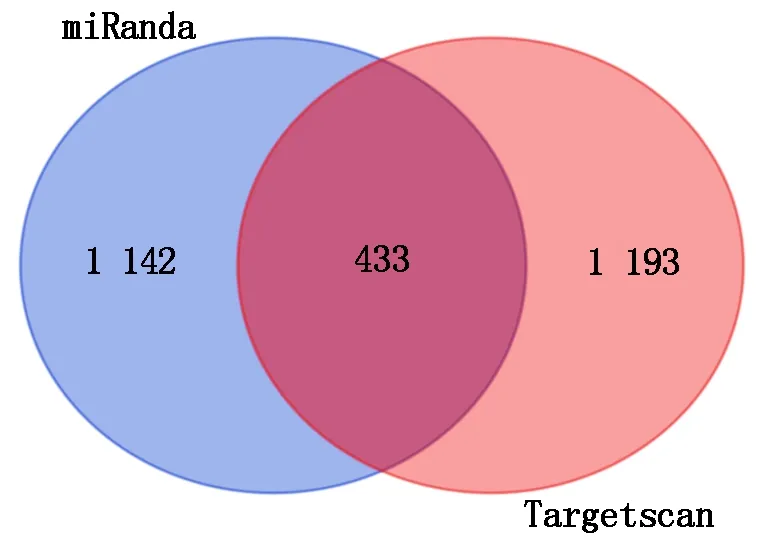
图9 miRanda与Targetscan靶基因预测结果韦恩图Fig.9 The target gene Vienn diagram of miRanda and Targetscan

图10 靶基因GO功能富集分析结果图Fig.10 GO functional enrichment analysis of target gene
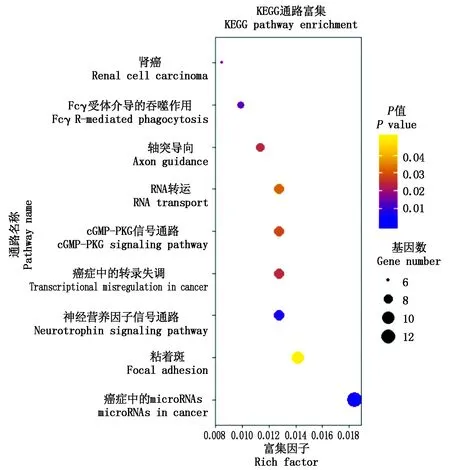
图11 靶基因KEGG通路富集分析Fig.11 KEGG pathway enrichment analysis of target gene
3 讨论与结论
随着高通量测序技术的发展和对非编码RNA研究的不断深入,大量lncRNA被挖掘且功能和作用机制也逐渐被阐明。本研究获得牦牛lncFAM200B全长531 bp,较张思欢[18]的秦川牛lncFAM200B全长多59 bp,经原核表达试验验证,牦牛lncFAM200B也不具备编码蛋白的能力,在牦牛中也是一个真正的长链非编码RNA。
3.1 lncFAM200B组织表达分析
本研究中,lncFAM200B在0.5,4.5岁牦牛的臀肌、臀脂中的表达量差异不显著,与张思欢[18]发现lncFAM200B在成年牛肌肉中的表达水平显著高于犊牛的研究结果不同。首先,牦牛lncFAM200B序列与普通牛lncFAM200B序列存在差异,可能导致与其结合的靶基因发生变化;其二,lncRNA作为非编码RNA,在各物种间的保守性较差,表达丰度低[2],可能导致其在各组织中的表达水平发生变化;其三,与牦牛肉脂肪含量低相关,研究表明,牦牛肉的脂肪含量小于秦川牛[32],脂肪沉积是影响肉质风味的重要因素之一。而本研究中lncFAM200B在0.5岁牦牛肺脏中的表达量显著高于其他组织,牦牛作为高原地区的特有牛种,在长期的自然选择下,其肺脏已形成特定的结构特点来适应高压低氧环境,如肺微动脉管壁和肺血-气屏障均薄于低海拔地区的哺乳动物[33],这种特点在低龄牦牛中表现更为明显。因此,lncFAM200B在牦牛肺脏组织中高表达,可能与牦牛的高原低氧适应性相关。

表4 lncFAM200B靶蛋白预测结果Tab.4 lncFAM200B target protein prediction results
3.2 lncFAM200B-miRNA-mRNA网络分析
本研究借助miRDB数据库筛选出8个可能与lncFAM200B调控肌肉和脂肪发育相关的miRNA,包括miR-411-5p、miR-212-5p、miR-138-5p等。其中miR-411属于miR-379家族,位于人类14号染色体[34]上DLK-DIO3区的miR-379/miR-656簇中。Harafuji等[35]研究发现,miR-411在面肩肱型肌营养不良症(FSHD)成肌细胞中的表达与正常成肌细胞相比显著上调,此外,过表达miR-411可抑制YAF2基因及肌源性标记基因MYOD、MYOG和MYH1的表达。miR-411-5p在横纹肌肉瘤(RMS)中可作为分化诱导因子,miR-411-5p可通过直接下调SPRY4表达来促进p38MAPK活化[20]。而miR-411与lncFAM200B的结合位置位于比张思欢[18]研究中增加的59 bp内,推测存在差异的59 bp可能导致lncFAM200B在牦牛和普通牛中的功能存在差异。在经氧化的低密度脂蛋白处理的THP-1型巨噬细胞中,miR-212通过靶向Sirt1来抑制与脂质代谢和胆固醇逆转运相关的ATP结合盒式运载蛋白A1(ABCA1)表达,从而促进脂质积累和减少胆固醇外流[21]。Guo等[36]的研究结果显示,亮氨酸缺乏会显著增加miR-212在肝中的表达水平,miR-212-5p通过与脂肪酸合酶(FAS)和乙酰辅酶A去饱和酶1(SCD1)的3′UTR结合来抑制酶活,此外,过表达miR-212可显著降低甘油三酸酯(TG)积累。上述研究表明,miR-212在脂质代谢和积累过程中发挥重要作用。Liu等[37]通过双荧光素酶报告分析发现,miR-138可直接与磷酸肌醇依赖性蛋白激酶1(PDK1)的3′UTR结合,从而抑制PDK1表达,过表达miR-138可降低ASMCs的增殖,抑制miR-138表达则得到相反的结果。在另一研究中,miR-138可通过抑制Sirt1表达而促进db/db小鼠平滑肌细胞的增殖和迁移[22]。推测lncFAM200B可能通过直接与这些miRNAs结合或与miRNA竞争性结合靶基因,从而调控牦牛肌肉和脂肪的发育过程。
整合TargetScan 7.1和miRanda 2个靶基因预测工具预测结果,获得433个靶基因,包括Sirt1、MYPN、KLF9、SCD5、PTEN等。Sirt1是依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白脱乙酰酶,该基因可通过抑制PPARγ促进白色脂肪细胞中脂肪动员,并通过下调肌细胞标志基因表达来抑制成肌细胞分化[38]。MYPN作为肌肉的结构组分,其功能是保持肌节完整性以及调节Z线结构。研究发现,该基因的多态性会影响猪肉肉质、胴体性状[39]。KLF9属于基因转录调控因子,在脂肪发生中期,KLF9通过C/EBPα调控PPARγ2的表达,从而促进脂肪分化进程[40]。SCD5是硬脂酰辅酶A去饱和酶(SCD)的异构体,是催化饱和脂肪酸去饱和化的关键酶,可影响肌内脂肪沉积[41]。研究发现,在牛脂肪细胞中,干扰PTEN基因表达可显著抑制Caspase-3蛋白和提高p-Akt蛋白的表达,揭示PTEN基因可通过AKT信号通路抑制脂肪细胞凋亡[42]。
对筛选出的433个靶基因进行GO富集分析发现注释到生物学过程的靶基因主要涉及RNA聚合酶Ⅱ启动子的转录调控过程、细胞分化过程、细胞增殖和迁移的调控过程等,也涉及白色脂肪细胞的分化过程,肌细胞的分化和增殖调控过程,这可能与lncFAM200B基因参与牦牛肌肉和脂肪发育调控有关。在细胞组成部分,除了富集程度较高的细胞质、核质、细胞骨架、核染色质等常规富集类别外,在对单个miRNA靶基因进行分析时,还包括肌动蛋白骨架、核膜等类别。在分子功能类别中,靶基因主要富集在RNA及DNA结合、酶的结合与活性中,lncFAM200B可能通过影响靶基因与其他分子的结合活性或酶活性来调控靶基因功能。KEGG信号通路分析显示,与lncFAM200B相互作用的miRNAs的靶基因主要富集到癌症中的miRNA、Focal adhesion信号通路,神经营养素信号通路、肿瘤的转录调控失调等。该结果提示,lncFAM200B可能通过Focal adhesion信号通路影响细胞的生长与分化,还可能影响癌症形成过程中miRNAs的功能,从而参与癌症的转录调控过程。
3.3 lncFAM200B靶蛋白分析
靶蛋白预测结果显示,lncFAM200B靶蛋白参与RNA剪切和转录调控等过程,HNRNPA1、FUS、Pum2、MBNL1 4个靶蛋白被证明与肌肉和脂肪发育相关。HNRNPA1属hnRNPs家族成员,敲除HNRNPA1基因的小鼠存在肌肉发育缺陷,出现了胚胎致死现象。RT-qPCR结果显示,与野生型小鼠相比,该基因敲除小鼠中肌肉发育相关基因的表达存在显著差异,如MEF2C、USP28、ABCC9等,推测该基因在胚胎肌肉发育过程中起重要调控作用[28]。FUS蛋白是hnRNP复合物的多功能蛋白组分之一,该基因在剪接过程发生突变可能导致肌萎缩侧索硬化症[29]。Pum2蛋白是胚胎发育和细胞分化过程中的翻译抑制剂,被认为是脂肪干细胞中细胞增殖的正调节因子[30]。MBNL1蛋白是一种C3H型锌指蛋白,该基因可调控肌肉相关基因Trim55和INSR的选择性剪接,从而抑制肌肉细胞分化[31]。由此推测lncFAM200B可能通过与HNRNPA1、FUS、Pum2、MBNL1相互作用,从而影响肌肉和脂肪的发育。
本研究成功克隆了牦牛lncFAM200B的全长序列531 bp,相较于普通牛该lncRNA,其长度多59 bp,通过生物信息学分析和原核表达结果证明牦牛lncFAM200B为长链非编码RNA。RT-qPCR结果显示,lncFAM200B在肌肉和脂肪肺脏中的表达量较高。对lncFAM200B可能结合的miRNAs及靶蛋白进行预测分析,结果显示牦牛lncFAM200B与普通牛差异的59 bp区段存在miR-411-5p的结合位点,相互作用miRNA的潜在靶基因(Sirt1、MYPN、KLF9、PTEN和SCD5)及靶蛋白(HNRNPA1、FUS、Pum2和MBNL1)与肌肉和脂肪发育相关。本研究为进一步探索lncFAM200B在牦牛肌肉和脂肪发育过程中的功能及分子机制奠定了基础。

