CaCl2、EBR对盐胁迫下紫花苜蓿种子萌发及幼苗生长的影响研究
刘隆阳 王炳盛 丁宣祺玥
摘 要:以紫花苜蓿为试验材料,探讨了不同程度盐胁迫及外源CaCl2、EBR对紫花苜蓿种子萌发及幼苗生长的影响。结果显示:①盐胁迫显著降低了紫花苜蓿种子的发芽率、发芽指数和活力指数,抑制了紫花苜蓿幼苗的伸长,降低了紫花苜蓿的生长量,盐胁迫程度越高,抑制作用越强。②外源CaCl2、EBR可以显著改善紫花苜蓿种子在盐胁迫下的萌发和幼苗生长情况,其中以CaCl2浓度为10 mmol/L、EBR浓度为0.1 μmol/L时缓解效果最佳。③同等盐胁迫条件下,外源施加10 mmol/L CaCl2对盐胁迫的缓解作用强于0.1 μmol/L EBR。
关键词:CaCl2;EBR;盐胁迫;紫花苜蓿;种子萌发;幼苗生长;影响
土壤盐渍化是限制农业生产最主要的非生物胁迫因素之一。我国约有2 700万hm2盐碱土地,其中耕地占25.92%[1]。在耕地有限且盐渍化日益严重的当下,如何提高作物耐盐性和培育耐盐的作物新品种已成为当前亟待解决的问题。
紫花苜蓿(Medicago sativa L.)作为豆科苜蓿属多年生草本植物,具有良好的营养和经济价值,常作为改良盐碱地的先锋植物,拥有“牧草之王”的美称[2]。然而,土壤盐碱化已成为限制紫花苜蓿产业成长与发展的主要因素之一,寻找有效的植物生长调节剂缓解紫花苜蓿在盐胁迫下所遭受的伤害已成为专家学者们的研究热点。
Ca2+具有维护植物细胞壁和细胞膜正常结构与功能的作用,并作为信号分子,提高植物对逆境的适应性。张会灵等[3]研究发现,适宜浓度的CaCl2可以有效促进豌豆在盐胁迫条件下的萌发,但浓度过低或过高均会对豌豆的生长产生抑制作用;丁能飞等[4]以西兰花为试验材料,发现CaCl2可显著促进西兰花在盐胁迫下的生长,并提出缓解盐胁迫的最佳钙浓度为10 mmol/L。2,4-表油菜素内酯(2,4-Epibrassinolide,EBR)是一种广泛分布于植物器官中的甾醇类新型植物激素,其在较低浓度条件下便可显著影响植物的生理活动。王小山等[5]研究发现,0.1 μmol/L EBR能有效缓解盐胁迫对植物生长的抑制作用,维持植物体内的离子平衡。
目前,对外源调节物质与植物抗逆性的关系及其信號转导途径的研究越来越受到人们的关注,但有关外源CaCl2、EBR在提高苜蓿抗盐性方面的研究报道甚少。本文以紫花苜蓿为试验材料,研究不同浓度盐胁迫及外源CaCl2、EBR处理对紫花苜蓿种子萌发及幼苗生长的影响,确定盐胁迫下提高紫花苜蓿种子发芽、促进幼苗生长的最佳CaCl2和EBR浓度,为进一步研究添加外源CaCl2、EBR调控苜蓿幼苗的耐盐机理和利用外源调节剂缓解盐害提供理论依据和技术指导。
1 材料与方法
1.1 供试材料
试验材料为紫花苜蓿WL525品种,其种子由扬州大学提供。
1.2 试验方法
试验前对已选取的优质供试苜蓿种子进行消毒处理。试验处理如下:①盐胁迫处理:分别配制0 mmol/L、50 mmol/L、150 mmol/L、250 mmol/L的NaCl溶液。②试验采用外源CaCl2、EBR浸种处理:在150 mmol/L浓度NaCl胁迫处理下,分别配制0 mmol/L、2.5 mmol/L、10 mmol/L、40 mmol/L的CaCl2溶液和浓度0 μmol/L、0.01 μmol/L、0.1 μmol/L、1 μmol/L的EBR溶液。将消毒完全的种子均匀摆放在垫有2层滤纸、底部铺有海绵的发芽盒(边长12 cm)中,分别往发芽盒中加入50 mL配制好的处理液(至滤纸、海绵饱和),每个处理3组重复。
萌发试验在光照培养箱中进行,连续7 d定点观察并记录种子的萌发个数(以胚根长度>1 mm认为发芽)。相关指标计算公式如下:
发芽率(%)=(正常发芽粒数/供试种子总数)×100%;
发芽指数(GI)=∑Gt/Dt,Gt为在第t日的发芽数,Dt为相应的发芽天数;
活力指数(VI)=S∑Gt/Dt,S为幼苗的平均长度。
第7天统计种子发芽结束时,测定幼苗的整株长度、干重,每个处理随机选取9株测量。
1.3 数据处理及分析
采用Excel 2016软件和SPSS 18.0软件进行数据处理。
2 结果与分析
2.1 不同盐浓度对紫花苜蓿种子萌发的影响
2.1.1 不同盐浓度对紫花苜蓿种子发芽率的影响
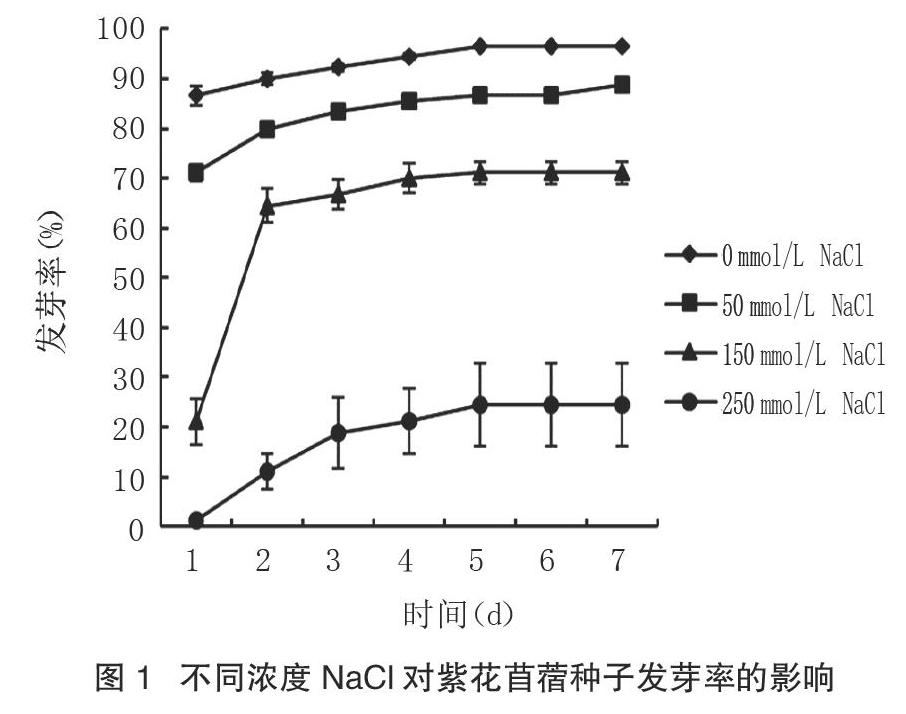
由图1可以看出,盐胁迫显著降低了紫花苜蓿种子的发芽率(P<0.05),且降低幅度随盐浓度的增加逐渐增大。50 mmol/L NaCl处理下紫花苜蓿种子发芽率显著低于对照(P<0.05),但明显高于150 mmol/L、250 mmol/L的NaCl处理(P<0.05),其发芽率保持在较高水平且整体变化趋势与对照一致。150 mmol/L NaCl处理下,紫花苜蓿种子在第1天仅有少量种子萌发,之后各时期的发芽率均保持在60%~70%,经250 mmol/L NaCl处理,紫花苜蓿种子发芽率最低,第1、2天仅有极少数种子萌发,最终发芽率为24.44%,与对照相比降低了72.23%。
2.1.2 不同盐浓度对紫花苜蓿种子发芽指数的影响
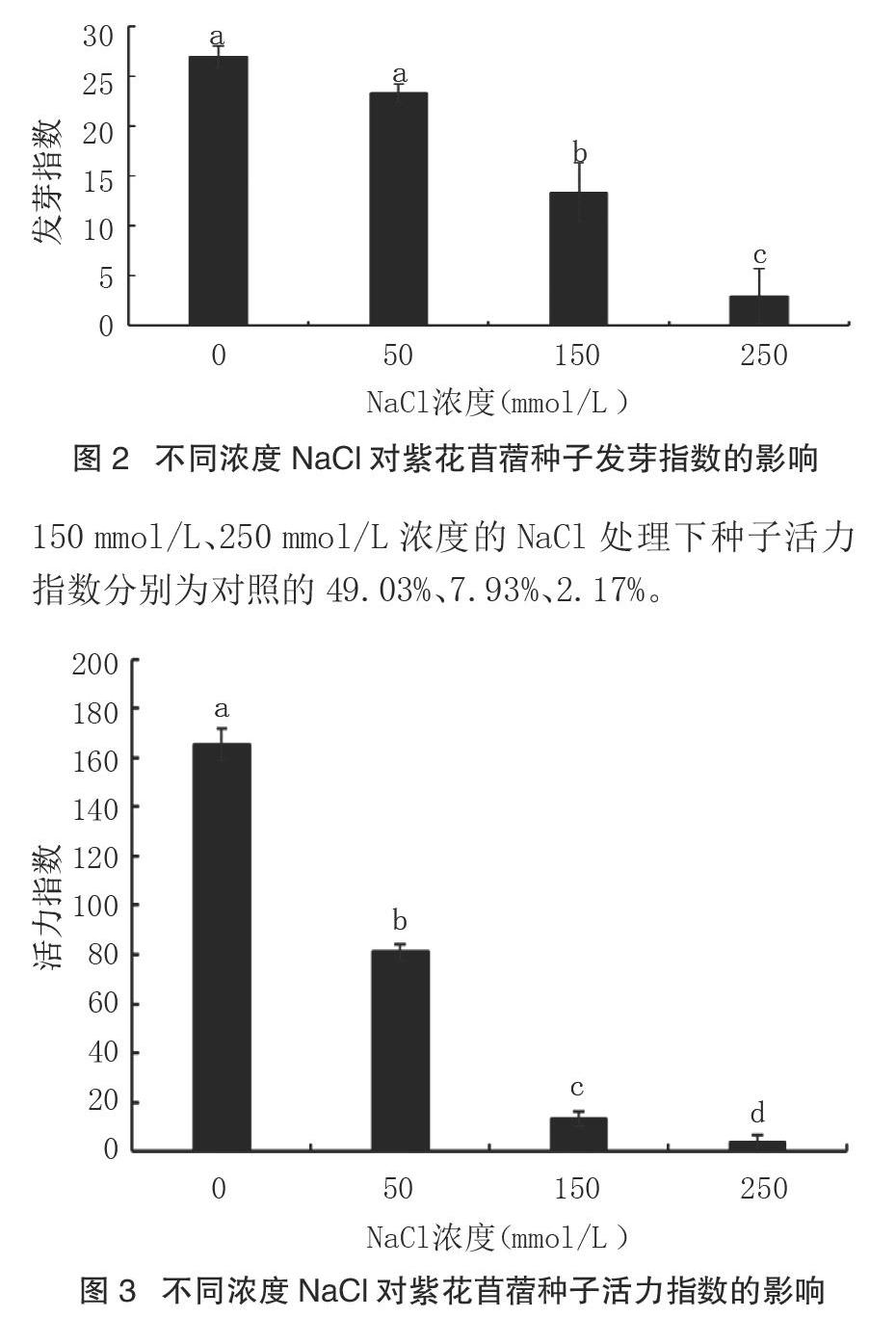
研究表明(图2),随着盐浓度的不断增加,紫花苜蓿种子的发芽指数逐渐降低。低浓度NaCl(50 mmol/L)处理与对照相比,对紫花苜蓿种子发芽指数影响不大,但随着NaCl溶液浓度(≥150 mmol/L)的增加,紫花苜蓿种子的发芽指数显著降低(P<0.05)。50 mmol/L、150 mmol/L、250 mmol/L处理下种子发芽指数分别为对照的86.34%、49.48%、11.03%。
2.1.3 不同盐浓度对紫花苜蓿种子活力指数的影响
由圖3可以看出,随着盐浓度的增加,紫花苜蓿种子的活力指数逐渐显著降低(P<0.05)。50 mmol/L、150 mmol/L、250 mmol/L浓度的NaCl处理下种子活力指数分别为对照的49.03%、7.93%、2.17%。
2.1.4 不同盐浓度对紫花苜蓿幼苗生长的影响
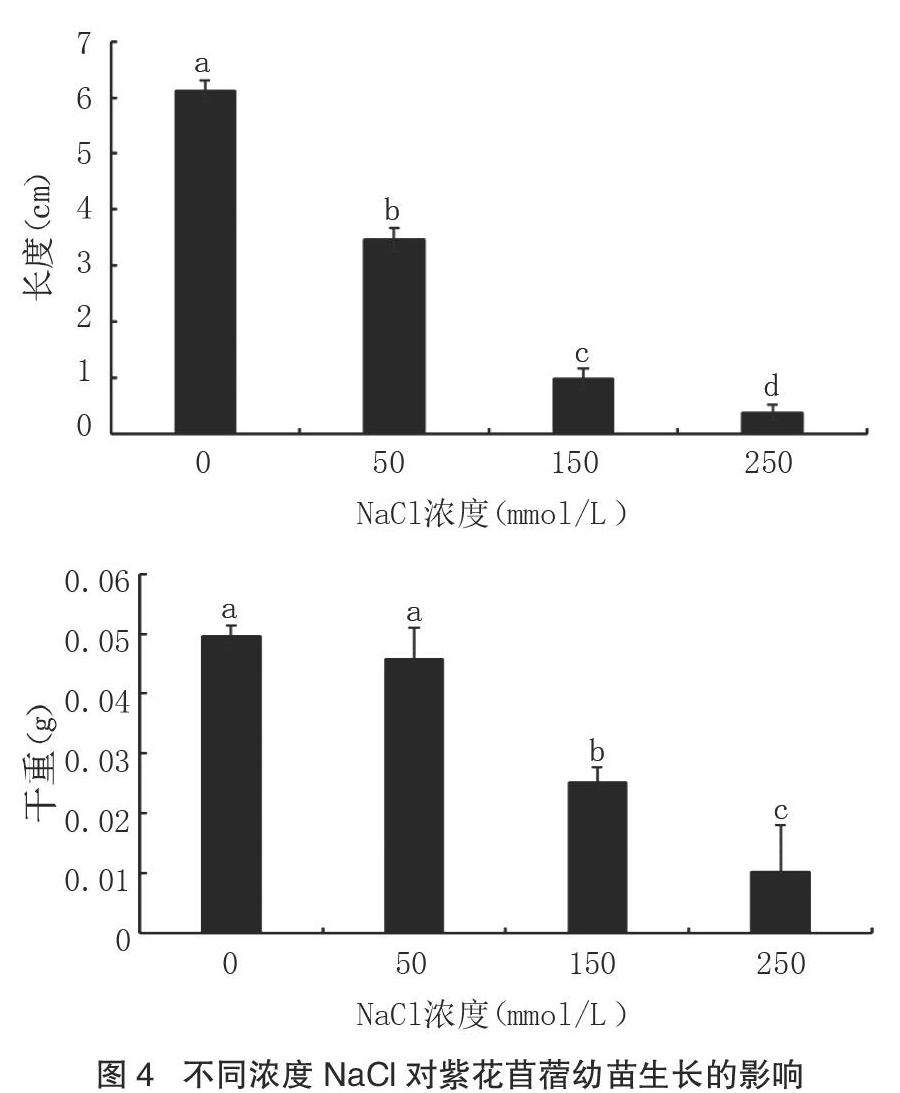
由图4可以看出,盐胁迫对紫花苜蓿幼苗的生长具有抑制作用,且随着盐浓度的不断增加,抑制作用越强,除50 mmol/L的NaCl处理下紫花苜蓿幼苗干重与对照没有显著差异外,其余处理下紫花苜蓿幼苗长度、干重均逐渐显著减少(P<0.05)。50 mmol/L NaCl处理下紫花苜蓿幼苗长度、干重分别为对照的56.79%、92.65%;当盐浓度达到高浓度(≥150 mmol/L)时,少数已萌发的幼苗无法正常生长,150 mmol/L NaCl处理下紫花苜蓿幼苗长度、干重分别为对照的16.04%、50.88%;250 mmol/L NaCl处理下紫花苜蓿幼苗长度、干重分别仅为对照的2.13%和15.97%。
2.2 不同CaCl2、EBR浓度对盐胁迫下紫花苜蓿种子萌发的影响
通过分析紫花苜蓿种子在盐胁迫处理下的萌发结果,确定150 mmol/L NaCl可作为研究外源CaCl2、EBR处理对盐胁迫下紫花苜蓿种子萌发及幼苗生长影响的适宜浓度。
2.2.1 不同CaCl2、EBR浓度对盐胁迫下紫花苜蓿种子发芽率的影响
由图5可以看出,在150 mmol/L的盐胁迫下,添加外源CaCl2可以显著提高各时期紫花苜蓿种子的发芽率,但其作用效果存在浓度效应。2.5 mmol/L、40 mmol/L CaCl2处理下紫花苜蓿种子最终发芽率比单纯盐处理分别显著提高了14.06%、18.75%,但均显著低于10 mmol/L CaCl2处理,10 mmol/L CaCl2处理下紫花苜蓿种子最终发芽率比单纯盐处理显著提高了28.13%。
在150 mmol/L的盐胁迫下,不同浓度EBR处理对紫花苜蓿种子萌发作用效果不同。0.01 μmol/L EBR处理使紫花苜蓿种子的萌发受到进一步抑制,种子最终发芽率为63.33%,比单纯盐处理降低了10.94%。当外源EBR浓度为 0.1 μmol/L 时,紫花苜蓿种子的发芽率在各时期均显著高于其他处理,其种子最终发芽率分别是对照、0.01 μmol/L、1 μmol/L EBR处理的1.14倍、1.28倍与1.07倍。经1 μmol/L EBR处理的紫花苜蓿种子的发芽进程及最终发芽率与对照相比,均无显著差异。
2.2.2 不同CaCl2、EBR浓度对盐胁迫下紫花苜蓿种子发芽指数的影响
由图6可知,2.5 mmol/L、40 mmol/L外源CaCl2处理对盐胁迫下紫花苜蓿种子的发芽指数无显著影响,当CaCl2浓度为10 mmol/L时,种子的发芽指数和对照相比显著升高,发芽指数为20.07,为单纯盐处理的1.50倍。
0.01 μmol/L、1 μmol/L外源EBR处理对盐胁迫下紫花苜蓿种子的发芽指数无显著影响,但都显著低于0.1 μmol/L EBR处理,0.1 μmol/L EBR处理下紫花苜蓿种子的发芽指数为16.25,分别是对照、0.01 μmol/L、1 μmol/L EBR处理的1.22倍、1.28倍与1.25倍。
2.2.3 不同CaCl2、EBR浓度对盐胁迫下紫花苜蓿种子活力指数的影响
在150 mmol/L NaCl胁迫下,如图7所示,添加外源CaCl2可显著提高紫花苜蓿种子的活力指数,但其作用效果存在浓度效应。2.5 mmol/L CaCl2处理下紫花苜蓿种子的活力指数与对照相比显著提高了3.68倍;10 mmol/L CaCl2处理下紫花苜蓿种子的活力指数最高,为65.42,是单纯盐处理的4.99倍;随着CaCl2浓度的升高(40 mmol/L),紫花苜蓿种子的活力指数下降,为单纯盐处理的2.87倍。
盐胁迫下添加外源EBR对紫花苜蓿种子活力指数的影响同样存在浓度效应。0.01 μmol/L EBR处理下,紫花苜蓿种子的活力指数与对照相比显著升高了80.61%,0.1 μmol/L EBR处理下紫花苜蓿种子的活力指数达到最高,为34.29,是单纯盐处理的2.62倍,当种子经1 μmol/L EBR处理时其活力指数下降,仅为对照的77.40%。
2.2.4 不同CaCl2、EBR浓度对盐胁迫下紫花苜蓿幼苗生长的影响
如图8所示,在150 mmol/L NaCl胁迫下,添加外源CaCl2可以显著提高紫花苜蓿幼苗的长度和干重,其值随CaCl2浓度的提高均先升高后降低,10 mmol/L CaCl2提升作用最为明显。对照、2.5 mmol/L、40 mmol/LCaCl2处理下紫花苜蓿幼苗的长度分别是10 mmol/L CaCl2处理的30.06%、81.90%、75.15%。不同浓度CaCl2处理对紫花苜蓿幼苗干重的提升效果没有显著差异。
盐胁迫下紫花苜蓿幼苗的长度和干重,随EBR浓度的提高呈现先升高后降低的变化,其中0.1 μmol/L EBR提升作用最为显著。0.01 μmol/L EBR处理显著提高了紫花苜蓿幼苗的长度,但对幼苗干重的提升效果并不明显,0.1 μmol/L EBR处理显著促进了幼苗的生长,其幼苗长度和干重与对照相比分别增加了115.31%、61.80%,当外源EBR浓度升高至1 μmol/L 时,对紫花苜蓿幼苗的生长又起到明显的抑制作用。
3 讨论
盐胁迫对植物的伤害主要体现在抑制种子萌发及幼苗生长上,并最终引起生物量积累下降。尽管紫花苜蓿属于耐盐性较强的作物,但在萌发和苗期依然对盐胁迫具有较高的敏感性。在盐碱条件下拥有较高的萌发率是牧草在盐碱地建植的关键,也是牧草在盐碱环境中生存的基础。
盐胁迫可显著降低植物种子发芽率、发芽指数、活力指数及胚芽长、胚根长,抑制幼苗的生长。本试验中,盐胁迫抑制了紫花苜蓿种子的萌发,降低了发芽率、发芽指数、活力指数、苗长及干重,该结果与陆婷等[6]在橡胶草上的研究结果相同;而李玉梅等[7]认为盐胁迫对植物生长存在“低促进、高抑制”的浓度效应,这应该与所研究的植物品种及盐处理浓度有关。本研究中,150 mmol/L NaCl处理下,外源添加CaCl2和EBR均可以不同程度地提高紫花苜蓿种子的萌发能力,改善了萌发期幼苗的生长,而尤以10 mmol/L CaCl2和0.1 μmol/L EBR处理效果最显著。
本研究中外源CaCl2緩解盐胁迫对紫花苜蓿种子萌发抑制作用的最佳浓度与李文杨[8]的研究结果相同,而何丽丹等[9]认为20 mmol/L CaCl2对盐胁迫的缓解效果最佳。同样的,刘金隆[10]在对十字花科植物的研究中认为10-4 μmol/L EBR对盐胁迫的缓解效果最好,与本研究中0.1 μmol/L也不尽相同。因此,CaCl2、EBR在不同的物种中应用时可能会存在浓度差异。由于多数生长调节剂对生长的调控作用都具有浓度效应,即低浓度促进生长而高浓度抑制生长的现象,因此在盐胁迫条件下继续提高CaCl2和EBR浓度会抑制种子萌发及幼苗生长的现象,究竟是由于CaCl2、EBR增强了盐胁迫的抑制作用还是因为高浓度CaCl2、EBR自身对植物产生了新的抑制作用而引起的,其机理仍有待于进一步研究。
另外,本研究通过比较两种外源调节物质对盐胁迫的缓解效果发现,同等浓度盐胁迫下添加10 mmol/L CaCl2后,紫花苜蓿种子及幼苗的各项指标普遍高于0.1 μmol/L EBR,说明CaCl2对盐胁迫的缓解作用强于EBR,推断这与CaCl2和EBR参与不同的生长调节机制有关,这对盐碱地苜蓿大田生产上选择合适的外源生长调节剂具有重要的指导意义。
综上所述,盐胁迫会显著抑制紫花苜蓿种子萌发及幼苗生长,外源CaCl2和EBR对盐胁迫具有一定的缓解作用,但其作用效果存在明显的局限性,即适宜的CaCl2、EBR浓度可以促进种子萌发,缓解盐害效应,当CaCl2、EBR浓度较高时,其促进作用明显减弱, 甚至抑制种子的萌发。在盐碱地上种植紫花苜蓿,并外源施加一定浓度的CaCl2(以10 mmol/L为宜)、EBR(以从0.1 μmol/L为宜),可以有效促进紫花苜蓿在盐胁迫条件下种子的萌发及幼苗生长。
4 结论
(1)盐胁迫显著降低了紫花苜蓿种子的发芽率、发芽指数和活力指数,抑制了紫花苜蓿幼苗的伸长,降低了紫花苜蓿的生长量。另外,盐胁迫程度越高,抑制作用越强。
(2)外源CaCl2、EBR可以显著改善紫花苜蓿种子在盐胁迫下的萌发和幼苗生长情况,但具有明显的浓度效应,其中以CaCl2浓度为10 mmol/L、EBR浓度为0.1 μmol/L时缓解效果最佳。
(3)同等盐浓度胁迫条件下,外源施加10 mmol/L CaCl2对盐胁迫的缓解作用强于0.1 μmol/L EBR。
参考文献:
[ 1 ] 李永智,单风翔.土壤盐渍化危害及治理途径浅析[J].西部探矿工程,2008(8):85-88.
[ 2 ] Dong XF,Gao WW,Su JL,et al.Effects of dietary polysavone(alfalfa extract) and chlortetracycline supplementation onantioxidation and meat quality in broiler chickens[J].BritishPoultry Science,2011,52(3):302-309.
[ 3 ] 张会灵,高文,陈双臣,等.氯化钙对盐胁迫下豌豆种子萌发及幼苗生理特性的影响[J].中国种业,2016(3):38-40.
[ 4 ] 丁能飞,傅庆林,刘琛,等.外源氯化钙对盐胁迫下西兰花抗氧化酶系统及离子吸收的影响[J].中国农学通报,2010,26(6):133-137.
[ 5 ] 王小山,季晓敏,刘隆阳,等.EBR对NaCl胁迫下苜蓿属植物离子吸收和分配的影响[J].草业学报,2018,27(9):110-119.
[ 6 ] 陆婷,李英霜,康健.混合盐碱胁迫对橡胶草种子萌发的影响[J].种子,2019,38(2):12-15,19.
[ 7 ] 李玉梅,田新,姜云天.混合盐胁迫对茶花凤仙种子萌发的影响[J].种子,2019,38(4):36-41,46.
[ 8 ] 李文杨.外源钙对盐胁迫下白菜种子萌发的影响[J].南方园艺,2018,29(1):9-12.
[ 9 ] 何丽丹,刘广明,杨劲松,等.外源物质浸种对NaCl胁迫下盐地碱蓬发芽的影响[J].草业科学,2013,30(6):860-867.
[ 10 ] 刘金隆.油菜素内酯调控三种双子叶植物耐盐性的效应 及其机制[D].南京:南京农业大学,2013.

