苏木素对膀胱癌T24细胞凋亡的影响
张 旭,夏圻儿,徐 杰
(上海市浦东新区人民医院泌尿外科,上海 201299;*通讯作者,E-mail:uro-zhang@163.com)
苏木属豆科云实属植物,为传统中药材,临床上具有祛痰、止痛、活血、散风、镇静等功效,并有一定的抗癌作用。苏木心材的水提物称为苏木素(hematoxylin),其主要成分为巴西苏木素[1]。作为天然色素,广泛应用于食品工业、日化工业、皮革及织物染色等行业[2],也是细胞学中常用的染色剂。对苏木素的研究表明[3,4],其在体外及体内实验中对K562、HL-60、P815、L929、Yac-1等肿瘤细胞均有显著的杀伤活性,在局部大剂量给药时可以使S180、EAC、H22、P388、L1210等荷瘤动物生存期显著延长。本课题组曾观察到苏木素在较低浓度下能诱导T24细胞发生凋亡,为进一步探讨其机制,进行了以下研究。
1 材料与方法
1.1 材料
苏木素(美国Amresco公司,分子式:C16H14O6·3H2O,相对分子质量356.33),以生理盐水配置为2%的溶液,高压蒸气灭菌备用;膀胱癌T24细胞(上海中科院);细胞培养基RPMI-1640、胎牛血清(美国Gibco公司);四甲基偶氮唑盐(MTT);碘化丙啶(PI)和异硫氰酸荧光素(FITC)均为美国sigma公司;CO2培养箱(美国BINDER公司);倒置显微镜(日本Olympus公司);FACS流式细胞仪(美国BD公司);RT-PCR仪(美国BIO-RAD公司);透射电子显微镜(荷兰FEI TECNAI G2 12型)。
1.2 方法
1.2.1 T24细胞培养 T24细胞用RPMI-1640培养基(含10%胎牛血清、100 U/ml青霉素及100 mg/ml链霉素)37 ℃,5% CO2浓度下培养24 h。取对数生长期细胞进行实验。
1.2.2 MTT实验 配制0.05%、0.1%和0.2%工作浓度苏木素;分别在37 ℃,5% CO2浓度下培养2,12,24 h;加MTT,继续孵育4 h;吸弃细胞培养上清液,每孔加入150 μl DMSO,震荡10-15 min以溶解结晶。在490 nm测定每孔的吸光度(OD)值。
1.2.3 透射电镜观察肿瘤细胞超微结构改变 取生长状态良好的细胞约106,0.2%苏木素处理24 h后,胰酶消化贴壁的T24细胞并使用2.5%的戊二醛固定细胞,透射电镜观察。
1.2.4 线粒体DNA(mtDNA)突变检测
1.2.4.1 mtDNA HV1和HV2区引物设计 在美国国立生物技术信息中心获取mtDNA全长序列(全长16 569 bp),通过查阅文献的方式找到mtDNA的HV1(16 001-16 569 bp)和HV2(1-574 bp)两个高变区(HV1和HV2高变区序列),使用Premier 5软件在HV1和HV2的两端设计引物以保证跨过完整的HV1和HV2区,引物设计策略(见图1)。
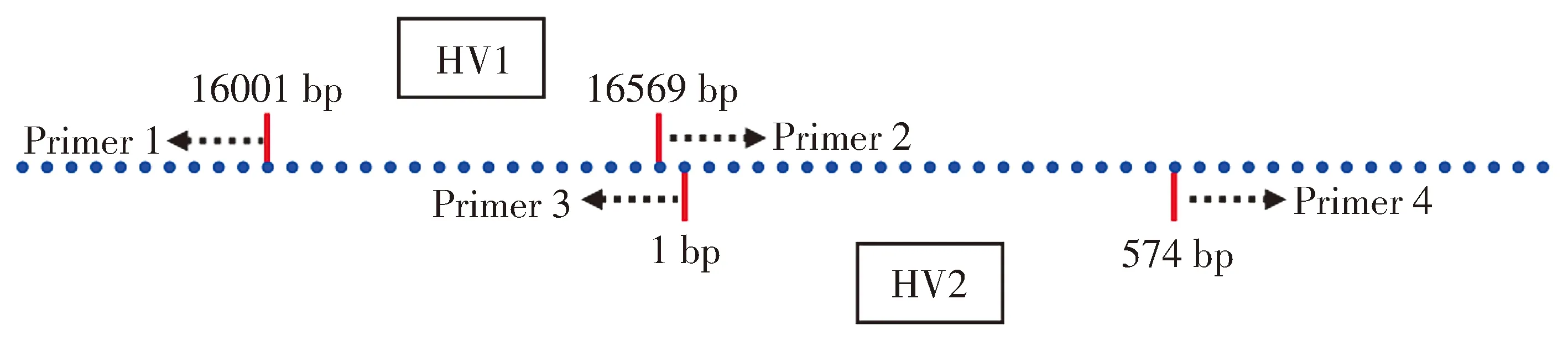
图1 mtDNA HV1和HV2区引物设计示意图Figure 1 Primer design in HV1 and HV2 region of mtDNA
1.2.4.2 T24细胞总DNA的提取 正常培养24 h后加入0.2%苏木素,每个设置3个复孔,加药后处理24 h。不含苏木素的T24细胞(空白对照组)继续培养24 h。收集最多不超过5×106个细胞,清除RNA,加入蛋白酶K、裂解液,加入DNA纯化柱内,所得总DNA进行测序。
1.2.5 RT-PCR定量检测细胞色素C、caspase-3和caspase-9的表达
用TRIzol法提取细胞总RNA,逆转录合成cDNA,1%琼脂糖凝胶电泳分离基因片段,BioRad.iQ5 Bandscan软件分析基因表达水平。
实时定量PCR体系:2×UltraSYBR Mixture 25 μl,Forward Primer(10 μmol/L) 1 μl,Reverse Primer(10 μmol/L)1 μl,Template DNA 1 μl,RNase-Free Water 22 μl。PCR反应程序(两步法PCR):预变性95 ℃ 10 min,变性95 ℃ 15 s,退火/延伸60 ℃ 1 min,40个循环。融解曲线分析:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。
1.2.6 统计学分析 采用SPSS 26.0软件,MTT实验中两组间的OD值均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MTT实验结果
将冻存管中的T24细胞悬浮液加入到培养瓶中,37 ℃,5% CO2浓度下培养24 h,细胞生长状态良好(见图2)。由表1可知:在苏木素处理2 h后,0.05%和0.1%苏木素对T24细胞无明显抑制,而0.2%苏木素抑制明显;处理12 h和24 h后,0.05%,0.1%,0.2%苏木素均抑制明显。因此,苏木素对T24肿瘤细胞的生长抑制作用随苏木素浓度的增加及作用时间延长而增强。
图2 正常生长的T24细胞 (×200)Figure 2 Normal growth of T24 cells (×200)
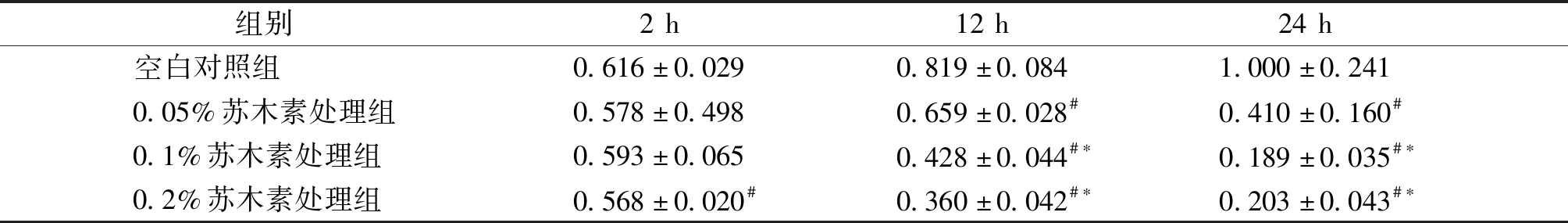
表1 不同浓度的苏木素处理2,12,24 h后T24细胞MTT实验吸光度值比较
2.2 透射电镜观察肿瘤细胞超微结构改变
0.2%苏木素处理T24肿瘤细胞24 h后,细胞形态不规则,细胞核深染,染色质呈块状凝集,胞浆内出现空洞,线粒体较少,部分细胞器破坏,细胞膜有缺损现象(见图3)。
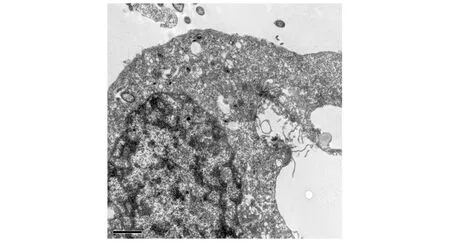
图3 苏木素处理T24细胞24 h后的超微结构改变 (透射电镜,×25 000)Figure 3 Ultrastructural changes of T24 cells treated with hematoxylin for 24 h (TEM,×25 000)
2.3 线粒体DNA突变检测
经过0.2%苏木素处理后,mtDNA HV1和HV2两个高变区位点均未发生突变。
2.4 RT-PCR定量检测细胞色素C、caspase-3和caspase-9的表达
使用2-ΔΔCt法进行相对定量分析,结果显示经过0.2%苏木素处理24 h后肿瘤细胞中细胞色素C的表达水平提高了1.16倍。caspase-3的表达水平提高了3.23倍,caspase-9的表达水平提高了7.94倍(见表2)。

表2 0.2%苏木素处理24 h后T24细胞的细胞色素C、caspase-3、caspase-9的表达水平
3 讨论
细胞凋亡和细胞增殖都是生命的基本现象,是维持体内细胞数量动态平衡的基本措施。细胞凋亡的途径主要有两条,一条是通过胞外信号激活细胞内的凋亡酶caspase、一条是通过线粒体释放凋亡酶激活因子激活caspase。这些活化的caspase可将细胞内的重要蛋白降解,引起细胞凋亡。
Caspase属于半胱氨酸蛋白酶,相当于线虫中的ced-3,这些蛋白酶是引起细胞凋亡的关键酶,一旦被信号途径激活,能将细胞内的蛋白质降解,使细胞不可逆的走向死亡。Caspase分为两类[5]:一类为执行者(executioner或effector),如caspase-3、6、7,它们可直接降解胞内的结构蛋白和功能蛋白,引起凋亡,但不能通过自催化(autocatalytic)或自剪接的方式激活;另一类为启动者(initiator),如caspase-8、9,能通过自剪接而激活,然后引起caspase级联反应,如caspase-8可依次激活caspase-3、6、7。细胞应激反应或凋亡信号能引起线粒体细胞色素C释放,作为凋亡诱导因子,细胞色素C能与Apaf-1、caspase-9前体、ATP/dATP形成凋亡体,然后召集并激活caspase-3,进而引发caspases级联反应,导致细胞凋亡[6,7]。
本研究结果显示,苏木素处理24 h后,T24细胞形态不规则,细胞核深染,染色质呈块状凝集,胞浆内出现空洞,线粒体较少,部分细胞器破坏,细胞膜有缺损现象,证明其具有诱导T24细胞凋亡的作用。从MTT检测结果可知,苏木素对T24肿瘤细胞的诱导凋亡作用随苏木素浓度的增加而增强。在苏木素处理T24细胞2 h后,0.05%和0.1%苏木素组诱导凋亡的强度无明显的差异,在0.2%苏木素处理组效果显著;处理12 h后,0.05%及0.1%苏木素组亦有显效;处理24 h后,0.05%,0.1%,0.2%苏木素均明显诱导凋亡。RT-PCR检测到细胞色素C表达表达水平提高了1.16倍,证明其已进入胞浆。有研究认为胞质细胞色素C含量与细胞早期凋亡率呈正相关[8]。而0.2%苏木素处理24 h后caspase-9的表达水平提高了7.94倍,表明casperse-9前体与凋亡酶激活因子-1(apoptotic protease activating factor-1,Apaf1)、细胞色素C、ATP/dATP形成凋亡小体增加,从而启动凋亡,使caspase-3的表达水平提高了3.23倍,并被激活,导致T24细胞凋亡。
线粒体凋亡是一种精确调控的细胞死亡形式,通过靶向癌细胞发挥肿瘤抑制机制的作用。线粒体脂质,如心磷脂、神经酰胺和鞘氨醇-1-磷酸,通过与吞噬细胞的机械作用,作为清除受损线粒体的有丝分裂信号,通过细胞色素C释放到细胞质中激活线粒体凋亡[9]。
本研究结果表明随着苏木素浓度的提高,它诱导膀胱癌细胞凋亡的能力增强,其并未通过导致线粒体DNA发生变化而启动凋亡,而是通过使线粒体中的细胞色素C释放到细胞质中,引发caspases级联反应,导致T24细胞凋亡。

