消化系炎性纤维性息肉内镜微创诊治分析
陆明军, 袁静萍, 谭诗云
1.湖北民族大学附属民大医院消化内科,湖北 恩施 445000; 2.武汉大学人民医院病理科; 3.武汉大学人民医院消化内科 湖北省消化疾病微创诊治医学临床研究中心
炎性纤维性息肉(inflammatory fibroid polyps, IFP)在胃肠道极为罕见,发病率占所有胃息肉的0.1%以下[1]。多数患者无典型临床表现,术前缺乏有效的诊断依据,本研究收集了22例消化系IFP病例,通过分析临床、病理及内镜资料,找到IFP诊断与鉴别诊断特征,并进一步探讨内镜微创治疗的有效性及安全性。
1 资料与方法
1.1 一般资料收集武汉大学人民医院2016年1月1日至2018年12月31日经病理诊断为IFP的患者22例,进行临床、病理及内镜资料分析,对其中20例内镜微创治疗(包括ESD、EMR、高频电凝电切术)的患者进一步观察其不良反应及复发情况。
1.2 纳入及排除标准纳入标准:在武汉大学人民医院电子病历系统中搜索2016年1月1日至2018年12月31日就诊并行电子胃镜检查及病理活检诊断为IFP的所有患者,均签署知情同意书。排除标准:病理诊断不符合IPF的患者。
2 结果
2.1 临床特征22例IFP患者中,男8例,女14例,男女比例1∶1.75;年龄(52.73±10.96)岁(27~71岁),40岁以上者居多,占95.45%(21/22),其中,40~60岁者占59.09%(13/22),>60岁者占36.36%(8/22)。病灶特点:病灶多为单发,仅1例为病灶多发,表现为胃多发息肉(胃角:0.8 cm×1.0 cm,胃窦大弯:0.4 cm×0.5 cm);病灶部位以胃窦为主,占82.61%(19/23),其余为胃角1例,胃底2例,小肠1例;病灶直径(1.71±1.04)cm,最大直径4.5 cm。1例小肠IFP合并结肠腺癌,2例胃IFP合并食管平滑肌瘤。临床表现:病程3 d~2年;临床症状主要为腹痛、腹胀、恶心、呕吐及黑便等,与病灶部位、大小、是否伴有糜烂或溃疡有关,1例为胃窦溃疡伴出血表现为黑便,其余无特征性临床表现。
2.2 病理特征肉眼大体观:表现为大小0.5 cm×0.4 cm×0.3 cm至4.5 cm×4.0 cm×3.0 cm灰白黏膜组织或灰红结节样物,表面多光滑,部分伴有糜烂或溃疡,多呈黏膜下生长,切面质地中等,包膜完整,边界清楚。组织形态学:表现为黏膜或黏膜下生长为主,2例达固有肌层,典型者表现为梭形细胞增生,伴嗜酸性粒细胞浸润,围绕血管形成“洋葱皮样”结构(见图1)。免疫组织化学染色(见图2~3):100%(1/1)Vimentin呈阳性表达,90.91%(10/11)CD34呈阳性表达,55.56%(5/9)SMA呈阳性表达,100%(1/1)CD68呈局灶阳性表达,100%(11/11)CD117呈阴性表达,100%(11/11)S-100呈阴性表达,100%(2/2)EMA呈阴性表达,100%(1/1)PCK呈阴性表达,88.89%(8/9)DOG-1呈阴性表达,87.50%(7/8)Desmin呈阴性表达,50.00%(1/2)β-catenin呈阴性表达,100%(7/7)Ki67呈低增殖,阳性指数1%~5%。
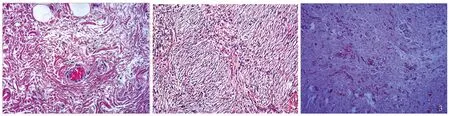
图1 梭形细胞增生,伴嗜酸性粒细胞浸润,围绕血管形成“洋葱皮样”结构(HE染色,放大200倍);图2 免疫组化:CD34(+,弥漫强)、S100(-)、EMA(-)(放大200倍);图3 免疫组化:CD34(+)、CD117(-)、Desmin(-)、S-100(-)、DOG-1(-)、SMA(-)、STAT-6(-)(放大200倍)
2.3 内镜特征普通内镜下表现为息肉样隆起18例,表面光滑,边界清楚,占位2例,糜烂1例,溃疡1例(见图4~6)。其中,13例行EUS检查,5例起源于固有肌层,呈低回声改变;5例起源于黏膜肌层,其中4例呈低回声改变,1例呈混合回声改变;3例起源于黏膜下层,其中1例呈低回声改变,2例呈混合回声改变。病灶起源以黏膜肌层或黏膜下层为主,呈低回声或混合回声改变,内部回声尚均匀,边界欠清(见图7~9)。

图4 普通内镜表现为胃息肉;图5 普通内镜表现为胃占位;图6 普通内镜表现为胃溃疡Fig 4 Common endoscopy showed gastric polyps; Fig 5 Common endoscopy showed gastric mass;
2.4 治疗情况20例IFP患者行内镜微创治疗,共有21个病灶,其中14个病灶行ESD,3个病灶行EMR,另外4个病灶行高频电凝电切术。术前有2例行组织病理活检,与术后诊断一致。仅1例起源于胃固有肌层的IFP行ESD手术出现术中出血,量约150 ml,内镜下止血成功,其余患者均未发生术中及术后迟发型出血、穿孔等并发症。2例行外科手术治疗,其中1例为小肠IFP合并右半结肠腺癌,行剖腹探查+右半结肠癌根治术+小肠肿块切除术;另1例患者27岁,由于病灶位于胃窦近幽门处,直径达4.5 cm,术前怀疑有恶变倾向,故行胃大部切除术,术后病理诊断为胃IFP。所有患者随访4~38个月,失访2例,死亡1例(非IFP引起),有效回访患者均未出现复发。
3 讨论
1949年Vanek[2]首次报道了6例IFP,当时命名为“胃黏膜下肉芽肿伴嗜酸性粒细胞浸润”,故又称“Vanek tumor”。IFP这个术语最早由Helwig和Ranier于1953年提出[3]。现在,IFP被定义为源自胃肠道黏膜下层的良性病变,根据第4版《WHO消化系统肿瘤病理学和遗传学》分类,IFP归为消化道间叶源性肿瘤[4]。
IFP在消化道比较罕见,我们两年时间共搜集了22例患者,从一般资料来看,女性占优势,发病年龄以中老年为主,40岁以下仅1例。从病灶特点来看,病灶多为单发,仅1例为病灶多发,3例合并消化道其他部位肿瘤,1例小肠IFP合并右半结肠腺癌,2例胃IFP合并食管平滑肌瘤。病灶部位以胃窦为主,占82.61%(19/23),其中胃窦前壁好发,占36.84%(7/19)。病灶直径0.3~4.5cm,平均直径1.71 cm。从临床表现来看,临床症状各不相同,与病灶部位、大小、是否伴有糜烂或溃疡有关,多数患者无明显症状,在内镜检查时发现,病程3 d~2年。
IFP典型的病理特征为CD34染色梭形细胞的存在,血管网、纤维黏液样基质和炎性细胞浸润,通常富含嗜酸性粒细胞,超过1/2的病例中出现血管周围梭形细胞“洋葱皮样”结构[5-6]。IFP最常见的是波形蛋白(Vimentin)和CD34阳性,S-100、CD117和结蛋白(Desmin)阴性[5, 7-8]。本组病例中,100% Vimentin阳性,90.91% CD34阳性,100% CD117阴性,100% S-100阴性,与文献报道一致。100% Ki67呈低增殖,阳性指数1%~5%,提示预后好。
普通内镜下IFP呈息肉样隆起,向腔内突出,表面可伴有糜烂或溃疡,EUS显示病灶多起源于黏膜肌层或黏膜下层,部分可达固有肌层,但不会突破浆膜层,呈低回声或混合回声改变,边界欠清。结合普通内镜及EUS特点,可初步做出IFP诊断,但需与胃肠道间质瘤(GIST)、平滑肌瘤、平滑肌肉瘤、神经鞘瘤和炎性肌纤维母细胞瘤相鉴别[6,8]。通过本组病例内镜下特征分析,诊断价值有限,主要还是通过免疫组织化学染色来明确诊断。
目前,IFP发病机制尚不清楚。既往研究者认为,该病与感染、炎症修复、创伤、刺激等有关[9]。近年来研究发现,抗幽门螺杆菌治疗后IFP组织形态学发生改变,提示幽门螺杆菌可能参与了IPF的病理生理过程[10]。本组4例患者进行了幽门螺杆菌检测,发现3例阳性,可能从侧面也证实了这一点。另外,有学者研究发现[11],有胃肠道息肉家族史的患者更容易发生IFP。本组所有病例均无胃肠道息肉家族史,可能与样本量小有一定关系。然而,最近的一项涉及IFP的基因研究中,70%的病例中存在血小板衍生生长因子受体-α(platelet-derived growth factor receptor alpha, PDGFR-α)基因的激活突变[12]。该证据表明,PDGFR-α基因的激活突变可能才是真正驱动IFP发生的关键因素。
IFP的治疗策略可以与其他良性胃肠息肉相似,由于病灶多单发且较小,采用内镜微创治疗能取得较好效果,术后行病理分析可以明确诊断并排除任何恶性肿瘤的可能。本组22例IFP患者,2例行外科手术治疗,其中1例为小肠IFP合并右半结肠腺癌,另1例为胃巨大IFP,术前怀疑恶变。其余20例行内镜微创治疗,包括ESD、EMR、高频电凝电切术。仅1例起源于胃固有肌层的IFP行ESD出现术中出血,量约150 ml,内镜下止血成功,其余患者均未发生术中及术后迟发型出血、穿孔等并发症,随访4~38个月,失访2例,死亡1例(非IFP引起),有效回访患者均未出现复发,提示预后良好。目前仅有1例IFP切除术后复发的报道[13],无关于IFP侵袭性生长或侵袭性转移扩散的证据。因此,不建议对术后和无症状患者进行常规内镜随访[14]。

