超声内镜下细针穿刺术对胰腺囊性神经内分泌肿瘤的诊断价值
王慧 李楠 张艺璇 吕瑛
南京大学医学院附属鼓楼医院消化内科,南京 210008
【提要】 回顾性分析14例病理确诊为胰腺囊性神经内分泌肿瘤(cPNETs)患者的EUS影像特征及EUS-FNA检查结果。结果显示,14例cPNETs患者EUS声像图多为囊实性结构,表现为厚壁、低回声、有分隔、无壁结节,且均与周围界清。3例超声造影均为高增强影。单独依靠EUS肿瘤检出率为35.7%,单独EUS-FNA检出率为69.2%,EUS镜下表现结合FNA检出率为78.6%。提示cPNETs的EUS声像图具有一定的特征,但需结合FNA检查结果增加肿瘤检出率。
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors, PNETs)是一种少见肿瘤,占胰腺恶性肿瘤的5%左右[1]。随着CT、MRI等影像技术及内镜技术的发展,其检出率逐年上升[2-6]。PNETs大部分为实性病变,囊性PNETs(cystic pancreatic neuroendocrine tumors, cPNETs)仅占7%~17%[7-14]。由于cPNETs无特征性临床表现且发病率低,依靠CT、MRI等影像手段检测难以与其他胰腺囊性病变相区别,出现较多的漏诊、误诊,延误病情。EUS是一种可在消化道管腔内近距离动态扫描胰腺组织并显示其细微结构的技术,目前认为是判断胰腺囊性病变良恶性的最好方法。本研究拟总结cPNETs在EUS下的特征,探讨EUS-FNA对cPNETs的诊断价值。
一、资料与方法
1.研究对象:收集 2014年10月至2019年10月间南京大学医学院附属鼓楼医院收治的14例经病理证实的 cPNETs患者,其中男性7例,女性7例,年龄45~80岁,中位年龄61.5岁。纳入标准:(1)均行EUS检查,报告描述详尽完整;(2)内镜下或外科手术证实存在囊性胰腺病灶;(3)行EUS检查前未经消融及外科手术等治疗;(4)病历资料完整。
2.EUS检查: 选用Olympus GF UTC260 EUS和Wilson Cook Echo 22G EUS穿刺针,观察从十二指肠乳头至胃体整个胰腺及胰周的非连续切面。在EUS引导下避开血管等重要结构,选择最合适穿刺路径穿刺、固定、负压吸引、反复抽吸,将组织条进行组织学及细胞学检查。
3.监测指标:收集患者的临床信息,包括性别、年龄、症状、WHO分级、确诊方式,EUS下表现包括肿瘤直径、回声、均匀性、囊壁厚度、壁结节、分隔、囊性占比及EUS-FNA检查结果。PNETs分级参照WHO 2017分级指南标准[15]:G1级,核分裂象<2个/10个高倍视野或Ki-67<3%;G2级,核分裂象2~20个/10个高倍视野或Ki-67 3%~20%;G3级,核分裂象>20个/10个高倍视野或Ki-67>20%。
4.统计学处理:采用SPSS 25.0软件进行统计学分析,计数资料组间比较采用chi-square检验或Fisher确切概率法。P<0.05为差异有统计学意义。
二、结果
1.患者一般情况:14例cPNETs患者中,3例临床表现为腹部胀痛,1例表现为进行性皮肤巩膜黄染,1例食欲减退伴消瘦,其余9例为体检发现。14例患者中仅1例血清淀粉酶升高。CA19-9、CEA等肿瘤标志物均正常。G1级8例, G2级6例。13例患者于鼓楼医院手术后确诊,1例于外院手术后确诊。
2.cPNETs的EUS影像特征:病灶最大直径为780 mm,最小直径仅13 mm,平均直径为35.9 mm。9例(64.3%)肿瘤发生在胰体、尾,5例(35.7%)发生在胰头或钩突。14例多呈低回声(11/14)或无回声(2/14),除1例外均回声较均匀(13/14),边界清晰(14/14),形态多较规则(13/14)。14例患者中11例患者厚壁,4例有壁结节,9例有分隔。总的来说,厚壁有分隔的为7例,其中仅2例有壁结节;厚壁无分隔的为4例,其中仅1例有壁结节;薄壁有分隔的为2例,有无壁结节各占1例;剩余1例为薄壁无分隔无壁结节。
14例患者根据EUS表现,5例诊断为cPNETs,1例考虑癌症可能,2例考虑浆液性囊腺瘤,6例无法明确诊断。单独采用EUS检出率为35.7%(5/14)。
3.cPNETs的谐波造影增强超声内镜(contrast-enhanced harmonic EUS, CH-EUS)表现:14例患者中仅3例接受CH-EUS检查,均表现为囊壁及结节强化,病灶为高增强影,提示恶性可能性大。
4.cPNETs的EUS-FNA检查结果:14例cPNETs患者中,13例接受EUS-FNA检查,病理结果证实9例为cPNETs,检出率为69.2%(9/13)。1例EUS影像学表现为cPNETs可能性大,经外科手术切除病理确诊为cPNETs。11例经EUS结合FNA穿刺病理确诊,检出率为78.6%。
5.cPNETs分级与EUS表现的相关性:6例G2级病例中厚壁者占5例,仅1例既无壁结节也无分隔;1例薄壁者既有分隔也有壁结节。8例G1级病例中6例为厚壁,其中3例存在分隔但无壁结节,1例存在壁结节但无分隔,1例既有分隔也有壁结节,1例两者皆无;2例薄壁者1例有分隔但无壁结节,1例两者皆无。chi-square检验分析cPNETs肿瘤分级与患者性别、年龄、症状及EUS下表现均无相关性(表1)。
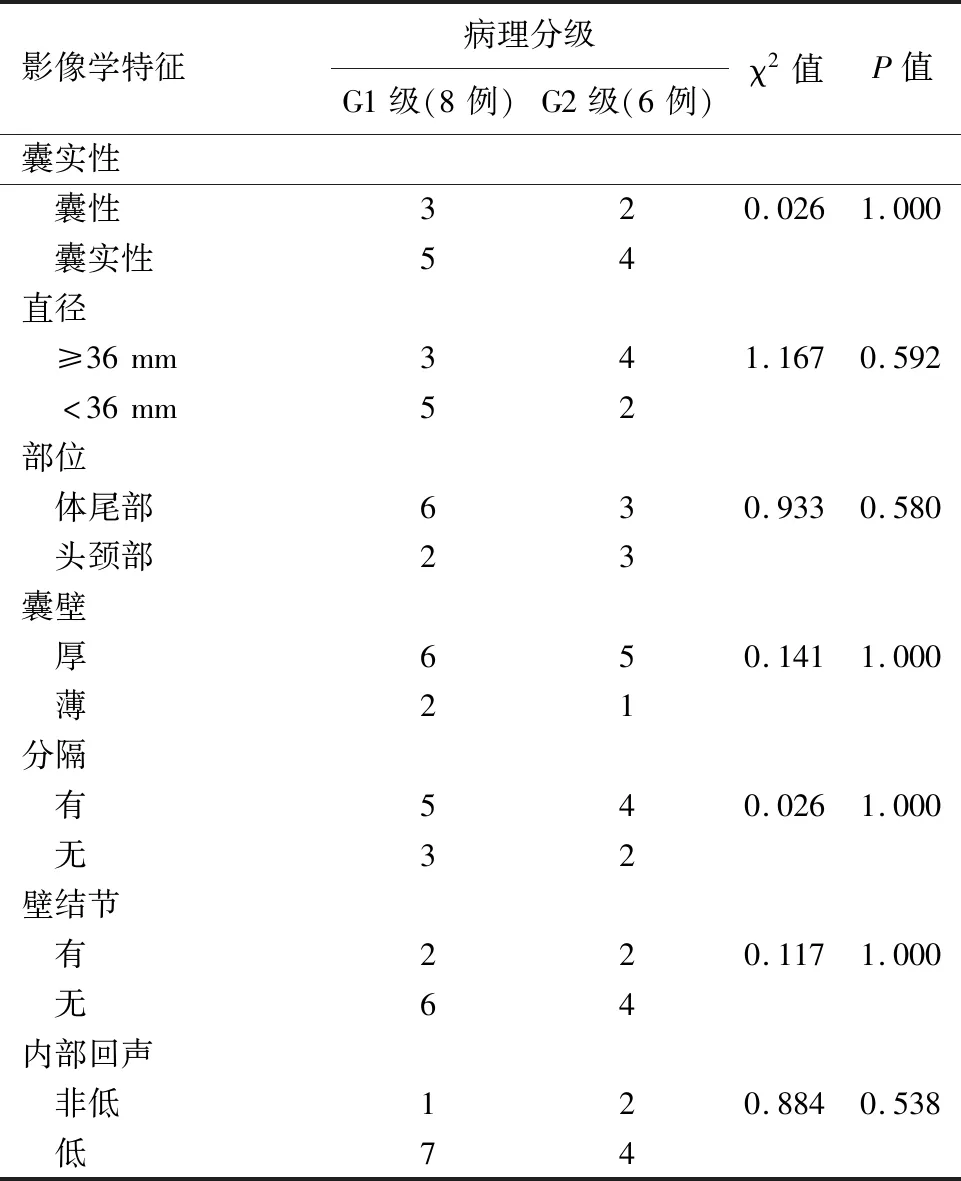
表1 14例不同病理分级cPNETs的内镜超声影像学特征
讨论PNETs起源于胰腺导管上皮多功能干细胞,是一种少见肿瘤,发病率约为0.4/100 000[16]。根据影像学特征PNETs分为囊性和实性两种,多数研究认为囊性PNETs相较于实性PNETs侵袭性低。临床上多认为cPNETs为非功能性肿瘤,与多发性内分泌肿瘤1型密切相关[4-13],但不乏胰岛素瘤、胃泌素瘤等cPNETs的报道[2]。2015年一篇荟萃分析提示EUS相较于CT、MRI等更易检出PNETs,但未单独就cPNETs进行分析比较[17],而Mitra等[5]研究结果显示EUS结合细胞学检查诊断灵敏度高达70%,远高于单用EUS(30%)或CT、MRI(10%)。本研究筛选出14例符合条件的cPNETs患者,男女比例各半,中位年龄为61.5岁,5例有临床症状,其中21.4%表现为腹痛。本组大多数患者血清淀粉酶及肿瘤指标CEA、CA19-9较低,仅1例血清淀粉酶稍高。14例患者中仅2例为胰岛细胞瘤并表现出内分泌症状。
荟萃分析[17]指出囊实性PNETs在肿块部位、功能、淋巴结转移、WHO分级及Ki-67指数中存在显著差异。囊性大多存在于体尾部,为无功能性,WHO分级良性或不典型病变较多见,Ki67指数较低(<2%)且淋巴结转移较少见,恶性可能较低。本组中42.3%的患者为G2级,仍存在恶变可能;64.3%的cPNETs位于体尾部,与上述结论一致。
cPNETs多呈类圆形或椭圆形,边界多清晰,存在囊实性混合。本组14例患者EUS显示大多数肿瘤为囊实性混合,单纯囊性只占35.7%。对于其囊实性病变形成的机制尚不清楚,目前主要有两种假说:一是认为PNETs的纤维囊包裹使得组织血供不足而坏死形成囊肿;一是认为PNETs本身是高血管性肿瘤,可能因病灶内出血诱发囊性病变[13]。这两种假说都认为囊性是由实性进展而来的,即囊实性PNETs是同一种来源的肿瘤。本研究中发现与实性PNETs相比,cPNETs多位于胰腺远端而非胰头,多无临床症状,无淋巴结及远处转移,病理结果上并无外周及血管浸润,Ki67数值较低,均提示囊性并非实性进展而来。
本组患者EUS下大部分表现为厚壁(78.6%)、低回声(78.6%)、有分隔(64.3%)、无壁结节(71.4%)且与周围界清,但无与其他胰腺囊性肿瘤相鉴别的特征性表现。多个病例报道同样证实因为缺乏足够的特征性表现,仅通过影像学或EUS检查很难准确对cPNETs术前诊断[6]。本研究也未发现肿瘤WHO分级与cPNETs的EUS特征有相关性。EUS-FNA可以获得病变及周围组织进行细胞学及组织学检查,有助于诊断微囊性肿瘤。CH-EUS可以通过判断囊壁性质帮助鉴别囊肿良恶性[18]。本组3例行CH-EUS,均为高增强影,可与胰腺癌类乏血供肿瘤相鉴别,但患者数量较少,统计学意义不大。鉴于单靠EUS镜下表现不能准确诊断cPNETs,而结合EUS-FNA检查其检出率达到78.6%,提示EUS镜下表现结合FNA检查可以更好地检出cPNETs。
利益冲突所有作者均声明不存在利益冲突

