miR-365对乳头状甲状腺癌TPC-1细胞增殖和侵袭的抑制作用
靳彤 白晓雪 崔现
(1吉林省肿瘤医院甲状腺微创外科,吉林 长春 130000;吉林大学第一医院 2干部病房;3延边大学附属医院肿瘤科)
甲状腺癌是内分泌恶性肿瘤中最常见的类型,近年来发病率逐渐上升。在甲状腺癌中,乳头状甲状腺癌约占80%。尽管乳头状甲状腺癌患者的5年生存率超过95%,但其容易发生转移,可以扩散到淋巴结或远处的组织中〔1〕。乳头状甲状腺癌的常规治疗有激素治疗、外科手术及放射性碘消融治疗,但这些方法对转移性病灶无效。因此,迫切需要寻找新型的治疗药物或者药物靶点。微小RNA(miR)是一类内源性的小RNA分子,在人类疾病中起到了重要的调控作用〔2〕。既往研究显示,miR-365在乳头状甲状腺癌中表达低于正常组织〔3〕,但其在乳头状甲状腺癌生物学功能方面的作用尚未清楚。本研究探讨miR-365在体外对乳头状甲状腺癌细胞系TPC-1细胞的增殖、转移和侵袭性的影响。
1 材料与方法
1.1实验细胞 人的正常甲状腺细胞系NTHY-ORI 3-1细胞和人乳头状甲状腺癌细胞系TPC-1细胞购买自ATCC公司,培养基为10%胎牛血清的 DMEM 完全培养基,培养于37℃含5%CO2的培养箱中,每3天传代或换液1次。
1.2主要试剂和仪器 高糖DMEM培养基购自Hyclone公司,胎牛血清(FBS)购自BI公司,CCK-8试剂购自碧云天科技有限公司,逆转录试剂盒和SYBR Green PCR预混液购自于莫纳公司。TRIzol购自Invitrogen公司,miR-365 mimic和miR-365抑制剂(inhibitor)及两者的阴性对照mimic control和inhibitor control均购自广州锐博。
1.3实验方法
1.3.1实时荧光定量聚合酶链反应(qRT-PCR) 弃去细胞培养基,用磷酸盐缓冲液(PBS)洗后根据细胞量加入TRIzol,三氯甲烷抽提,异丙醇沉淀后提取细胞总RNA,cDNA的合成为20 ng总RNA逆转录。SYBR Green qPCR Supermix与2.5 μl cDNA、1 μl miR-365特异性引物混合后在伯乐实时定量PCR仪中进行测定。以U6为内参,采用2-△△CT值的方式定量细胞中miR-365的表达。
1.3.2细胞活性检测 消化TPC-1细胞后,培养基重悬制成单细胞悬液。然后将细胞种植于96孔板中,每孔2 000个细胞。待第二天每孔加20 μl CCK溶液,细胞继续培养1~4 h。将细胞培养板放入酶标仪,设定波长在450 nm处检测孔中的光学密度(OD)值。
1.3.3细胞划痕试验 消化TPC-1细胞后,培养基重悬制成单细胞悬液。然后将细胞种植于6孔板中,每孔1×106个。待第二天细胞长满后,用200 μl移液头垂直于细胞培养板底,划一条直线。用1倍PBS清洗细胞培养板,洗去划下来的细胞。然后加入无FBS的培养基,将细胞放入37℃、5%CO2培养箱中培养。培养时间为0 h、24 h和48 h,倒置显微镜下拍照。愈合率的计算公式为,细胞划痕的初始宽度减去划痕的目前宽度然后除以划痕的初始宽度,得出的小数换算成百分比。
1.3.4Transwell实验 在Chamber上室底部中央垂直加入100 μl 溶解的基底膜基质,37℃温育4~5 h使其干成胶状,将TPC-1细胞转染后用无血清培养基重悬制成单细胞悬液。下室加入600~800 μl 含不同浓度血清的培养基,上室加入100~150 μl 细胞悬液,培养24 h后用800 μl 甲醇固定,800 μl 结晶紫染色,轻轻用清水冲洗数次,用用棉棒小心擦拭Transwell室底部膜表面,去除膜上的TPC-1细胞。用镊子取下室底膜。在阴凉避光处晾干后,放置在载玻片上,通过中性树胶封片,在正置显微镜下对膜上的细胞进行拍照并随机取6个视野计数细胞。
1.4统计学方法 采用GraphPad Prism7.0软件进行方差分析及q检验。
2 结 果
2.1miR-365在TPC-1细胞中的表达 TPC-1细胞株中miR-365水平(0.37±0.06)明显低于NTHY-ORI 3-1细胞(1.00±0.22,P<0.01)。
2.2miR-365对TPC-1细胞增殖能力的影响 与空白组和对照组比较,miR-365 mimic可明显降低TPC-1细胞的增殖率(P<0.01)。相反,miR-365 inhibitor可明显增加TPC-1细胞的增殖率(P<0.01),miR-365可以调节TPC-1细胞的增殖能力,见表1。
2.3miR-365对TPC-1细胞迁移的影响 miR-365转染后24 h的TPC-1细胞的迁移能力下降,表现为miR-365 mimic组的划痕修复率明显低于空白组与对照组(P<0.01)。然而,转染miR-365 inhibitor后,TPC-1细胞的迁移能力提高,表现为miR-365 mimic组的划痕修复率明显高于空白组与对照组(P<0.05),miR-365能显著抑制TPC-1细胞的体外迁移能力。见表1。
2.4miR-365对TPC-1细胞体外侵袭能力的影响 miR-365转染后24 h的TPC-1细胞的侵袭能力下降与后,表现为miR-365mimic组的小室膜下的细胞数目明显低于对照组(P<0.01)。然而,转染miR-365 inhibitor后,TPC-1细胞的侵袭能力提高,表现为miR-365 mimic组的小室膜下的细胞数目明显高于对照组(P<0.01),miR-365能显著抑制TPC-1细胞的体外侵袭能力。见表1。
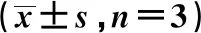
表1 miR-365 对TPC-1 细胞增殖、迁移及侵袭能力的影响
3 讨 论
miR是长约22个核苷酸的小RNA分子,通过与靶基因mRNA的3'非翻译区(UTR)结合负调节基因表达,从而抑制或破坏转录本翻译〔4〕。 研究表明miR参与许多不同的生理和病理过程,如细胞增殖、细胞周期、分化及凋亡〔5〕。据报道,miR在肿瘤的发生、发展和进展中发挥着重要的作用,并且在各种癌症中起着肿瘤抑制剂或致癌基因的作用〔6,7〕。既往研究发现一系列致癌和抑制肿瘤的miR,参与人类乳头状甲状腺癌的发生和发展,这表明miR可以作为乳头状甲状腺癌的诊断标志物和治疗药物〔8~10〕。miR-365位于染色体区域16p13.12。miR-365在各种癌症类型中的表达是不同的。miR-365在皮肤鳞状细胞癌中高表达〔11〕。但有报道miR-365在乳头状甲状腺癌组织中呈低表达〔3〕。本研究结果与以往的研究结论一致,提示miR-365可能对乳头状甲状腺癌的增殖、抗凋亡及转移等生物学行为有着重要的调控作用。已发现miR-365在肝癌中低表达,并通过直接靶向抗凋亡蛋白Bcl2发挥诱导肝癌细胞凋亡的作用〔12〕。另外,发现结肠癌中miR-365水平降低,并且miR-365表达的恢复抑制了细胞周期进程,促进了5-氟尿嘧啶诱导的结肠癌细胞系中细胞凋亡和抑制肿瘤生长〔13〕。然而,miR-365在调控乳头状甲状腺癌细胞生长和转移过程中的作用尚不清楚。本研究结果表明miR-365对TPC-1细胞体外增殖、迁移和侵袭能力具有明显的抑制效应。综上,本研究表明,miR-365在乳头状甲状腺癌细胞中表达下调,体外过表达可明显抑制TPC-1细胞体外增殖、迁移和侵袭能力。miR-365有望为设计乳头状甲状腺癌的新型治疗药物提供理论依据,为乳头状甲状腺癌的诊断和治疗提供新的见解。

