血管内皮生长因子过表达骨髓间充质干细胞对支气管肺发育不良的保护作用
蓝国锋 王艺瑾 黎云芳 韦清华 石丰浪 崔其亮 Hussnain Mirza 史学凯
1广西南宁市第二人民医院新生儿科(南宁530031);2广州医科大学附属第三医院儿科(广州510150);3美国佛罗里达儿童医院儿科(USA)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿(尤其是小早产儿)常见的慢性呼吸系统疾病。胎龄<32 周的早产儿中,BPD 发生率为12%~32%[1],超低出生体重儿(出生体质量<1 000 g)与极早早产儿(胎龄<28 周)BPD 发生率高达50%[2],但是BPD 在临床上缺乏有效的治疗手段[3],严重影响BPD 患儿的预后及生存质量。
BPD 临床上常表现为肺泡发育不良、肺泡数量减少、肺泡简单化和微血管发育异常等症状[4]。流行病学研究[5]显示,BPD 的发生过程复杂,是多种因素共同作用的结果。血管内皮生长因子(vascular endothelial growth factor,VEGF)作为血管发生方面的核心因子[6],其表达水平影响着肺血管发育,进而影响BPD 的发生发展[7]。VEGF 主要由肺泡上皮细胞产生,对内皮细胞的迁徙、生存、增殖和分化起着关键作用,是整个胚胎期、胎儿期和出生后肺血管生长与维持最关键的调节因子[8],其缺少可影响胎儿肺微血管系统的形成,导致微血管床密度减低、肺泡简单化,使正常肺泡的发育受阻[9],从而增加新生儿BPD 的发生率。VEGF 在维持肺部正常发育过程中起着关键的作用。已有研究[10-11]表明干细胞可以有效阻止BPD的发展进程。
为探索VEGF 改善BPD 的作用及其机制,本研究构建了过表达VEGF 基因的骨髓间充质干细胞(BMSC-VEGF)。在动物BPD 模型中,检测其对于维持肺部血管形成和肺泡细胞正常生长的作用以及作用机制。现报道如下。
1 材料与方法
1.1 高氧诱导小鼠BPD模型构建将9只新生FVB小鼠幼仔与2 只母鼠(购自北京维通利华)暴露于75%氧气有机玻璃室或出生时的室内空气中,并持续饲养14 d。通过氧浓度控制装置(Biospherix,Lacona,N.Y.)调节通气并保持室内75%氧浓度,同时除去CO2,使其含量不超过0.5%。通过空气净化器和活性炭过滤氨。每隔48 h 置换常氧母鼠和高氧母鼠,以防止母鼠氧气中毒。
高氧组:FVB 小鼠幼仔从出生后第1 天(出生6 h 内)在75%氧气条件下进行饲养,持续2 周;常氧组:FVB 小鼠幼仔从出生时,饲养在室内空气中,持续2 周。在第14 天,当BPD 模型中慢性高氧肺损伤明显时[12],将小鼠置于室内空气中,高氧组随机分为3 组:高氧模型组、高氧模型+NC 组及高氧模型+VEGF 组。常氧组与高氧模型组置于室内空气中饲养2 周;高氧模型+NC 组静脉内/肌肉注射含有对照的BMSCs 细胞,高氧模型+VEGF 组静脉内/肌肉注射含有VEGF 过表达载体的BMSCs 细胞,置于室内空气中继续饲养2 周。各组小鼠幼仔恢复两周后,水合氯醛麻醉处死,收集肺组织用于如下所述的组织学和免疫组织化学研究。所有动物实验均获得广西南宁市第二人民医院伦理委员会动物护理和使用批准(2017-10-08)。
1.2 BMSCs 分离、培养、分化和免疫荧光鉴定从5~7 周大的FVB 小鼠的股骨和胫骨中原代分离BMSCs 细胞[10]。然后,将BMSCs 细胞离心、浓缩并铺板。每2~3 天更换1 次BMSCs 条件培养基。传2~3 代后,选取状况良好的细胞进行后续实验。
以上BMSCs 用胰酶消化,PBS 洗涤2 次,再通过免疫荧光检测BMSCs 的表面标志蛋白CD44、CD106 的表达。其过程为:细胞爬片制作,抗原修复、封闭,一抗4 ℃孵育过夜,CD44 一抗(兔抗小鼠,abcam,货号:ab157107)1∶1 000 稀释;CD106 一抗(兔抗小鼠,CST,货号:39036)1∶400 稀释。荧光二抗室温避光孵育30 min。DAPI 复染,洗涤,封片,镜检,最后分析。
1.3 VEGF 过表达BMSCs 构建通过合成VEGF序列(来自NCBI,XM_021581441),构建慢病毒载体,再通过病毒包装与纯化,滴度检测,最后慢病毒感染BMSCs 细胞,得到VEGF 过表达慢病毒稳转的BMSCs 细胞。RT-PCR 检测BMSCs 细胞VEGF基因的表达,验证过表达效率。
1.4 静脉注射VEGF-BMSCs 和条件培养基第14天向高氧模型+VEGF组静脉注射VEGF-BMSCs,常氧组与高氧模型注射等剂量的条件培养基,而高氧模型+NC 组注射等剂量的NC+BMSCs。
1.5 肺呼吸阻力检测为了评估幼鼠肺呼吸阻力,使用超声雾化器(Scireq,Montreal,Canada)将生理盐水和吸入乙酰甲胆碱(1.6、5、10、16 和50 mg/mL)雾化。在基线时计算平均气道阻力,吸入每次剂量的乙酰甲胆碱之后记录最大值。
1.6 Masson Trichrome 染色通过Masson Trichrome染色肺泡组织。首先肺泡细胞脱水、包埋,制作石蜡切片。苏木精核染15 min,丽春红酸性染液染色10 min,磷钼酸溶液处理5 min,再苯胺染液复染5 min,多次脱水,最终封片,分析各组肺泡组织纤维化及肺泡重构情况。
1.7 Western blot 实验蛋白质免疫印迹方法检测增殖相关蛋白Ki67 的表达。提取肺组织总蛋白,BCA 法标准曲线测定总蛋白含量,通过SDSPAGE 电泳,半干转印蛋白,室温封闭60 min,Ki67一抗[兔抗小鼠,CST(#12202)]1∶1 000 稀释,4 ℃孵育过夜;羊抗兔二抗孵育,室温孵育1.5 h,成像,图片扫描后应用Image-ProPlus Version 6.0 图像分析软件对蛋白免疫印迹灰度值进行定量分析。目的蛋白灰度值/内参蛋白灰度值表示蛋白质相对表达水平。
1.8 统计学方法采用SPSS 17.0(SPPS,Inc.)对数据进行统计学分析,多组间数据进行比较采用单因素方差分析(ANOVA),两组数据进行比较采用t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 BMSCs 鉴定通过免疫荧光的方法检测分离的BMSCs 表面标志物CD44 和CD106 的表达。在BMSCs中CD44和CD106的表达均为阳性(图1),这与以往的研究结果一致[13]。提示分离的BMSCs满足后续实验要求。

图1 免疫荧光法检测分析CD44、CD106 表达Fig.1 The expression of CD44 and CD106 was detected by immunofluorescence
2.2 RT-PCR检测BMSCs细胞VEGF基因表达通过RT-PCR 检测BMSCs-VEGF 的VEGF 表达情况,以验证VEGF 过表达效率。从图2 可以发现,VEGF 过表达组其表达量是(80.85±6.71),对照组及空载组分别为(0.98±0.04)、(1.06±0.08),相差80 倍左右,差异有统计学意义(P<0.01),提示慢病毒可以有效感染BMSCs 细胞并表达VEGF。
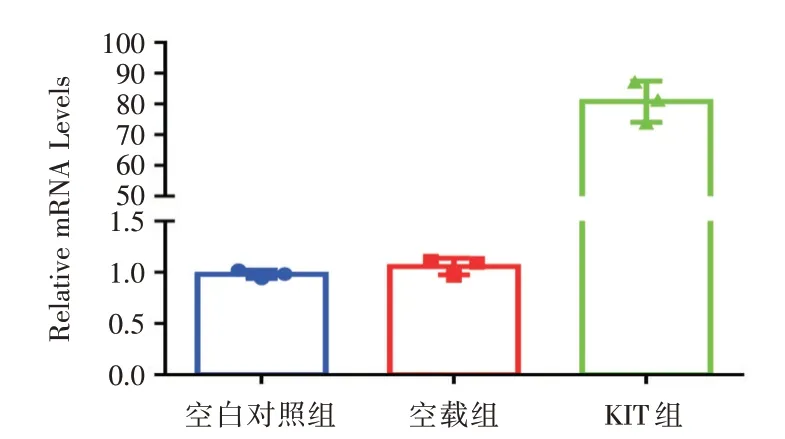
图2 VEGF 在各组中基因表达量Fig.2 VEGF expression in each group
2.3 BMSCs-VEGF 可以改善BPD 幼鼠肺泡重构、肺纤维化相比健康对照幼鼠,暴露于高氧条件下2 周的幼鼠,恢复期间以单剂量给予BMSCs 条件培养基的高氧组,其肺泡整体结构发生严重改变:气管严重变形、肺泡简单化、气道重塑、严重炎性细胞浸润以及肺细胞胶原含量增高和严重肺纤维化。高氧2 周后,注射BMSCs-VEGF 恢复2 周的VEGF 组,相比高氧组幼鼠,其肺泡结构得到明显的改善,肺纤维化程度显著降低,胶原含量明显减少,肺泡化丰富而有序,气管结构恢复。如图3所示,其肺结构功能趋于正常健康常氧幼鼠。说明高氧诱导的BPD 幼鼠给予静脉注射BMSCs-VEGF 可以显著地改善其肺泡结构异变。
2.4 BMSCs-VEGF可调节CD31、TGF-β、COLⅡ、COLⅤ蛋白的表达为研究BPD 幼鼠静脉注射BMSCs-VEGF 后对其肺组织细胞增殖、肺内血管形成及肺纤维化的机制,Western bolt 方法检测细胞增殖相关蛋白Ki67 的表达,结果显示,注射BMSCs-VEGF 后,Ki67 蛋白水平显著上调,趋于正常小鼠肺组织中Ki67 蛋白水平,如图4所示。通过IHC检测血管形成相关蛋白CD31 及纤维化相关蛋白TGF-β、COLⅡ、COLⅤ的表达。结果显示,高氧组及VECTOR+高氧组相比于正常对照组,其血管形成相关蛋白CD31 表达极低,而纤维化相关蛋白TGF-β、COLⅡ、COLⅤ均显著高表达。注射BMSCs-VEGF 后的高氧组,CD31 蛋白表达有所上升且与正常对照组表达相似,而TGF-β、COLⅡ、COLⅤ的表达均显著下调,且与正常对照组相比,差异无统计学意义,这与已有研究一致[13]。

图3 肺切片染色检测肺泡重构(Masson Trichrome 染色,×400)Fig.3 Determination of alveolar remodeling by Masson′s trichrome staining(Masson Trishrome,×400)
3 讨论
BPD 是一种肺泡和肺内血管发育受阻引起的持续性呼吸窘迫慢性肺部疾病,是小早产儿呼吸系统常见疾病,也是早产儿死亡的最主要原因[14]。BPD 常表现为:肺泡简单化改变,减少异常肺泡微血管发育和早期肺的重塑[15]。本研究结果显示给予BPD 模型幼鼠静脉注射BMSCs-VEGF 可以有效阻止肺泡单一化,并遏制肺内血管减少,抑制无序异常的肺重塑,从而改善早产幼鼠支气管肺发育不良。临床上BPD 常见于早产儿呼吸窘迫及机械通气后,存活者常有肺功能障碍[16]。在此期间,还将反复发生肺炎、肺不张、支气管痉挛引起的一系列并发症[16]。本研究提示,支气管肺发育不良及恢复期间,若给予早产儿静脉注射BMSCs-VEGF,或将缓解支气管肺异常发育,降低肺炎等并发症的产生。尽管随着机械通气等治疗BPD水平的提高,使早产儿存活率显著提高,但BPD 发生率依旧呈逐年增加趋势,严重影响早产儿存活率和生存质量,给家庭和社会带来巨大经济负担和损失[17]。
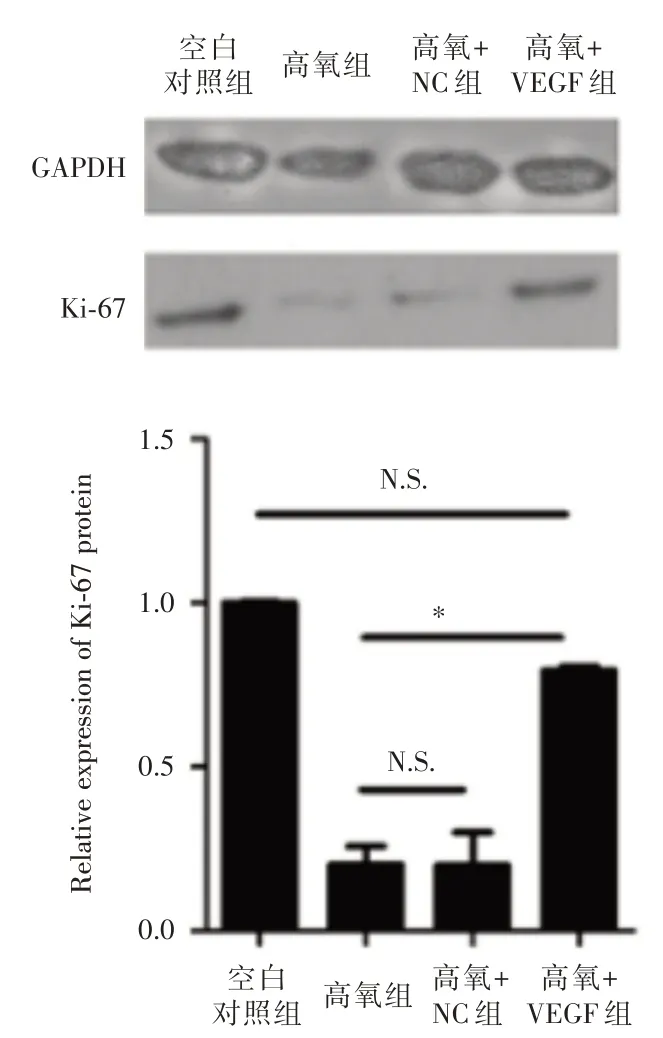
图4 CD31、TGF-β、COLⅡ、COLⅤ在各组中的表达Fig.4 CD31、TGF-β、COLⅡ、COLⅤexpression in each group
动物和临床试验研究表明,干细胞疗法可调节疾病标志物,并且可能在组织/器官再生中发挥有效作用[18]。BMSCs 已被证明可有效修复心脏和肺部疾病,如心肌梗死[19]、肺纤维化和肺损伤[20]。小鼠[10]和大鼠[21]或人脐带血来源的BMSCs,以预防方式静脉注射时[22],已被证明可改善高氧诱导的BPD 啮齿动物模型的肺结构。
本研究采用高氧诱导新生鼠BPD模型,符合早产儿BPD 的病理生理发生、发展过程[23]。75%高氧是目前研究动物高氧肺损伤常用的浓度,短期可造成慢性肺损伤,2 周给氧可导致BPD 发生[24]。本研究显示,幼鼠吸氧2 周后,出现肺泡结构简单化、肺内血管数目明显减少、肺纤维化、肺泡化停滞单一等现象。有研究表明[1]肺发育过程中血管新生是肺泡分化所必需的,肺泡分化与血管扩张直接联系,同步作用可形成有效的气血屏障[25]。而早产且联合治疗可使肺泡和肺血管发育进程中断,导致肺泡发育受阻、肺泡和毛细血管数量的减少,最终使气血交换面积减少,VEGF 主要作用于血管形成早期,促进原始血管网形成[26]。本研究表明,给予高氧诱导BPD 模型幼鼠静脉注射BMSCs-VEGF 后,可以明显阻止肺内血管减少,且这种效应是通过阻止CD31 蛋白表达调控实现的。CHOU 等[27]研究发现,BPD 肺发育和纤维化伴随VEGF 表达的减少。而对其给予人源MSCs 可以改善缺陷性肺泡化,增加肺血管密度,减少肺纤维化,同时伴随VEGF 表达的上调。DAO 等[28]在BPD 小鼠左肺切除的模型中,给予VEGF 观察,发现实质肺体积、肺泡体积扩大且肺泡数增加,进而促进小鼠肺发育。在BPD 早产兔模型中,研究者[29]通过羊水干细胞介导VEGF 治疗,发现VEGF同样可以减轻其肺损伤。此外,临床病例对照研究发现[30],BPD 早产儿VEGF 的表达水平相比健康正常幼儿是显著增高的。本研究则通过给予高氧诱导BPD 模型幼鼠静脉注射BMSCs-VEGF 后,发现肺组织结构得到良好改善,降低了幼鼠肺呼吸阻力。肺结构的改善是通过调控Ki67、CD31、TGF-β、COLⅡ、COLⅤ蛋白表达的分子机制来实现的,通过Ki67 蛋白表达显著上调促进肺细胞增殖,阻止CD31 蛋白表达进而遏制血管形成,降低TGF-β、COLⅡ、COLⅤ蛋白表达从而降低肺纤维化,最终改善支气管肺不良发育。从而证实,BMSCs-VEGF 治疗可以有效改善高氧诱导BPD 幼鼠的肺部情况,BMSCs-VEGF 治疗或可成为临床治疗BPD 早产儿新型有效手段。
本研究阐述了给予静脉注射BMSCs-VEGF 对BPD 幼鼠肺功能的改善作用,而其具体机制需要在随后的研究中进一步探索。此外,BMSCs 衍生的干预措施似乎是一种很有前途的治疗手段,适用于BPD、肺动脉高压和其他慢性肺部疾病[21],应在未来的临床试验中进行调查。尽管本研究存在样本量少的问题,但结果显示过表达VEGF 对BPD 肺功能的保护作用,提示VEGF 有望成为治疗BPD的候选药物之一。

