血清TNF-α NSE MCP-1联合检测对脓毒症相关性脑病早期诊断价值
蒙振发, 李以萍, 谭德敏, 陈绵军, 陈 军
(海南省儋州市人民医院, 海南 儋州 571700)
脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)是脓毒症常见并发症之一,由感染引起全身炎症进一步引发的弥漫性大脑功能障碍[1]。SAE临床表现各异,且是重症监护室(ICU)中病死率较高的疾病[2]。因此临床上寻找快速检测指标用于早期诊断,对降低SAE发生率有重要意义。肿瘤坏死因子-α(TNF-α)是脓毒症发病过程中重要影响促炎症细胞因子,参与SAE炎症反应,能影响炎症细胞的释放及炎性递质的生成,研究表明血清TNF-α水平可作为早期诊断和治疗脓毒症的指标[3]。神经元特异性烯醇化酶(neuron-specific enolase,NSE)是用于卒中、脑损伤、缺血缺氧性脑病诊断的生化指标,且有研究表明NSE能预测浓度正相关脑病的发生[4]。单核细胞炎性蛋白-1(monocyte inflammatory protein-1,MCP-1)与脑组织损伤密切相关,可通过趋化T淋巴细胞间接引起中性白细胞聚集,产生的炎症介质可加重脑组织损伤[5]。TNF-α、NSE、MCP-1水平均与脓毒症或脑病发生有密切联系,但是关于TNF-α、NSE、MCP-1在SAE早期诊断中的研究较少。因此,本研究通过检测SAE患者血清中TNF-α、NSE、MCP-1水平,探讨TNF-α、NSE、MCP-1在SAE早期诊断中的应用价值。以期为SAE早期临床诊断和预防开辟新思路,同时配合积极治疗降低SAE疾病发生率。
1 资料与方法
1.1一般资料:选取2016年7月至2019年9月本院接收的脓毒症患者178例作为研究对象,其中未合并相关性脑病患者82例(脓毒症组),年龄42~80岁,平均(60.32±17.38)岁;男43例,女39例;合并相关性脑病患者96例(SAE组),年龄42~80岁,平均(59.54±17.36)岁;男42例,女54例。两组患者年龄、性别比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》中的相关诊断标准[6],SAE诊断符合ICU意识模糊评估法(CAM-ICU)[7];②临床资料记录清晰者;③无中枢神经系统感染者。排除标准:①心肺脑复苏后患者;②有脑血管意外者;③有颅内器质性病变者;④其它代谢性脑病者。本试验经医院伦理委员会批准,符合伦理学标准;所有患者均由专业人员详细告知本人及家属研究内容并同意参加,并签署知情同意书。收集两组患者一般资料,包括年龄、性别、急性生理与慢性健康状况Ⅱ(acute physiology and chronic health evaluation scoring system Ⅱ,APACHE Ⅱ)[8]、序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分[9]、28d死亡率。
1.2主要试剂与仪器:TNF-α ELISA试剂盒(货号:QY-H10038),购自上海齐一生物科技有限公司;MCP-1 ELISA试剂盒(货号:JK-a-H10038),购自上海晶抗生物工程有限公司;Beckman Dxi800型全自动化学发光免疫分析仪,购自美国Beckman公司。
1.3方 法
1.3.1样品采集及保存:抽取两组患者清晨空腹静脉血样,3000r/min离心15min后收集血清,置于-80℃保存待测。
1.3.2检测血清中TNF-α、NSE、MCP-1水平:采用ELISA法检测两组血清中TNF-α、MCP-1水平,采用全自动化学发光免疫分析仪检测两组血清中NSE水平,操作步骤严格按试剂盒和仪器说明书进行。

2 结 果
2.1两组患者一般资料比较:两组患者男女比例、年龄等比较,差异均无统计学意义(P>0.05);SAE组APACHE Ⅱ、SOFA评分、28d死亡率显著高于脓毒症组(P<0.05)。见表1。
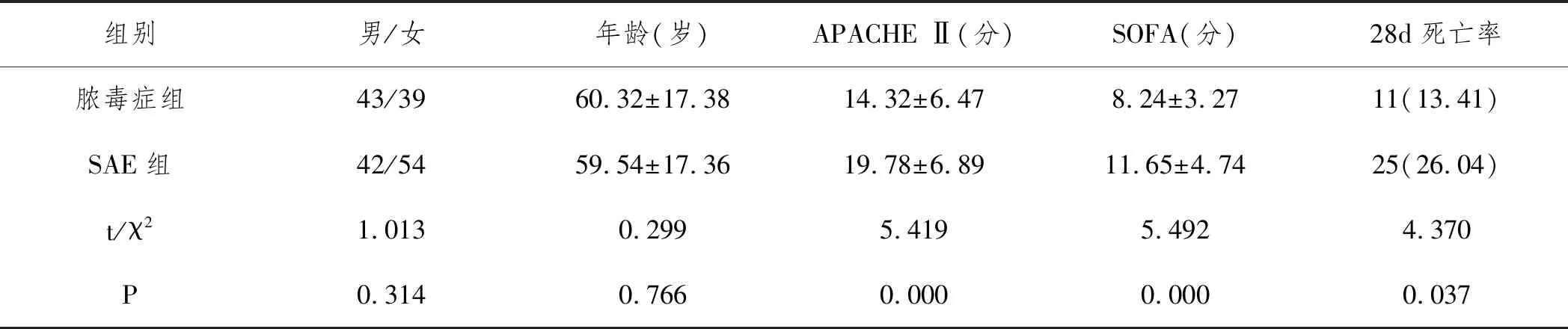
表1 两组患者一般资料比较
2.2两组患者血清中TNF-α、NSE、MCP-1水平比较:SAE组TNF-α、NSE、MCP-1水平均显著高于脓毒症组(P<0.05)。见表2。

表2 两组患者血清中TNF-α NSE MCP-1水平比较
2.3SAE患者血清中TNF-α、NSE、MCP-1水平的相关性:SAE患者血清中TNF-α、NSE、MCP-1水平两两之间均呈正相关(r=0.677、0.646、0.541,P均<0.05),见图1、图2和图3。
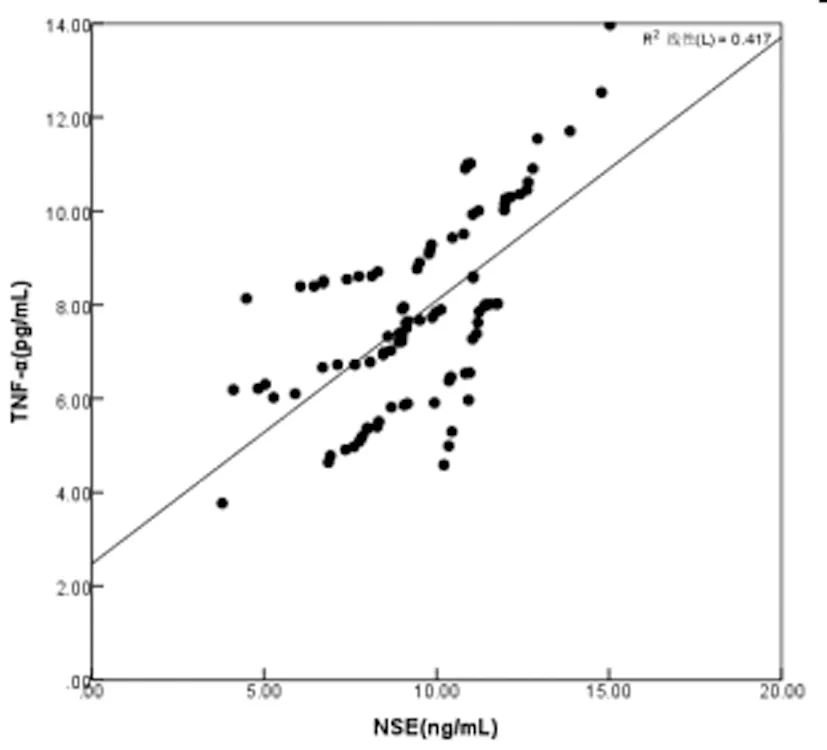
图1 SAE患者血清中TNF-α与NSE水平的相关性
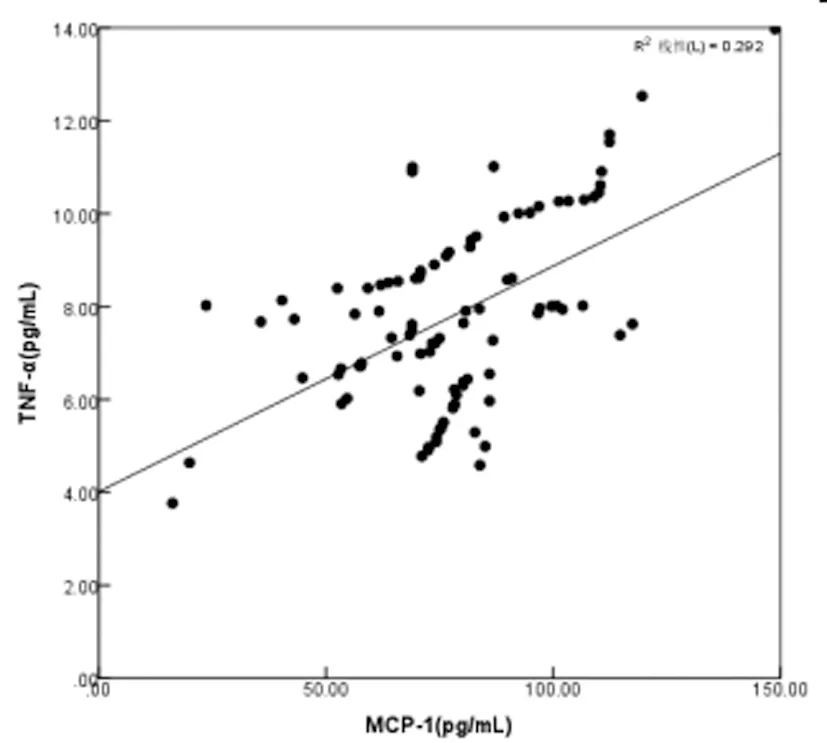
图2 SAE患者血清中TNF-α与MCP-1水平的相关性
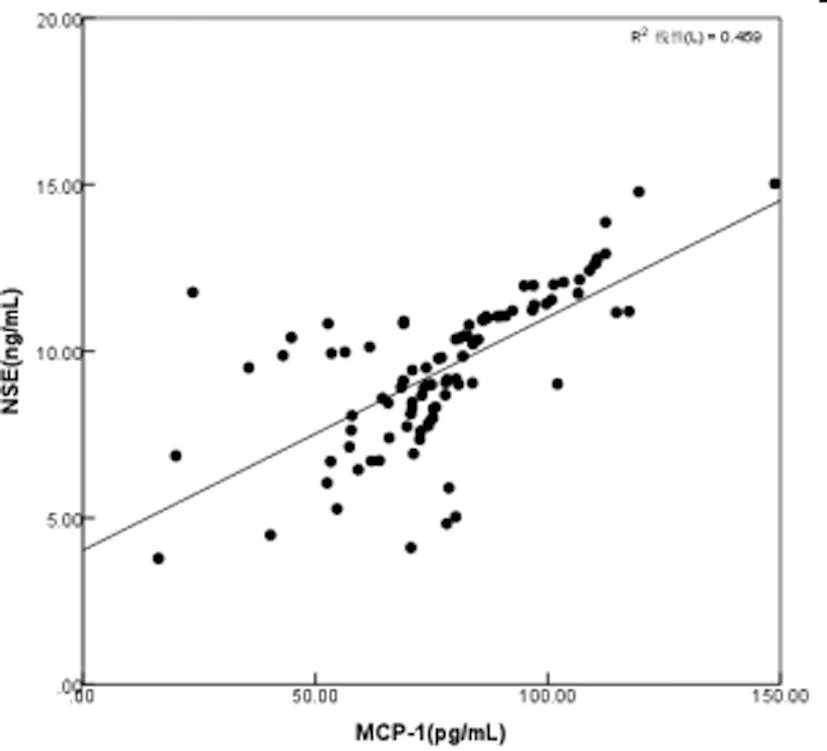
图3 SAE患者血清中NSE与MCP-1水平的相关性
2.4SAE患者血清中TNF-α、NSE、MCP-1水平与APACHE Ⅱ、SOFA评分的相关性:SAE患者血清中TNF-α、NSE、MCP-1水平与APACHE Ⅱ、SOFA评分均呈正相关(P<0.05)。见表3。
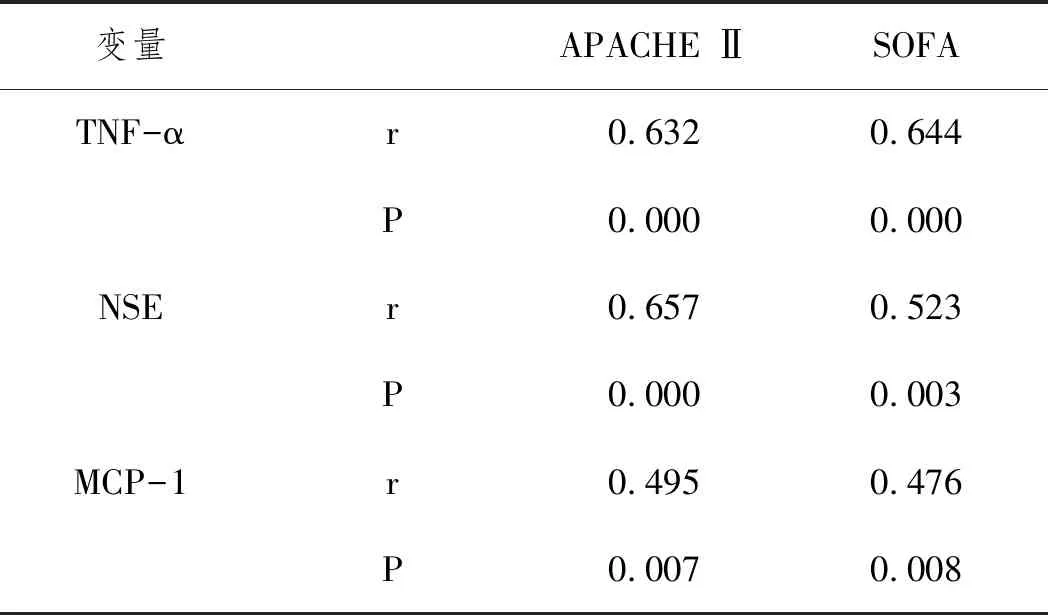
表3 SAE患者血清中TNF-α NSE MCP-1水平与APACHE Ⅱ SOFA评分的相关性
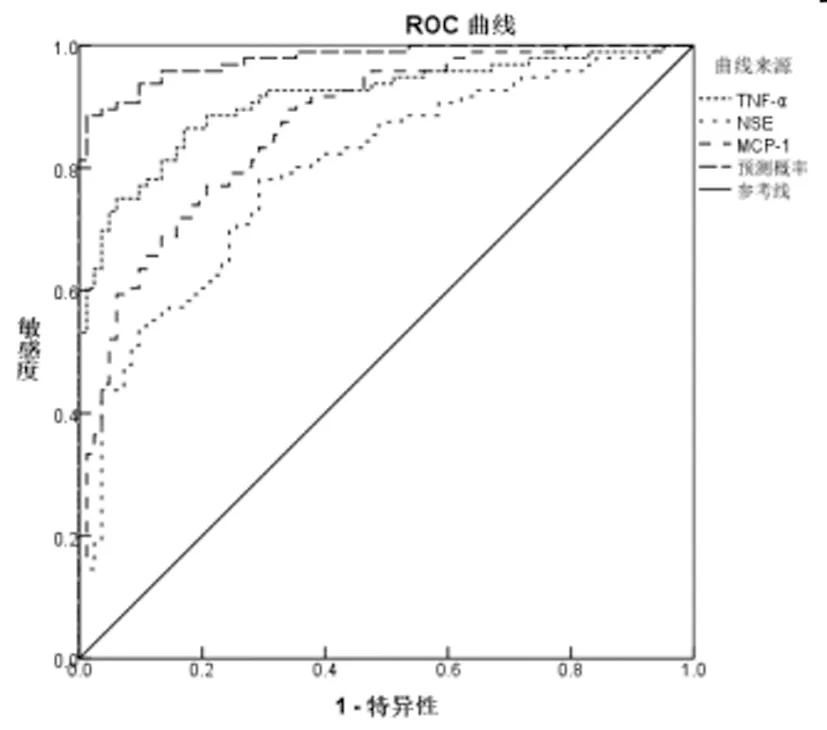
图4 TNF-α NSE MCP-1对SAE诊断的ROC曲线
2.5TNF-α、NSE、MCP-1对SAE的诊断价值:TNF-α、NSE、MCP-1预测值为检验变量绘制ROC曲线,结果显示,TNF-α诊断SAE患者的AUC为0.912(95%CI: 0.869-0.954),截断值为6.289 pg/mL,此时的特异性为86.5%,敏感度为82.9%;NSE诊断SAE患者的AUC为0.795(95%CI: 0.730-0.861),截断值为8.429 ng/mL,此时的特异性为78.1%,敏感度为70.7%;MCP-1诊断SAE患者的AUC为0.869(95%CI: 0.818-0.920),截断值为62.265 pg/mL,此时的特异性为77.1%,敏感度为79.3%;TNF-α、NSE、MCP-1联合诊断SAE患者的AUC为0.978(95%CI: 0.960-0.995),特异性为88.5%,敏感度为98.8%。见图4。
3 讨 论
SAE是一种由多因素介导的弥漫性脑功能障碍,其病理机制仍不明确,目前已确定的致病机制有:氧化应激、神经直接损伤、炎症因子水平升高等[10]。SAE可一定程度增加脓毒症患者的死亡风险,因此寻找早期SAE诊断指标对降低SAE发生率十分必要。
TNF-α参与SAE炎症反应,介导中性粒细胞在脑组织中的浸润,同时可启动多种炎症因子的表达,在脓毒症早期炎症反应中有重要意义[11]。本研究中SAE组TNF-α水平显著高于脓毒症组,与杨建钢等[12]研究中TNF-α的变化趋势一致。推测其可能原因是随脑组织损伤加重,TNF-α介导的中性粒细胞浸润增加,导致炎症水平升高,进而促进SAE的发生。
NSE广泛存在于神经组织中,是目前公认的脑组织损伤标志物,它在颅脑神经受损后扩散至人脑脊液及细胞间隙中[13]。本研究中SAE组NSE水平显著高于脓毒症组,提示SAE患者血清中NSE水平高于脓毒症患者。颜姗珊等[14]研究中SAE患者血清NSE水平明显高于脓毒症患者,本研究与其结果基本一致。推测其原因可能是脑神经组织细胞膜的完整性被破坏,从而发生NSE扩散,导致血清中NSE检测水平升高。因此检测血清中NSE水平对早期SAE诊断可能有重要意义。
MCP-1又称为单核细胞活化因子和单核细胞趋化激活因子,它可参与缺氧、缺血性脑损伤的发生、发展。本研究中SAE组MCP-1水平显著高于脓毒症组。推测血清中MCP-1可能通过高表达释放炎性细胞因子、氧自由基等神经毒性物质,导致脑组织中炎症水平加深,进而介导SAE的发生。研究显示,APACHE Ⅱ、SOFA评分均可表征患者疾病严重程度,而本研究中TNF-α、NSE、MCP-1水平均与两评分呈正相关。提示血清TNF-α、NSE、MCP-1水平的高低与患者病情严重程度密切相关,对病情诊断可能有重要的提示作用。此外,本研究结果显示,TNF-α、NSE、MCP-1对SAE均有一定的诊断价值,其中TNF-α诊断的特异性和敏感度最高,三者联合后特异性和敏感度均有提高。提示三者联合用于临床诊断,可能对SAE疾病的早期评估具有重要意义。
综上所述,TNF-α、NSE、MCP-1可作为诊断SAE的参考指标,为早期SAE临床诊断及治疗提供新思路,降低SAE发病率。在临床中需密切监测脑损伤、炎症因子等指标变化,提高SAE诊断。但本研究为回顾性研究,有较多遗失病例,部分因素分析可能不够全面。

