柚皮苷纳米乳液递送体系的消化特性
程 喆,潘思轶,2,
(1.华中农业大学食品科技学院,湖北 武汉 430070;2.华中农业大学环境食品学教育部重点实验室,湖北 武汉 430070)
柚皮苷(naringin,NA)是存在于柑橘类水果中的一种极具代表性的天然黄酮类化合物,因其具有抗氧化[1]、抗癌[2]、缓解糖尿病[3]、抗骨质疏松[4]、抗炎[5]、抗动脉粥硬化[6]等药理作用及生物活性而广受关注。尽管NA表现出良好的生物活性,但由于其在水中的溶解度以及在人体内的吸收率很低,导致口服NA的生物利用效率极低[7]。
近年来,许多研究学者采用纳米乳液技术包埋水溶性低的营养物以提高其生物利用率。而乳化剂对构建稳定的纳米乳液起着至关重要的作用,乳清分离蛋白(whey protein isolate,WPI)作为来源广泛、安全的大分子乳化剂,具有良好生物兼容性与乳化性,被广泛应用于稳定负载营养物纳米乳液的稳定剂[8]。纳米乳液体系在胃肠道消化过程中可发生复杂的物理化学和生物学变化[9],使其结构产生不同程度的变化,从而影响纳米乳液的生物学效应[10]。WPI具有环境敏感性和生物降解性,其作为乳化剂稳定的乳液在胃肠环境下易降解,不利于营养物质的递送体系发挥最大的生物利用率。有研究发现,蛋白质-多糖双层乳液可增强单层纳米乳液的理化稳定性,对所包埋营养物形成更好的保护,更适用于营养物在人体消化道内的释放和吸收[11-12]。近年来,NA纳米乳液的体外消化规律鲜有报道,对WPI-多糖双层纳米乳液消化规律的研究也并不多见。
本实验以WPI为乳化剂构建NA纳米乳液,并在WPI界面层引入ι-卡拉胶(ι-carrageenan,ι-Car)和阿拉伯胶(gum arabic,GA)制备双层纳米乳液。分析NA单层纳米乳液(NA/WPI-e)及加入ι-Car和GA制备的双层纳米乳液(NA/WPI/ι-Car-e、NA/WPI/GA-e)在口腔、胃、肠消化过程中粒径、Zeta电位的变化,比较体外消化后游离脂肪酸(free fatty acids,FFAs)释放率以及NA生物利用率的变化规律,以期为选用WPI等生物大分子乳化剂构建纳米乳液用于NA等营养物的递送提供理论基础。
1 材料与方法
1.1 材料与试剂
NA(纯度≥98%) 武汉科瑞生物技术公司;WPI(纯度≥98%) 美国Davisco食品国际公司;NA标准品、中链甘油三酯(medium chain triglyceride,MCT)、磷酸盐缓冲溶液(phosphate buffer saline,PBS)、GA、ι-Car、黏蛋白、胃蛋白酶、猪胆汁盐 上海源叶生物科技有限公司;胰酶 美国Aladdin工业公司;甲醇、氢氧化钠、盐酸、氯化钠、硝酸铵、磷酸二氢钾、氯化钾、柠檬酸钾、尿素 国药集团化学试剂有限公司;叠氮钠天津科密欧试剂有限公司;尼罗红 美国Sigma-Aldrich公司。
1.2 仪器与设备
J-26 XP型高速冷冻离心机 美国Beckman Counter公司;ZetasizerNano ZS90型光散射粒径分析仪 英国Malvern公司;AL204型分析天平 梅特勒-托利多仪器有限公司;Ultra-Turrax T18型高速分散器 德国IKA公司;905 Titrando型全自动电位滴定仪 瑞士Metrohm公司;PHS-3C型pH分析仪 上海雷磁公司;M-110-EH-30型高压微射流纳米均质机 美国MFIC公司;MA100N型倒置荧光显微镜 日本尼康公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司。
1.3 方法
1.3.1 NA纳米乳液的制备
NA/WPI-e的制备:称取10 mg NA(纯度98%)溶于10 g MCT中,超声处理20 min至完全溶解,形成油相。将WPI溶于pH 7.0的0.05 mol/L的PBS中,室温下搅拌4 h后放置于4 ℃冰箱溶胀过夜,使蛋白质充分溶解。水相的WPI质量浓度为50 mg/mL。在高速剪切仪的作用下(18 000 r/min、5 min),将NA油相缓慢加入到水相中,形成油体积分数10%的粗乳液。再通过高压微射流纳米均质机进一步处理,在均质压力10 000 psi条件下循环3 次得到NA/WPI-e。加入0.02%叠氮化钠,抑制微生物的生长。
NA/WPI/ι-Car-e和NA/WPI/GA-e的制备:在NA/WPI-e的基础上加入不同质量浓度的GA和ι-Car溶液,由高压微射流纳米均质机进行二次均质,GA和ι-Car在乳液中最终质量浓度为1、2、3 mg/mL。
1.3.2 体外模拟消化实验
参考Li Yan等[13]构建的体外消化模型,模拟口腔、胃和肠3 个阶段。
口腔模拟消化:称取3.6 g乳液与1.4 mL PBS(pH 7.0,10 mmol/L)混合,然后与9 mL口腔模拟液(1.594 g/L氯化钠、0.328 g/L硝酸铵、0.636 g/L磷酸二氢钾、0.198 g/L尿素、0.202 g/L氯化钾、0.308 g/L柠檬酸钾、5 g/L黏蛋白)充分混合,保证混合体系中油的质量分数为2%,调节pH 6.8,于37 ℃水浴中搅拌90 s,转速100 r/min。90 s后停止反应,取2 mL用于粒径、Zeta电位的测定。
胃部模拟消化:经口腔消化后的样品以体积比1∶1与胃模拟液(NaCl 2 g、胃蛋白酶3.2 g、7 mL 37% HCl溶液,溶于1 L水中充分混合后,用1 mol/L HCl溶液调节pH 1.2)混合,共计32 mL,保证混合物中油相的质量分数为1%,然后调节pH 2.5,于37 ℃水浴中搅拌1 h,转速100 r/min。随后停止酶促反应,取2 mL用于后续粒径、Zeta电位的测定,剩余溶液进行肠消化。
小肠模拟消化:消化液样品在经过模拟胃消化阶段1 h后,调节pH 7.0,并依次加入3.5 mL胆盐溶液(5 mg/mL)、1.5 mL CaCl2(5 mmol/L)与NaCl(150 mmol/L)混合溶液,再调节其pH 7.0;最后加入2.5 mL现配制的胰酶(1.6 mg/mL)悬浮液,开始小肠油脂消化,消化2 h。在肠消化过程中,使用pH-stat法将0.25 mol/L的NaOH溶液加入消化体系使pH值控制在7.0左右,并记录消耗NaOH溶液的体积。消化结束后冰浴10 min停止酶促反应,随后测定粒径、Zeta电位。
1.3.3 FFAs释放率的测定
在肠消化过程中,脂肪在胰脂肪酶的作用下不断被水解为FFAs。根据2 h内NaOH溶液消耗量计算出体系中FFAs释放量,如式(1)所示:

式中:Vexp(NaOH)为滴定时消耗NaOH溶液的体积/L;C(NaOH)为实验所用NaOH溶液浓度(0.25 mol/L);m(MCT)为消化前样品中MCT质量/g;mW(MCT)为MCT的摩尔质量(500 g/mol)。
1.3.4 NA纳米乳液生物利用率的测定
NA标准曲线的绘制:采用HPLC方法,色谱条件参考Zhang Ping等[14]的方法。精密称取NA 1.0 mg,用甲醇进行梯度稀释。以标准品溶液质量浓度(x)为横坐标,峰面积(y)为纵坐标,进行线性回归所得的回归方程为:y=23 669x+4 839.6(R2=0.999 1)。表明NA在0.25~10.0 μg/mL范围内呈良好的线性关系。
NA质量浓度的测定:采用HPLC方法。准确吸取200 μL的样品,然后依次加入2 mL的甲醇和2 mL的正己烷的混合有机相进行萃取。4 000 r/min离心6 min后,除去上清正己烷,取1 mL样品12 000×g离心2 min后,过有机膜后进行HPLC分析。利用测得的标准曲线回归方程计算NA的质量浓度。
生物利用率的测定参照Qian Cheng等[15]的方法。NA纳米乳化体系经模拟肠阶段消化后,消化液10 000 r/min离心35 min后得到胶束液。取中间的胶束液,利用NA标准曲线计算质量浓度。根据式(2)计算消化后NA的生物利用率:
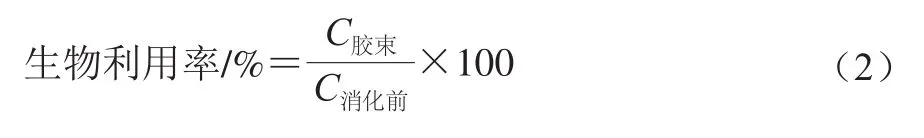
式 中 :C胶束为 消 化 后 胶 束中NA的质量浓度/(μg/mL);C消化前为消化前NA的质量浓度/(μg/mL)。
1.3.5 NA纳米乳液平均粒径、Zeta电位的测定
参考刘蕾等[16]的方法。利用马尔文激光粒径仪在25 ℃测量NA纳米乳液的平均粒径及Zeta电位。样品用PBS稀释500 倍,以防止多次散射效应。设定测量参数为:样品折射率为1.473;分散剂折射率为1.330。
1.3.6 荧光显微镜观察
采用倒置荧光显微镜分析乳液体外模拟消化后形态的变化。取一定量的消化样品,滴加质量分数0.02%的尼罗红荧光染料,摇匀,避光。取少量样品滴于载玻片上,轻轻压上盖玻片并避免气泡产生。用荧光显微镜观察。
1.4 数据分析
实验均重复3 次,采用SPSS 20进行显著性分析,使用Origin 8.0软件进行绘图。P<0.05,差异显著。
2 结果与分析
2.1 NA纳米乳液体系在体外消化过程中粒径的变化
如图1所示,NA/WPI-e和NA/WPI/ι-Car-e、NA/WPI/GA-e经过口腔消化后的粒径和原始乳液相比无显著变化(P>0.05),表明乳液在口腔消化过程中保持稳定。模拟胃液消化后,NA/WPI-e和NA/WPI/ι-Car-e、NA/WPI/GA-e的粒径均显著增大(P<0.05)。NA/WPI/ι-Car-e、NA/WPI/GA-e经模拟小肠消化后的平均粒径均低于NA/WPI-e的平均粒径。GA质量浓度为2 mg/mL和3 mg/mL的双层纳米乳液经过肠液模拟消化后,纳米乳液的平均粒径均显著低于胃消化后的粒径(P<0.05),此时GA基本上全部从WPI形成的膜层上脱落下来。ι-Car在1 mg/mL和3 mg/mL质量浓度时小肠消化后的平均粒径高于胃消化的粒径,推测由于在小肠模拟消化过程中,脂肪酶、胆盐和FFAs等与乳液发生复杂的生物学变化[17],油脂的消化产物在肠道消化阶段形成一系列复合胶体,从而导致乳液的粒径显著增大[18]。由图1可以看出,不同质量浓度ι-Car和GA构建的NA纳米乳液在模拟消化过程中平均粒径的差别较大。

图1 不同质量浓度ι-Car和GA构建的NA纳米乳液在模拟消化过程中平均粒径的变化Fig.1 Change in average particle size of nanoemulsions prepared with different concentrations of ι-Car and GA during simulated digestion
2.2 NA纳米乳液在体外模拟消化过程中Zeta电位的变化
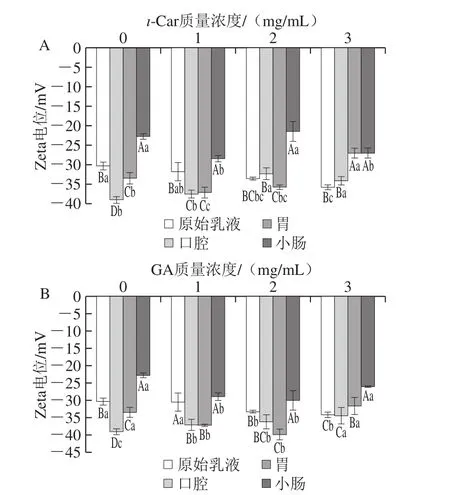
图2 不同NA纳米乳液在模拟消化过程中电位的变化Fig.2 Change in zeta potential of different naringin-loaded nanoemulsions during simulated digestion
由图2可知,NA/WPI-e和NA/WPI/GA-e经口腔消化后,乳液所带的负电荷值均高于原始乳液,部分NA/WPI/ι-Car-e所带的负电荷降低。NA/WPI-e经口腔消化后的Zeta电位为-39.0 mV,经模拟胃和小肠消化后乳液所带的负电荷逐渐减少,Zeta电位分别为-33.5 mV和-22.8 mV。在胃消化的环境中,NA/WPI/ι-Car-e和NA/WPI/GA-e的多糖质量浓度为1 mg/mL和2 mg/mL时,Zeta电位绝对值均高于原始乳液。目前并不完全清楚引起胃消化液中乳液所带的负电荷增多的物质的性质。有研究表明,Zeta电位可表示液滴的静电排斥力,其绝对值越高,乳液的稳定性越好。在模拟人体消化的过程中,由于能量壁垒效应的影响,乳液表面的高电荷会阻止消化液破坏乳液内部从而保护NA[19],由于模拟胃消化阶段的3 种纳米乳液均具有较强的负电荷,对胃蛋白酶的水解具有一定的抵抗作用,有利于NA能顺利地被运载至肠道。经模拟小肠消化后,NA纳米乳液的Zeta电位绝对值均降低。
2.3 NA纳米乳液在体外消化过程中显微镜观测
为研究整个口服消化过程中乳液的变化情况,对口腔、胃、小肠中乳液的微观结构进行观察,并使用尼罗红染色法观察油脂变化情况。图3部分样品由于液滴的尺寸太小,已经接近荧光显微镜的最低分辨率,因此难以很好地观察,在荧光观察的视野中显示一片红色[20]。
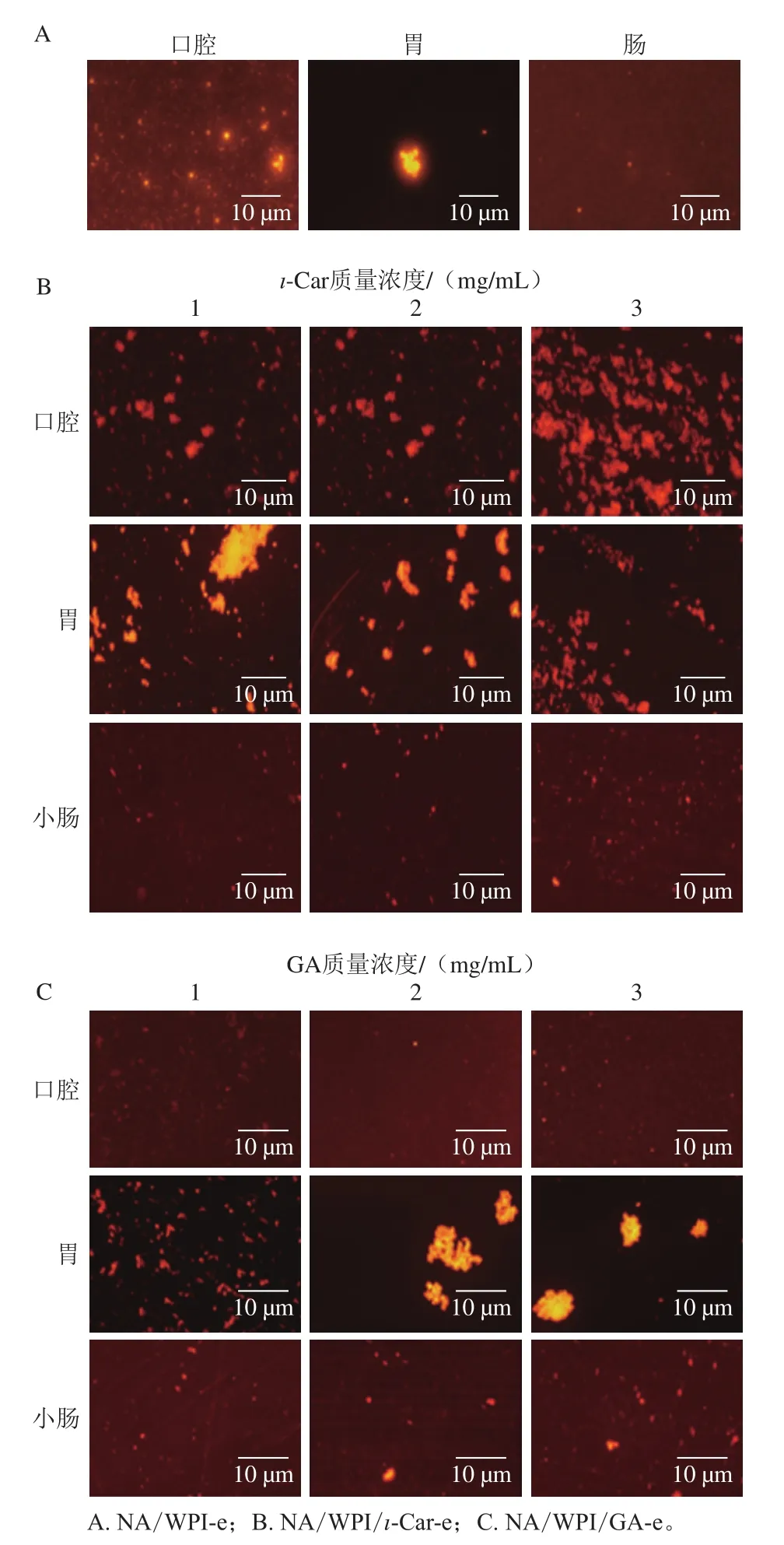
图3 不同纳米乳液消化前后的荧光显微镜图片Fig.3 Fluorescent microscopy images of different nanoemulsions before and after simulated gastrointestinal digestion
由图3可知,制备的纳米乳液在不同消化阶段发生了不同程度的水解。由于乳液在口腔中消化时间仅为90 s,而NA/WPI/ι-Car-e显示出絮凝状,且ι-Car质量浓度越高,聚集液滴越多,推测其在口腔消化后的聚集可能与ι-Car空缺絮凝作用有关[21]。由图3可知,当乳液完成胃消化阶段后,乳液液滴明显聚集,在小肠中,乳液体系发生解絮凝。Lim等[22]研究也发现WPI和GA制备的双层乳液在小肠消化中存在解絮凝现象。结合消化过程中NA纳米乳液的粒径与Zeta电位的结果,NA/WPI-e和双层纳米乳液在胃消化环境下絮凝,而胃消化阶段乳液所带的负电荷量依旧较高,维持较高的静电排斥力,随后在小肠中胆盐与胰酶的共同作用下,乳液中的油脂消化水解,NA从油脂中逐渐释放出来,从而有利于NA在肠道中的消化吸收。这与高健[23]的研究结果相似。Mcclements等[24]的研究也表明,WPI结构中的β-乳球蛋白对胃蛋白酶表现出一定的抗性,且乳白蛋白在胃部消化过程中的酶解也存在降低现象[25]。另外,由于本研究所用的WPI质量浓度较高,保证分散相表面覆盖了致密的蛋白质分子层,阻止了蛋白在乳液界面的有效伸展,导致乳化体系的多肽链伸展度较小,阻碍了胃蛋白酶对WPI的水解能力[26],因此NA/WPI-e及NA/WPI/ι-Car-e和NA/WPI/GA-e对胃蛋白酶的水解具有一定的抗性。
2.4 NA纳米乳液在体外消化过程中FFAs释放率的变化
FFAs释放率是判定NA生物利用率高低的重要参数。采用pH-stat方法测定模拟小肠消化过程中的FFAs释放率,其中对照组是溶有同等质量浓度NA的MCT油相,结果见图4。

图4 FFAs释放率在小肠消化中随消化时间的变化Fig.4 Change in FFA release rate during intestinal digestion
由图4可知,NA/WPI-e、NA/WPI/ι-Car-e与NA/WPI/GA-e的FFAs释放率的变化趋势保持一致,均呈先快速增加后缓慢提高的变化趋势,在前500 s内,3 种纳米乳液的FFAs释放量均快速增加,表明乳液中油脂的水解速度在前500 s都很快,随后FFAs释放速率明显放缓,最后趋于相对稳定。NA/WPI-e在肠消化后的最终FFAs释放率最高为97.3%,NA/WPI/ι-Car-e的FFAs释放率随ι-Car质量浓度由小到大依次达到94.8%、84.7%和91.5%,NA/WPI/GA-e的FFAs释放率由小到大依次为96.8%、80.8%和79.3%,对照组FFAs释放率仅为34%,显著低于NA纳米乳液。由于乳液中油脂的消化水解属于界面反应[27],而纳米乳液递送体系的比表面积较大,提高了油脂与胃肠道分泌物的接触比面积,促进了油脂与吸附的消化酶之间的相互作用[28],因此表现出更高的油脂水解速率。与陈翰[29]的研究结果一致。由最终值可以看出在120 min时,乳液体系的FFAs释放率并未达到100%,这是由于乳液的消化速率越快,颗粒的聚集也越快,使得油滴总的表面积减少,导致FFAs释放量降低[30]。由图4可以得出,纳米乳液递送体系能有效地提升油脂的消化速率。
2.5 NA在纳米乳液中的生物利用率分析
有研究表明纳米乳液递送体系在模拟小肠消化阶段,油脂在脂肪酶与胆盐的作用下发生水解,被包埋的营养物逐渐从油脂中释放出来,被包埋的营养物不断地载入胶束中,从而被小肠上皮细胞吸收利用[31]。因此,可以利用肠道消化过程后胶束中NA质量浓度表示其生物利用率,结果见图5。

图5 NA在纳米乳液中的生物利用率Fig.5 Bioavailability of narigine incorporated in different nanoemulsion systems
通过HPLC检测发现,仅溶于油相MCT中的NA在283 nm波长处无峰,说明对照组中NA生物利用率极低。由图5可知,对比仅溶于MCT中的NA,纳米乳液的形成可测得NA的生物利用率。NA/WPI-e经过胃肠消化后的生物利用率达10.06%,NA/WPI/GA-e在GA质量浓度为1 mg/mL时生物利用率最高为12.13%。NA/WPI/ι-Car-e的NA生物利用率均略低于NA/WPI-e,Mcclements等[32]的研究表明,纳米乳液递送体系中功能物质的吸收率显著高于仅溶解于水中或者油相中的吸收率,与本研究结果一致。同时,由于纳米乳液的表面积体积比很大,其巨大的反应界面面积可以大大增强酶促反应的速率[33],从而FFAs释放率和释放量也随之增加。由于乳液脂肪水解的程度关系到小肠消化中胶束的形成,FFAs释放率越高,脂肪水解程度越高,胶束越易形成,及油脂消化程度与生物利用率呈正相关[34],结合图4中NA纳米乳化体系的FFAs释放率的变化趋势,发现NA的生物利用率与FFAs释放率呈正比。与徐丽青[35]、Yi Jiang等[36]的研究结果类似。部分双层纳米乳液的生物利用率和FFAs释放率均略低于NA/WPI-e,可能是由于ι-Car和GA的在消化过程中阻碍乳液与消化液的接触。
3 结 论
本实验通过测定粒径、Zeta电位、FFAs释放率以及NA生物利用率探讨NA单层与双层纳米乳液在口腔、胃、肠中的消化特性。在口腔消化阶段,单层及双层纳米乳液的粒径无显著变化;在胃消化阶段,NA/WPI-e、大部分NA/WPI/GA-e和NA/WPI/ι-Car-e的Zeta电位绝对值高于原始乳液,倒置荧光显微镜观察显示液滴产生明显的聚集;在小肠消化阶段,NA/WPI-e的粒径显著增加,NA/WPI-e及NA/WPI/ι-Car-e、NA/WPI/GA-e的Zeta电位绝对值降低,且显微镜观察显示纳米乳液体系的液滴均发生一定程度的解絮凝。3 种NA纳米乳液的FFAs释放率和NA利用率明显高于对照组,且GA质量浓度为1 mg/mL的NA/WPI/GA-e相比于NA/WPI-e NA生物利用率更高,因此,NA纳米乳液递送体系能有效提高NA生物利用率,合适的WPI-多糖双层纳米乳液可促进NA的吸收。

