冠状动脉自发性夹层致两次心肌梗死救治一例
赵飞飞,王大新, 何胜虎,徐日新,纪军,谢勇,徐冰
(扬州大学临床医学院·苏北人民医院心血管内科,江苏 扬州 225001)
自发性冠状动脉夹层(spontaneous coronary artery dissection,SCAD)发病机制尚不完全清楚,关于复发的SCAD治疗尚缺少相关临床数据。本文报告1例SCAD患者两次心肌梗死的救治经历,为复发的SCAD患者的救治提供临床借鉴。
1 临床资料
患者女性,52岁,因“突发胸痛4 d”于2016年11月3日入扬州大学临床医学院治疗。既往高血压病史5年余,无糖尿病病史;48岁停经,近5年未服用避孕药,否认家族性遗传病史。入院体格检查无明显阳性体征。心脏超声示左心室舒张末期内径46 mm,射血分数61%。心电图示V2~V6 T波倒置。肌钙蛋白I 8.40 ng/ml(正常值<0.034 ng/ml)。诊断为急性非ST段抬高型心肌梗死,行冠状动脉造影结果如图1A所示,考虑此次急性心肌梗死罪犯血管为第2对角支(D2),病变血管远端较细,呈鼠尾样改变,无法植入支架,且冠状动脉远端心肌梗死溶栓疗法研究(thrombolysis in myocardial infarction,TIMI)血流Ⅲ级,选择内科保守治疗,术后规律服用阿司匹林肠溶片等药物。
2018年5月22日,患者活动时再次突发压榨性胸痛4 h入院,心电图示I、aVL导联ST段抬高>0.1 mV,V1~V4 R波递增不足。心脏超声示左心室舒张末期内径48 mm,左心室射血分数53%。查肌钙蛋白I 0.641 ng/ml(正常值<0.034 ng/ml),肌红蛋白288.9 ng/ml(正常值<61.5 ng/ml)。诊断:急性高侧壁心肌梗死,心功能Killip分级I级,冠状动脉粥样硬化性心脏病,高血压病2级(很高危)。急诊冠状动脉造影示(图1B):D2全程弥漫性狭窄变细,远端TIMI血流0~I级。血管内超声影像显示(图2):D2全程、前降支近段至回旋支开口可见壁内血肿和假腔形成。送入美敦力2.0 mm×15.0 mm预扩张球囊以6~8 atm扩张,重复造影见对角支远端TIMI血流2~3级(图1C),可见夹层影和管腔弥漫性变细,建议继续药物治疗。术后予以阿司匹林肠溶片(100 mg)、硫酸氢氯吡格雷片(75 mg)双联抗血小板治疗。随访13个月无胸部不适。
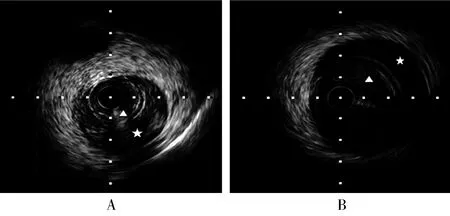
图2 血管内超声结果
2019年7月4日复查造影示(图1D),D2原夹层处基本愈合,无造影剂残留,血流良好;心脏超声示左心室舒张末期内径49 mm,射血分数63%;心电图基本正常。
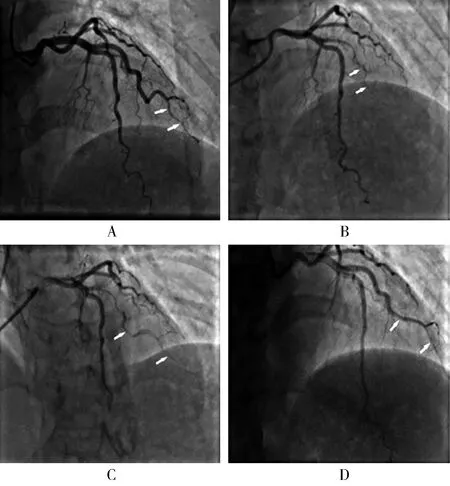
图1 冠状动脉造影结果
2 讨 论
SCAD是由于冠状动脉壁非创伤性和非医源性分离形成血管假腔,对真腔产生压迫,引起冠状动脉血流减少导致的病症,是一种少见的冠状动脉疾病[1,2]。在接受冠状动脉造影的患者中,SCAD患病率在0.1%~0.2%之间,多发于女性患者,特别是围生期女性多发,死亡率极高[3-6]。SCAD心血管不良事件主要表现为不稳定型心绞痛、急性心肌梗死、室性心律失常或心源性猝死等[1,2,4,7]。研究发现,SCAD可发生于任何冠状动脉,以左前降支发病率最高(35%~46%),在所有冠状动脉节段中,中远段是常见发病部位,多血管SCAD发病率约为9%~23%[1,2,5]。SCAD发病机制尚不完全清楚,通常认为是由于冠状动脉壁内滋养血管破裂出血,导致动脉壁中膜外1/3或中膜与外膜间形成大的夹层血肿,最终可压迫冠状动脉,或因管壁不连续(内膜撕裂)导致血液从真腔进入假腔。既往临床研究证实,SCAD的发生与纤维肌性发育不良和遗传易感性有关[4,5,8]。Sun等[9]研究发现,TSR1基因突变与SCAD相关。SCAD与激素水平改变、自身免疫性疾病、系统性炎症反应等的关系尚需要充分的证据。
随着冠状动脉影像学技术的进步,SCAD检出率在逐渐增加,对其的治疗也逐渐引起了重视。2018年美国心脏病学会/欧洲心脏病学学会分别发布了各自的SCAD专家共识[1,2,10,11]。目前治疗SCAD主要方法有如下几种。(1)内科保守治疗。这是目前公认的首选治疗SCAD的方法,尤其是对于血流动力学稳定的SCAD患者,经过药物治疗后一般可自行愈合,但也有约5%~10%患者可长期存在夹层或病情加重。(2)经皮冠状动脉介入治疗。经皮冠状动脉腔内成形术或直接支架植入术可使支架覆盖整个夹层,防止夹层扩大,稳定血管腔。但在行经皮冠状动脉介入时,往往会选择较长的支架,这就增加了后续支架内再狭窄和支架内血栓的发生率。且SCAD往往影响冠状动脉远端,而冠脉远端往往较为细小,无法植入支架。(3)冠状动脉旁路移植术。对于冠状动脉主干夹层或复杂病变患者,特别是血流动力学不稳定而介入治疗失败时,可考虑冠状动脉旁路移植术。
Saw等[12]在前瞻性队列研究中发现,80%的SCAD患者(134例)最初接受保守治疗,其中住院期间心肌梗死复发率为4.5%,2年内重大心脏事件发生率为17%,SCAD总复发率为13%。SCAD患者的观察数据显示,在最初事件发生数周至数月后,有70%~97%的患者夹层病变可以愈合[2]。SCAD的自发愈合具有一定的时间依赖性,这也许与血管内皮细胞生理周期有关;但对于长期不能愈合或愈合后再复发的SCAD的病例治疗尚缺少大量的相关临床数据。
本例患者在第1次SCAD致心肌梗死后采取保守治疗,术后予以抗血小板治疗,15个月后再次发生相同部位的夹层,冠状动脉造影及血管内超声提示夹层较上次明显加重、进展迅速,提示保守治疗后的单联抗血小板治疗对其病情改善获益有限。第2次SCAD致急性心肌梗死后,通过半顺应性球囊对夹层血管行经皮腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA),再予以双联抗血小板治疗13个月,随访期间患者无胸部不适症状。13个月后复查冠状动脉造影,D2原夹层处基本愈合,无造影剂残留,远端血流良好。该患者经历了2次不同的治疗方案,对于复发的SCAD行PTCA联合双联抗血小板治疗,患者获益更大,这可能是因为PTCA促进了壁内血肿尽快排出及吸收,使内膜瓣贴附在动脉壁上,从而使SCAD自发愈合。对于复发的SCAD患者的治疗目前尚缺少相关临床数据,本篇病例报告的诊治方案可为复发的小血管SCAD患者提供临床借鉴。
对于SCAD患者接受双联抗血小板治疗(dual antiplatelet therapy, DAPT)和阿司匹林及抗凝治疗仍存在争议[1,2,11,13]。由于SCAD的病理生理学和心肌细胞缺血机制的特殊性,冠状动脉血运重建结局和残留机制不同于动脉粥样硬化及急性冠状动脉综合征(acute coronary syndrome,ACS),在SCAD患者中使用标准ACS疗法存在潜在风险。目前缺少比较SCAD中使用DAPT治疗和单独使用阿司匹林的短期或长期结局或出血风险的临床研究;但在2014年美国心脏协会/美国心脏病学会指南中[14],建议接受冠状动脉血运重建的SCAD患者应在术后接受基于标准指南的抗血小板治疗,而对于在未接受冠状动脉介入治疗的SCAD患者中使用DAPT治疗尚缺少相关证据。对于SCAD抗凝,目前尚缺乏证据支持其安全性,多数临床研究者担心抗凝会增加夹层假腔扩张及出血的风险。
总之,SCAD患者病情重,病死率高,相关并发症多。对于血流动力学稳定的SCAD患者,建议首选保守治疗;而对于复发的SCAD患者,可以考虑冠状动脉血运重建,PTCA是其很好的选择术式之一,术后接受基于标准指南的抗血小板治疗,但不建议抗凝治疗,同时注意患者出血风险。

