本芹种子乙醇层析物对黄瓜枯萎病菌的抑制作用
钱程 高涵 苗宇 贠娜娜 张娜 李显超
摘 要:本文以黄瓜枯萎病菌为指示菌株,制备本芹种子乙醇粗提取液,采用柱层析法对本芹种子乙醇粗提取液进行层析分离,每次分离均得到8个流分,用不同流分与黄瓜枯萎病菌进行离体培养,从中筛选抑制病菌菌落生长最强的流分,用以研究本芹种子乙醇层析物的抑菌作用。结果表明,本芹种子乙醇层析物不同流分对黄瓜枯萎病菌均有不同程度的抑制作用。经过三次柱层析分离之后,最终筛选出流分ZY-6-5-4、ZY-6-5-5、ZY-6-6-6和ZY-6-6-7其群落扩展速度在96-144h时间小于其他流分,抑制作用最大,且与空白对照差异显著(P<0.05)。
关键词:黄瓜枯萎病;乙醇粗提物;抑制作用;本芹
中图分类号:S633.4 文献标识码:A 文章编号:1673-260X(2020)09-0027-04
1 引言
黄瓜枯萎病(Cucumber Fusarium Wilt)[1],也经常被称为萎蔫病、蔓割病,可经过土壤、种子、肥料、昆虫、农具等途径传播传染,也可借助雨水或者灌溉水远距离传播传染。根据调查统计,每年由于黄瓜枯萎病引起病害可达20%,最严重时可高达90%,使黄瓜大量减产,甚至严重到绝收。迄今为止,黄瓜枯萎病已经成为导致黄瓜减产绝收的病害之一[2,3]。为了保证黄瓜的生产质量及生长品质,现研究利用植物的化感作用[4]来防治黄瓜枯萎病是一个新的绿色防控技术。
化感作用(Allelopathy)属于植物生态学的分支科学—生态生化学(Ecological Biochemistry)研究内容的一部分。是指植物通过淋溶、挥发、分泌和分解等方式向环境释放化学物质为对该种植物或者植物周围(包括微生物)所产生的直接或间接的促进或者抑制作用的一种化学生态学现象[5],也被称为他感、相生相克、异株克生。
化感物质是化感作用重要物质支撑基础,占据化感作用中心位置。化感物质是植物或自身发育生长所产生和释放的次生代谢物质,主要有酚类、萜类、生物碱等。其主要来源为根系分泌物、茎和叶的淋溶物、植物残体分解物等[6]。根据植物自身分泌化感物质的特性,并且利用化感作用防治病害操作方便、简单、有效[7],同时对植物的生长环境不会产生污染。因此,利用植物化感物质的抑制作用来防治病害成为比较受欢迎的手段之一。课题组前期实验证实,本芹种子乙醇粗提物能够抑制黄瓜枯萎病生长,但是粗提物里面的抑菌成分非常复杂,有必要对其进行进一步的分离和纯化,基于此,开展了本芹种子乙醇层析物不同流分抑菌作用的试验研究。
2 材料与方法
2.1 材料与菌种
2.1.1 试验材料 本芹種子
2.1.2 供试菌种 黄瓜枯萎病菌(Fusarium oxysporium f.sp.cucumerinum),购自中国工业微生物菌种保藏管理中心(CICC)
2.1.3 培养基 PDA 培养基(马铃薯200g,葡萄糖20g,琼脂18g,水1000mL,自然pH)。
2.2 仪器设备
恒温培养箱(HWS-250B),高压灭菌锅(YXQ-LS-75SⅡ),超净工作台(VS-1300L-U)
2.3 本芹种子层析物抑菌作用试验
2.3.1 本芹种子粗提物的制备
称取新鲜的干净的本芹种子10g,放置于三角瓶中,倒入50ml乙醇。将三角瓶置于摇床震荡24h(25℃,140r·min-1)。震荡24h后,取出放置于超净工作台。首先用滤纸将多余的本芹种子从浸泡液中滤出,留取液体;然后用0.45μm细菌过滤器再次过滤以便除去细菌,之后得到浓度为200mg·mL-1本芹种子乙醇粗提液。
2.3.2 菌种活化
将黄瓜枯萎病菌接种于PDA培养基,倒平板后置于25℃培养箱中培养,120h后取出待用。
2.3.3 色谱柱制备
采用硅胶作为色谱柱的填料。称量15g硅胶置于烧杯之中,加入适量乙醇(浓度为20%),用玻璃棒进行搅拌,直至硅胶变得粘稠,没有块状为止。将搅拌后的硅胶倒入色谱柱内,用胶头滴管吸取乙醇,以手腕旋转的方式对挂在色谱柱壁的硅胶进行冲刷,打开色谱柱底部的活塞,使多余的乙醇流出,待乙醇液面距硅胶1cm时,关闭活塞。注意对样品进行前处理,尽可能除去杂质避免制备色谱柱子被污染。
2.3.4 柱层析法分离
用10ml量筒每次量取10ml提取液依次倒入制备好的色谱柱,然后打开底部活塞,对所流下的液体进行收集,每5ml为一个流分,为保持色谱柱内液体页面高于硅胶1cm,在粗提液面下降到距硅胶1cm时,用胶头滴管吸取乙醇以手腕旋转的方式沿着色谱柱内壁加入乙醇,以保持液面高度。共收集8个流分。注意当每个色谱柱分成8个流分后,就要重新取10ml的提取液,重新制备色谱柱。
2.3.5 室内抑菌作用实验设计思路
将第一次层析后获得的8个流分,记为ZY-1~8(ZY表示本芹种子乙醇提取物),与黄瓜枯萎病菌共培养144h后,记录各组处理的菌落直径,从中选取抑制效果最好的一组,用该组添加的流分再进行第二次层析,分别收集8个流分,重复上述培养和计数过程,再筛选两个抑制效果最好的流分,并进行第三次层析分离;培养后记录菌落直径,最终得到4个抑制效果最佳的流分。
2.3.6 室内抑菌作用实验操作程序
第一步 配置培养基:配置PDA培养基
第二步 高压灭菌
第三步 稀释流分 将之前所获得的八个流分稀释四倍,浓度为200mg·mL-1,待用。
第四步 制备平板 将高温灭菌的试验物品及稀释的八个流分置于超净工作台中。将稀释的流分分别三次通过细菌滤器,注意保证最后有10ml的提取液。依次将其倒入80ml三角瓶中,并取灭过菌好的培养基倒入含有不同粗提液的三角瓶中,定容至80ml,摇匀,平均分倒入四个培养皿(d=9cm)中,让每个培养皿中含有2ml粗提物,18ml培养基。对照组为20%的乙醇,记为乙醇CK,和空白对照,培养基中不添加任何物质,记为白板。每个处理重复四次。
第五步 接种培养 待培养基冷却凝固,进行接菌。用直径为0.6cm的打孔器对供试菌种打取菌块,取菌块,用接菌环将菌块置于培养皿正中间位置,注意菌丝一面朝下,放置于培养箱(25℃)倒置培养。每组四次重复。
第六步 记录数据 生长48h后开始观察,用游标卡尺以十字交叉法测量菌落直径,并做好记录。
第七步 数据分析 参照下述计算公式,计算不同流分处理的抑制率。
菌落直径(cm):测量菌落直径平均值0.6
抑制率(%):(对照菌落直径-处理菌落直径)/对照菌落直径×100%
3 结果与分析
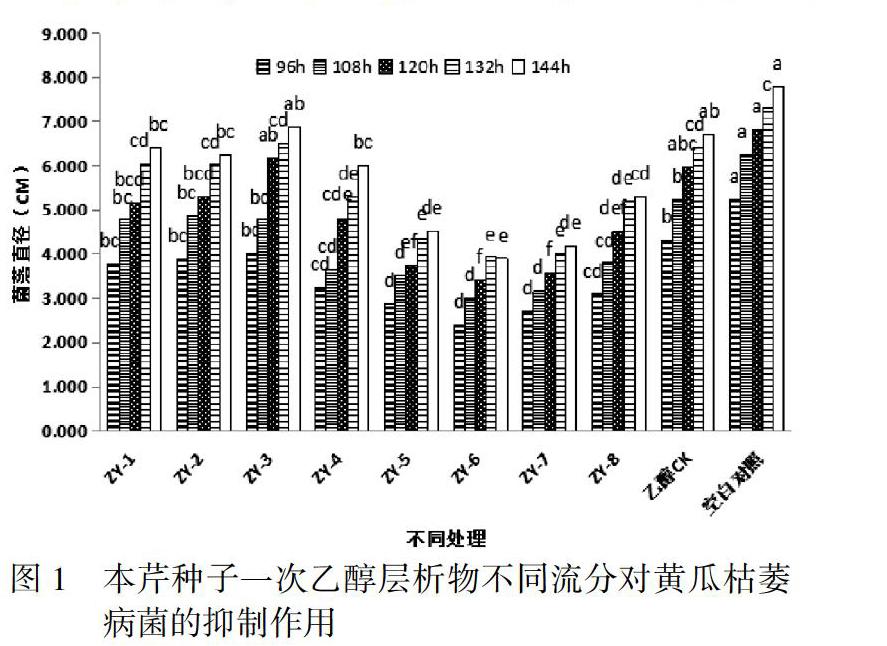
3.1 本芹种子一次乙醇层析物不同流分对黄瓜枯萎病菌的抑制作用
采用硅胶柱层析方法对本芹种子的乙醇层析物流分进行分离,总共得到8个流分,以黄瓜枯萎病菌为供试菌,分别测定了8个柱层析流分在48-144h的抑菌作用情况,8个流分处理的菌落生长情况均比对照组的菌落直径小。进而说明本芹种子一次乙醇层析物中含有对黄瓜枯萎病菌起抑制作用的化感物质。不同流分的抑菌作用情况不同,其中第6号流分(编号标记为ZY-6)在96-144h下菌落生长速度最慢,表现为抑制作用最大,且与对照组乙醇CK和空白对照差异显著(P<0.05)。如图1。
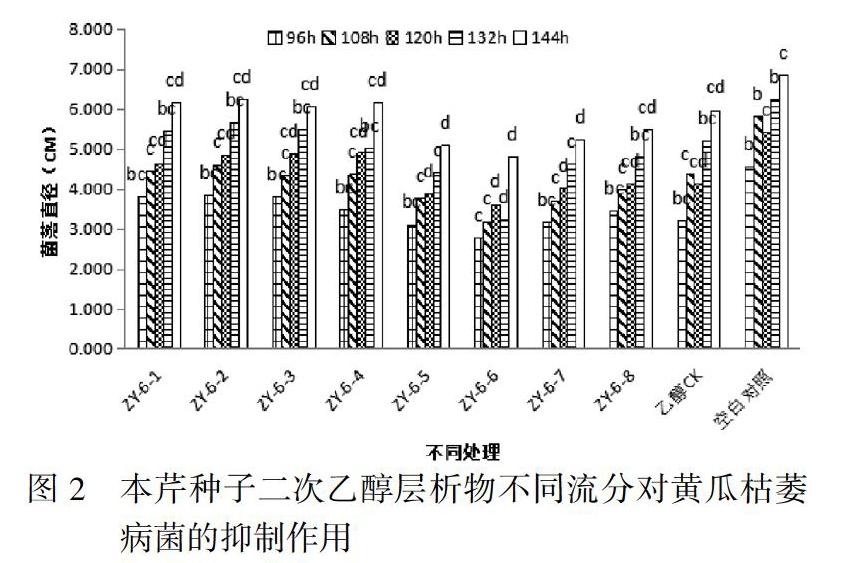
3.2 本芹种子二次乙醇层析物不同流分对黄瓜枯萎病菌的抑制作用
根据第一次实验结果,进行本芹种子第二次乙醇层析物不同流分对黄瓜枯萎病菌的抑制作用实验。对第一次实验选取的第6号流分(编号标记为ZY-6)通过硅胶柱层析,分离提纯出8个流分,分别标记为ZY-6-1~8,进行抑菌作用实验。结果显示,不同流分的抑菌作用情况不同,其中流分ZY-6-5和流分ZY-6-6对供试病菌的抑制率大于其他处理,表现为菌落生长较其他流分慢。流分ZY-6-5、流分ZY-6-6在96-144h时间下,菌落直径与对照组乙醇CK和空白对照差异显著(P<0.05)。如图2。
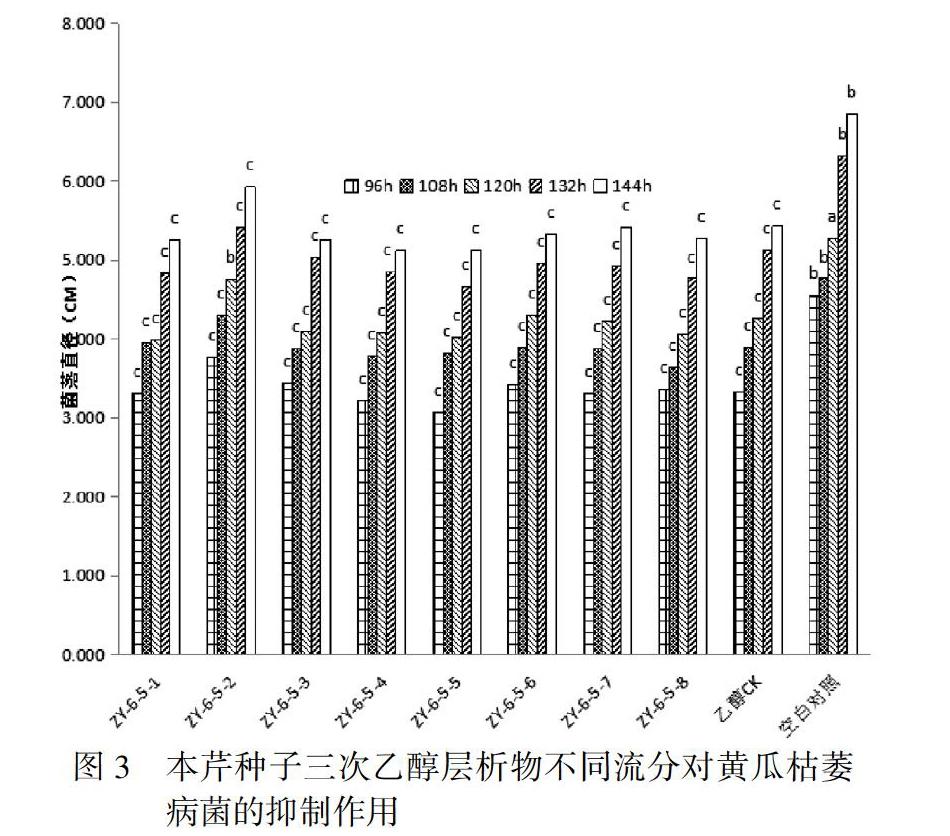
3.3 本芹种子三次乙醇层析物不同流分对黄瓜枯萎病菌的抑制作用
根据第二次实验结果,进行本芹种子第三次乙醇层析物不同流分对黄瓜枯萎病菌的抑制作用实验。对第二次实验选取的流分ZY-6-5通过硅胶柱层析,分离提纯出8个流分,分别标记为ZY-6-5-1~8,进行抑菌作用实验。结果表明,不同流分的抑菌作用情况不同,其中流分ZY-6-5-4和流分ZY-6-5-5对供试病菌的抑制率大于其他处理,表现为菌落生长较其他流分为慢。流分ZY-6-5-4、流分ZY-6-5-5在96-144h作用下,其菌落直径均与空白对照差异显著(P<0.05)。如图3。
根据上述试验结果,进行本芹种子第四次乙醇层析物不同流分对黄瓜枯萎病菌的抑制作用实验,对第二次实验选取的流分ZY-6-6通过硅胶柱层析分离提纯出8个流分,分别标记为ZY-6-6-1~8,进行抑菌作用实验,结果表明,不同流分的抑菌作用情况不同,其中流分ZY-6-6-6、流分ZY-6-6-7对供試病菌的抑制率大于其他处理,表现为菌落生长速度较其他流分为慢。流分ZY-6-6-6、流分ZY-6-6-7在96-144h作用下,均与空白对照差异显著(P<0.05)。如图4.
4 讨论与结论
芹菜(Apium graveolens L.)属伞形科一年生或二年生草本植物,又名药芹或旱芹[8]。在中国被广泛栽培,其嫩叶、叶柄可以食用,芹菜籽可药用。此外,芹菜因其具有特殊气味,可用来趋避和防治农业害虫。西芹粗提物防治黄瓜枯萎病[9]、旱芹粗提物防治棉花枯萎病[10]已被先后报道。韩燕[11]研究证实西芹根水浸提液对黄瓜枯萎病菌具有低促高抑现象。宋文超[12]实验结果表明,西芹鲜根丙酮、乙醇和蒸馏水粗提物可使黄瓜枯萎病菌菌丝生长受到抑制,病菌孢子数量分泌减少,从而揭示了化感作用机理。贾俊英[13]则对西芹种子粗提物进行了系统研究,结果表明,西芹三种粗提物对黄瓜枯萎病菌的抑制作用随着浓度增大而增强。高晓敏[14]对西芹乙醇粗提物进行四次柱层析,结果表明,第四次层析最佳流分抑制黄瓜枯萎病菌菌落生长及分泌镰刀菌酸能力。
本实验结果表明,本芹乙醇粗提物经过三次柱层析分离后,所得最佳流分亦能够抑制黄瓜枯萎病菌菌落生长。这与高晓敏的结论一致。分析原因可能为本芹和西芹都属伞形科芹菜属,二者理应含有一些相同的成分,而这些成分正是起到了抑制真菌菌落生长的作用。但本芹中抑制黄瓜枯萎病菌的物质究竟是什么,目前未知,有待于开展更为复杂、更为精细的实验进行研究。
——————————
参考文献:
〔1〕马斌.西芹种子浸提液对黄瓜枯萎病菌化感作用机理的研究[D].内蒙古农业大学,2010.
〔2〕鲁素云.植物病害生物防治学[M].北京:农业出版社,1993.
〔3〕王玲平.黄瓜感染枯萎病菌后生理生化变化及其与抗病性关系的研究[D].山西农业大学,2001.
〔4〕陈磊.西芹根物质与挥发物对黄瓜枯萎病菌的化感作用、机理及化感物质分离纯化的研究[D].内蒙古农业大学,2012.
〔5〕Blum U, Shafer S R. Microbial populations and phenolic acids in soil[J]. Soil Biology and Biochemistry, 1988, 20(06): 793-800.
〔6〕曾任森.化感作用研究中的生物测定方法综述[J].应用生态学报,1999,10(01):123-126.
〔7〕郝静,高晓敏,马立国,等.西芹根物质四次醇层物对黄瓜枯萎病菌的化感作用[J].内蒙古农业大学学报(自然科学版),2015,59(03):26-32.
〔8〕严建刚,张名位,杨公明,等.芹菜提取物清除自由基作用研究[J].食品科学,2004,25(08):39-42.
〔9〕张国华.盆栽下西芹根物质对黄瓜枯萎病菌的化感作用及其对相关酶的影响[D].内蒙古农业大学,2008.
〔10〕魏立强,谢慧琴,杨德松,等.旱芹粗提物控制棉花苗期枯萎病盆栽试验研究[J].中国棉花,2011,38(07):11-13.
〔11〕韩燕,云兴福.西芹根水浸提液对黄瓜枯萎病菌的化感作用[J].内蒙古农业大学学报,2007, 28(04):112-115.
〔12〕宋文超,贾俊英,云兴福.西芹鲜根浸提液对黄瓜枯萎病菌化感作用机理的研究[J].内蒙古农业大学学报,2010,31(03):100-105.
〔13〕贾俊英.西芹种子浸提液对黄瓜枯萎病菌化感作用及其机理的研究[D].内蒙古农业大学,2011.
〔14〕高晓敏,王琚钢,云兴福.西芹醇层物对黄瓜枯萎病菌的化感作用及化感物质鉴定[J].中国生物防治学报,2017,33(02):281-288.

