左侧星状神经节化学消融对犬急性心肌梗死后室性心律失常的影响
谢 轲 周明敏 何 燕 李棣文 刘 育
心脏性猝死(SCD)是心血管疾病所致死亡的主要原因之一,其常由急性心肌梗死(AMI)后恶性室性心律失常(VAs)所致。心脏交感神经的激活被认为是AMI后恶性VAs的重要因素之一[1]。既往研究表明,左侧星状神经节(LSG)干预(例如外科手术切除、化学物质损毁和局部神经阻滞等)抑制交感神经活性是预防AMI后恶性VAs发生的措施之一[2, 3]。瞬时电位感受器香草酸受体1(TRPV-1)是一种于神经组织中广泛表达的非选择性阳离子通道,既往研究发现TRPV-1在中枢神经组织中与酪氨酸羟化酶(TH)阳性神经元存在广泛共表达[4]。树胶脂毒素(RTX)能选择性损毁TRPV-1阳性的神经元,而不损伤周围,TRPV-1阴性的神经元[5,6]。因此,本研究旨在通过RTX微量注射化学损毁LSG中TRPV/TH阳性的交感神经元,探讨其对AMI后VAs发生和心脏电生理特性的影响。
材料与方法
1.实验动物及分组:本研究通过武汉大学人民医院医学伦理学委员会的批准(WSRM20171224)。健康成年雄性比格犬28只(体质量为9.5~11.0kg),购自北京玛斯生物技术有限公司并饲养于武汉大学人民医院动物中心。采用随机数字表法将28只犬随机分为3组:假手术组(8只)、AMI组(11只)和RTX组(9只)。实验犬使用3%戊巴比妥缓慢注入前肢浅静脉麻醉,随即气管插管,接大动物呼吸机(MAO01746,美国Harvard Apparatus公司)正压机械通气,肢体导联心电图(ECG)持续监测。每小时末添加2mg/kg戊巴比妥钠作为手术期间的维持剂量,并通过检查角膜反射来评估麻醉深度,所有手术操作均在麻醉状态下进行。通过股静脉鞘管向实验动物持续滴注0.9%氯化钠溶液(50~70ml/h)以补充体液丢失。犬的体温通过加热垫维持在36.5±1.5℃。左侧第二和第四肋间开胸,剪开心包缝制心包吊桥,操作过程中避免动物的肺部损伤并保证其湿润。通过右侧股动脉连接压力换能器持续监测血压。所有心电信号和血压信号均通过Lead-7000多导电生理仪系统(四川锦江电子公司)实时采集监测。
2.模型的建立:预先将1mg RTX(美国Sigma公司)溶于0.1ml DMSO(美国Sigma公司)中,配成10mg/ml的储存液。根据预实验的结果,使用前用等渗0.9%氯化钠溶液稀释至最终浓度(250μg/ml)。第2肋间开胸后,寻找并分离LSG,在直视下将总量为0.1ml的RTX多点注射至LSG中。对照组和AMI组犬微量注射不含RTX的溶剂。AMI组(溶剂注射后60min)和RTX组(RTX注射后60min)通过分离犬冠状动脉左前降支并于第1对角支以下结扎的方式建立AMI模型。通过观察ECG ST-T及心肌颜色的变化来确认AMI模型建立成功。对照组只分离穿线,不结扎冠状动脉。
3.VAs的观察:由多导电生理仪系统连续记录AMI后1h内VAs发生情况,对照组记录分离冠状动脉后1h的ECG改变。并将VAs分为室性期前收缩(VPB),室性心动过速(VT,≥3个连续VPB)和心室颤动(VF)等3种类型进行分析。
4.LSG功能评估:冠状动脉结扎后1h,在LSG不同部位发放高频电刺激进行试探性刺激,将刺激时血压升高最明显的部位定义为血压变化最大的位点,在此刺激位点固定刺激银丝,测定不同强度电压刺激(从2.5V开始,以2.5V逐步递增直至12.5V,刺激持续时间30s)LSG引起的最大收缩压变化百分比(MSBP%),以此评价LSG功能。
5.心脏电生理参数的测量:(1)有效不应期(ERP)及其离散度:将自制电极缝制于左心室表面,记录冠状动脉结扎后1h缺血区和非缺血区(对照组于对应时间记录心尖部和心底部)的ERP。通过程控期前刺激测量缺血区和非缺血区的ERP,其包括8个连续的S1刺激,起搏周长为300ms,此后再接一个S2刺激。S1-S2间隔从250ms逐渐减少10ms,当S2不能夺获心室时,从上一个S1-S2间隔起始以2ms递减直到最终无法夺获心室。ERP定义为未能夺获心室的最长S1-S2间期。ERP离散度定义为缺血区和非缺血区ERP的标准差/均数。(2)单向动作电位(MAP)的记录及相关分析:将自制刺激电极缝于左心耳上,采用300ms S1-S1周长固定起搏,用自制针状Ag-AgCI MAP记录电极分别记录结扎冠状动脉后1h缺血区和非缺血区(对照组于相应时间记录心尖部和心底部)的MAP,计算MAP复极90%的时程(MAPD90)。
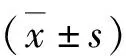
结 果
本研究中,对照组8只全部存活。AMI组3只,RTX组1只死于冠状动脉结扎后心室颤动(此4只犬仅纳入心室颤动发生率分析),其余犬均完成全部实验。
1.3组犬VAs发生情况比较:冠状动脉结扎后在实验犬ECG中均观察到ST段变化及VAs发生,包括VPB、VT及VF。与对照组比较,AMI组VPB、VT和VF发生率及VT持续时间显著增加(P<0.05)。与AMI组比较,RTX组显著减少AMI后VAs的发生(P<0.05,表1)。

表1 3组犬VAs发生的比较
2.3组犬LSG功能的比较:LSG功能被用于评估交感神经活性。3组犬LSG在不同电压刺激下所诱发的MSBP%见表2。与对照组比较,AMI组引起MSBP%显著增加;与对照组和AMI组比较,RTX组RTX处理显著降低MSBP%(P<0.05,表2)。

表2 3组犬LSG功能的比较
3.3组犬电生理指标的比较:与对照组比较,AMI组左心室缺血区ERP及MAPD90均显著缩短,ERP离散度和MAPD90离散度显著增加(P<0.05)。与AMI组比较,RTX组RTX处理延长左心室缺血区的ERP及MAPD90,减少ERP离散度和MAPD90离散度(P<0.05)。与对照组比较,AMI组非缺血区ERP和MAPD90比较差异无统计学意义(P>0.05),而RTX组ERP和MAPD90显著延长(P<0.05,表3)。

表3 3组犬ERP及其离散度、MAPD90及其离散度的比较
讨 论

本研究通过LSG微量注射RTX化学损毁TRPV-1/TH阳性的神经纤维,显著延长AMI后ERP和MAPD90并减小ERP和MAPD90离散度(表3)。因此,可以证明RTX处理获得了与交感神经阻滞相同的效果,即抑制交感神经活性,从而改善心脏的电不稳定性。综上所述,笔者可以推测RTX通过化学损毁LSG中TRPV-1/TH阳性的交感神经纤维,有效抑制LSG功能,从而改善心脏电生理稳定性并减少AMI后VAs的发生。
AMI后VAs的治疗是目前的研究热点,自主神经调节是AMI后VAs的治疗选择之一[15,16]。目前临床上调节自主神经平衡的手段有限,除了β受体阻滞剂一类的药物外,并无其他更好的方法。心脏交感神经切除术虽然有确切的效果,但因为容易出现各种并发症,包括血气胸、术后感染及Horner综合征等,此外对手术操作者的技术水平要求也很高,所以很少在临床上使用[17]。既往研究显示,去肾交感神经、迷走神经刺激及心房自主神经节刺激等能有效促进AMI后自主神经再平衡,但相关临床研究较少,仍需获取进一步的临床证据[18~20]。各种去LSG的方式包括手术、药物损毁(乙醇等)虽然可减少MI后VAs的发生,但也存在着一些问题,如LSG局部解剖复杂,神经血管丰富且功能关键,易造成不可逆转的损伤。而在本研究中,RTX是一种有效的TRPV-1激动剂,它通过使细胞内的游离钙大量增加,在短时间内诱导钙细胞毒性,快速清除TRPV-1阳性神经纤维,从而减少LSG中表达TH交感神经纤维数量。其他不表达TRPV-1的临近神经纤维或细胞将不受影响,包括少量TRPV-1阴性TH阳性神经纤维和卫星细胞[6]。此外,笔者采用星状微量注射来减小RTX干预出现解剖学脱靶的概率以及对血压和心率的影响,就其特异性、安全性及有效性,RTX化学消融LSG中TRPV-1/TH阳性的交感神经纤维为AMI后VAs的预防及治疗提供了一个新的选择。
本研究存在的不足之处:(1)笔者没有进行RTX处理LSG前后 TRPV-1/TH阳性神经元的定量分析,没有得到RTX处理后交感神经减少的直接证据。其次,TH阴性而TRPV-1阳性神经纤维的生理作用尚不清楚,这可能需进一步研究。(2)笔者的研究仅限于RTX神经节内微量注射对AMI模型的短期影响,它对心脏电生理、自主神经系统及心脏重构的长期影响仍需要在未来的研究中得到印证。(3)未评估达到最佳抗心律失常和最小不良反应的RTX浓度。

