smad1/5信号通路在诱导多能干细胞成釉分化中的作用研究
刘 治 覃文聘 高 鹏 谭 蕾 张乐琪
诱导多能干细胞(induced pluripotent stem,iPS)被认为是实现牙齿再生的一种新的干细胞来源,其来源于患者自体成熟细胞,因此成功克服了细胞来源受限、伦理和免疫排斥上的障碍,具有良好的临床应用前景。研究显示,iPS细胞可被诱导分化为神经细胞、胰岛素分泌细胞、心血管和造血细胞、肝脏、肾脏等细胞[1]。Liu等[2]近期研究表明,iPS细胞可在成釉细胞无血清条件培养基(ameloblast serum-free conditioned medium,ASF-CM)诱导下,分化为成釉细胞样细胞,并表达成釉细胞标志物成釉蛋白(ameloblastin,AMBN)及细胞角蛋白-14(cytokeratin-14,CK14);当在ASF-CM中添加骨形态发生蛋白4 (morphogenetic protein 4,BMP4)可显著促进iPS细胞的成釉分化,而加入了BMP抑制剂noggin则可显著抑制iPS细胞的成釉分化,表明BMP家族分子在iPS细胞成釉分化过程中发挥关键调控作用。然而,iPS细胞成釉分化过程中的信号转导通路目前仍不清楚。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)属于转化生长因子β(transforming growth factor β,TGF-β)家族成员,是一组能广泛参与调节多种细胞的增生、迁移、分化和凋亡的生物学过程的功能蛋白,其在早期胚胎发生和随后的器官形成中发挥关键调控作用。BMP信号通过激活其受体磷酸化smad1、5、8蛋白,从而启动细胞内信号转导,继而直接或间接通过 DNA 结合蛋白或重新合成蛋白质来调节靶基因的转录。此外,有研究显示BMPs也可直接激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路,其中,ERK1/2信号转导通路主要调控细胞生长与分化,JNK和 p38 MAPK 信号转导通路参与炎症、细胞凋亡等应激反应[3]。然而,smad与MAPKs信号通路在iPS细胞被诱导向成釉细胞分化过程中的调控作用,目前仍未见文献报道。
本研究采用ASF-CM诱导iPS细胞成釉分化,检测分化过程中smad1/5与MAPKs信号分子磷酸化水平,并观察smad1/5或MAPKs通路抑制剂对iPS成釉分化的影响,从而探明smad1/5与MAPKs信号通路在iPS细胞成釉分化中的作用。
材料与方法
1.实验材料:小鼠C5系iPS细胞购自中国科学院广州生物医药与健康研究院。成品上皮细胞培养液购自美国Sciencell公司,smad1/5通路抑制剂LDN-193189购自美国Selleck公司,p38 MAPK通路抑制剂SB203580及ERK1/2通路抑制剂U0126,以及phospho-smad1/5、phospho-p38、total-p38、phospho-ERK1/2、total-ERK1/2、phospho-JNK、total-JNK及GAPDH抗体均购自美国Cell Signaling Technology公司。RIPA细胞裂解液及BCA蛋白定量试剂盒购自上海碧云天生物科技有限公司,RNeasy Mini kit试剂盒购自美国Invitrogen公司,反转录试剂盒(DRR037A)及SYBR法实时定量PCR试剂盒购自日本TaKaRa公司,Oct-4、SSEA-4、SSEA-1、AMBN、ENAM和CK14抗体均购自美国Santa Cruz 生物技术公司,MTT检测试剂盒(C0009)购自上海碧云天生物技术公司。
2.实验方法:分离培养小鼠胚胎成纤维细胞:将怀孕12.5~14.5天 C56孕鼠断颈处死,无菌条件下取出胎鼠,小心分离其躯干并置于盛有PBS的平皿内,充分洗涤弃除红细胞。用无菌眼科剪剪碎鼠胚躯干,加适量胰酶37℃消化30min后终止消化,常规离心弃上清,加适量含10%胎牛血清的DMEM培养液,反复吹打后接种置细胞培养瓶中,37℃、5%CO2、饱和湿度培养,培养6天后传代。
3.制备iPS细胞滋养层:将丝裂霉素(10μg/ml)加入到上述长满胚胎成纤维细胞的培养瓶中孵育3h,吸弃废液PBS充分洗涤后,加入0.25%胰酶消化。在显微镜下观察,当贴壁细胞层出现裂隙且有少量细胞漂浮时,用移液管反复吹打瓶底,加含血清培养液终止消化,常规离心后弃上清,以3.0×104/cm2密度铺在经0.1%明胶溶液预处理的培养瓶中,于培养箱中静置过夜,使细胞贴壁。铺好的饲养层在7 天内可有效支持iPS细胞的生长并维持其全能性。
4.培养小鼠iPS细胞:于37℃水浴中迅速解冻iPS细胞,将细胞悬液吸至加有少量PBS的离心管中,常规离心弃上清,加入6ml含10%胎牛血清的DMEM培养液,吹打混匀为单细胞悬液,并移至已铺好饲养层细胞的培养瓶中,37℃、5%CO2、饱和湿度培养,每天换液,观察克隆的大小和密度,一般在培养后的第3 天可进行传代。
5.成釉细胞无血清条件培养基(ASF-CM)的制备:断颈处死出生7天的C57 仔鼠20只,无菌分离仔鼠下颌骨, PBS冲洗干净后分离其下颌切牙牙胚,在体视学显微镜下用显微镊剥离成釉上皮,浸泡于含 10%胎牛血清的DMEM培养液中。剪碎组织后加入2ml Ⅰ型胶原酶,于37℃消化1h,终止消化后常规离心,弃上清,加入无血清的上皮细胞培养液,以1×105/ml密度接种于培养瓶内,37℃、5%CO2、饱和湿度培养。待细胞贴壁后,采用差别消化法纯化上皮细胞,首先加入0.25%胰酶消化细胞5min,倒置显微镜下观察到成纤维样细胞完全脱壁,此时加入含血清培养基终止消化,PBS反复冲洗后加入无血清的上皮细胞培养液继续培养。可重复此法,直至贴壁的完全是上皮细胞而没有成纤维细胞。当成纤维样细胞全部去除后,开始收集成釉细胞无血清条件培养液(ASF-CM),避光条件下用无血清上皮细胞培养液每天换液1次,置换出来的ASF-CM用小滤器过滤后-80℃冷藏备用。为确保实验的可重复性,将所有ASF-CM混匀后分装,用于下述实验。
6.iPS细胞诱导分化及通路阻断:以1∶1体积比配制ASF-CM与iPS常规培养液混合液(ASF-CM),分别在上述混合液中加入200nmol/L LDN-193189(smad1/5通路抑制剂),或10μmol/L SB203580 (p38 通路抑制剂) 或 10μmol/L U0126 (ERK1/2通路抑制剂),采用ASF-CM或加入上述通路抑制剂的ASF-CM培养iPS细胞,2天换液1次,以常规iPS培养液培养作为阴性对照,培养14天后收集细胞,进行下述蛋白及基因检测。
7.Western blot法检测蛋白表达量:RIPA裂解细胞30min,4℃高速离心取上清,BCA蛋白定量法测定样品总蛋白浓度;取各组蛋白样品40μg用体积分数为10%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行凝胶电泳后,再以半干法转印到PVDF膜上,5.0%脱脂牛奶封闭 1h,然后分别加兔抗小鼠phospho-smad1/5、GAPDH、phospho-p38、total-p38、phospho-ERK1/2、total-ERK1/2、phospho-JNK及total-JNK一抗(1∶1000,美国Cell Signaling Technology公司),4℃孵育过夜;TBST洗膜后,滴加辣根过氧化物酶标记的羊抗兔二抗(1∶5000,北京中杉金桥生物技术公司)室温孵育1h;TBST再次洗膜后,ECL化学发光试剂显影,化学发光凝胶成像系统检测蛋白条带,并计算蛋白的相对表达水平。
8.实时定量PCR:RNeasy Mini kit试剂盒提取样品总RNA,反转录试剂盒反转录合成cDNA,再以cDNA为模板,以GAPDH为内参照,采用SYBRⅡ试剂盒检测各组细胞Ambn、ENAM及Ck14 mRNA的表达水平,反应条件严格按产品说明书进行;所用引物均由日本TaKaRa公司合成,具体引物序列见表1。最后以目的基因与 GAPDH 的起始拷贝数的比值表示目的基因的相对表达量。实验重复3次。
9.免疫荧光染色:4%多聚甲醛固定细胞15min,PBS洗后滴加0.25% Triton X-100,37℃孵育15min,PBS洗后加入4%山羊血清孵育30min,不冲洗,甩干后直接加入相应一抗 (1∶100),4℃孵育过夜;PBS洗3次, 滴加FITC或Rhodamine标记的二抗(1∶200),37℃避光孵育30min;5μg/ml DAPI衬染细胞核2min,Olympus 荧光显微镜观察及DP Manager软件处理图。

表1 PCR引物序列
10.MTT实验:分别在上述阻断实验进行1、7、14天时,在细胞培养孔中加入MTT 溶液(5mg/ml)20μl,继续孵育4h,每孔加入100μl Formazan溶解液并混匀,继续孵育使结晶物充分融解,选择 570nm 波长,在酶标仪上测定各孔吸光度值,记录结果。
11.统计学方法:采用SPSS 11.0统计学软件对数据进行方差分析,采取盲法获取及计算以上数据,即由两个对实验设计不了解的实验员各计数2次,并间隔1周。经标准一致性检验显示,两人所得数据高度吻合(r>0.9),因此两人计数的平均值被用于统计分析。采用SNK-q检验进行两两亚组间比较,以P<0.05为差异有统计学意义。
结 果
1.Western blot法检测:用于实验的ips细胞表达胚胎干细胞特异性标记分子SSEA-4及Oct-4,阳性细胞百分比均高于95%,但不表达分化的胚胎干细胞标志物SSEA-1(图1),表明其具有胚胎干细胞样特性。本实验采用Western blot法检测磷酸化的smad1/5及MAPKs通路分子的表达。结果显示,经ASF-CM处理的iPS细胞p-smad1/5 (6.1±1.3)、p-P38 (3.2±0.6)以及p-ERK1/2 (4.1±0.8)的表达较对照组显著升高(图2、图3),但其p-JNK表达水平与对照组比较,差异无统计学意义(t=0.67,P=0.61)。

图1 iPS细胞免疫荧光染色及阳性细胞定量(×40)Oct-4与SSEA-4为胚胎干细胞特异标记分子,SSEA-1为分化的胚胎干细胞标志物
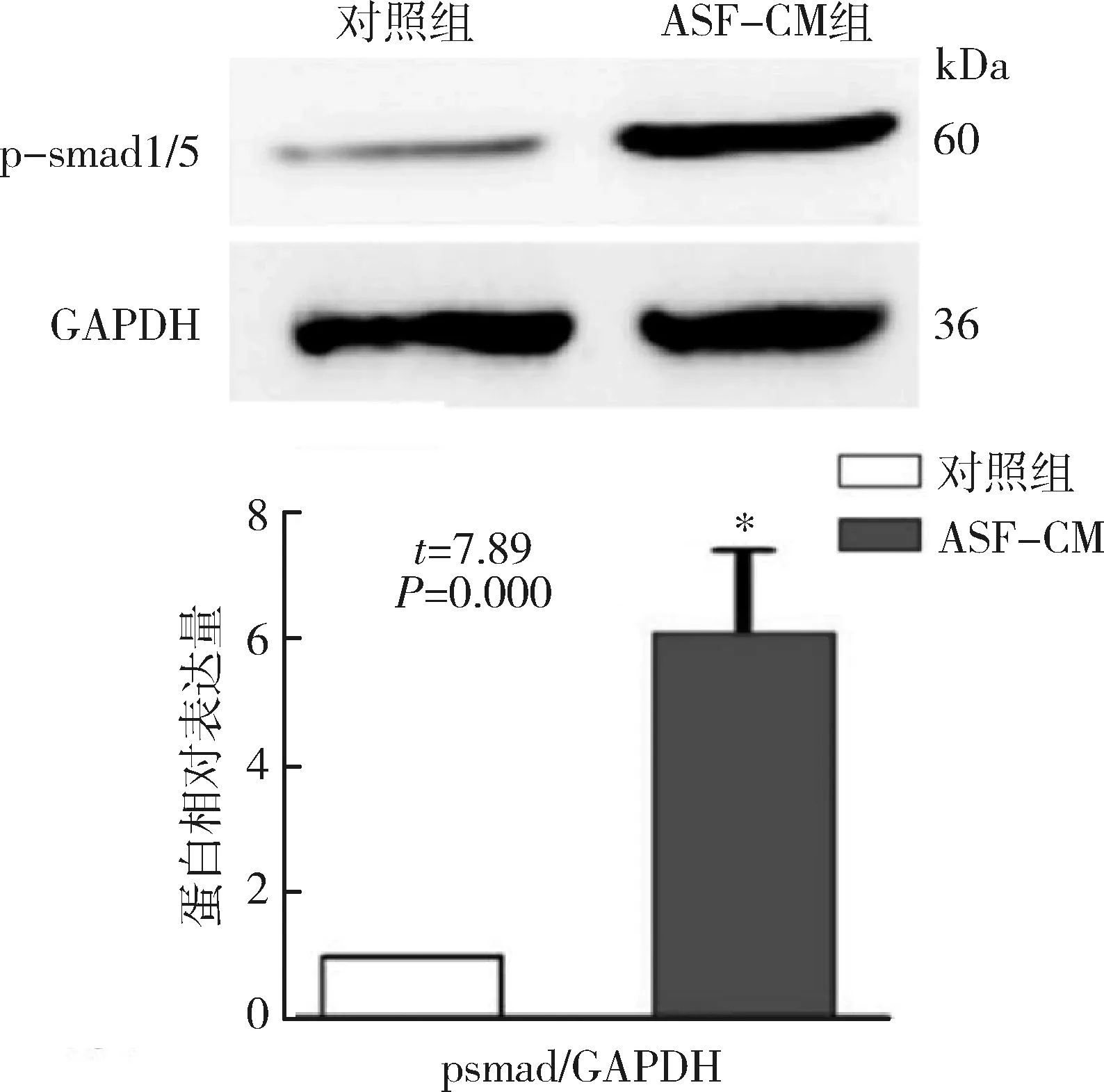
图2 Western blot法检测及定量对照培养基或ASF-CM培养iPS细胞后p-smad1/5蛋白表达水平与对照组比较,*P<0.01
2.实时定量PCR结果:分别将smad1/5、P38以及ERK1/2信号通路抑制剂加入到ASF-CM中培养iPS细胞14天,并以对照培养基或ASF-CM培养的iPS细胞作对照,检测iPS细胞成釉细胞特异性标志物(Ambn、ENAM和Ck14)基因的表达。对照组、ASF-CM组、ASF-CM+LDN-193189组、ASF-CM+SB203580组及ASF-CM+U0126组iPS细胞Ambn(F=4.290,P<0.05)、ENAM(F=3.620,P<0.05)和Ck14(F=3.110,P<0.05)的表达比较,差异有统计学意义,其中ASF-CM组iPS细胞Ambn(6.6±1.3)、ENAM(5.4±0.9)和Ck14 mRNA(5.9±1.1)的表达较对照组显著增高(P<0.05),smad1/5抑制剂LDN-193189可显著反转ASF-CM的上述促iPS细胞成釉分化的效应,表现为ASF-CM+LDN-193189组iPS细胞Ambn(2.4±0.5)、ENAM(1.9±0.6)和Ck14 mRNA(1.4±0.4)的表达较单纯ASF-CM组显著降低(P<0.05,图4),但仍旧高于对照组(P<0.05)。然而,p38 MAPK通路抑制剂SB203580及ERK1/2通路抑制剂U0126则对ASF-CM促iPS细胞成釉分化的效应无显著影响,表现为ASF-CM+SB203580组及ASF-CM+U0126组iPS细胞Ambn(SB203580组:6.1±1.1;U0126组:5.9±0.8)、ENAM(SB203580组:4.8±0.9;U0126组:5.1±0.5)和Ck14 mRNA(SB203580组:5.3±1.2;U0126组:4.9±0.6)的表达与单纯ASF-CM组比较,差异无统计学意义(P>0.05,表2)。

图3 Western blot法检测及定量对照培养基或ASF-CM培养iPS细胞后MAPKs通路分子蛋白表达水平与对照组比较,*P<0.01
3.免疫荧光染色结果:采用对照培养基培养的iPS细胞基本不表达成釉细胞特异性标志物Ambn、ENAM及Ck14,ASF-CM组及ASF-CM+抑制剂组iPS细胞均可表达Ambn、ENAM及Ck14蛋白,主要表达在胞核及胞质(图4)。定量研究结果显示对照组、ASF-CM组、ASF-CM+LDN-193189组、ASF-CM+SB203580组及ASF-CM+U0126组iPS细胞Ambn(F=44.190,P<0.05)、ENAM(F=52.160,P<0.05)和Ck14(F=40.680,P<0.05)阳性细胞百分比组间比较,差异有统计学意义,其中ASF-CM组iPS细胞Ambn(46.6±11.3)、ENAM(51.4±10.9)及Ck14(41.9±8.1)阳性细胞百分比均较对照组显著增高(P<0.05),smad1/5抑制剂LDN-193189可显著逆转ASF-CM诱导iPS细胞成釉分化的作用,表现为ASF-CM+LDN-193189组iPS细胞Ambn(8.4±0.5)、ENAM(6.9±0.6)和Ck14 (4.4±0.4)阳性细胞百分比均较单纯ASF-CM组显著降低(P<0.05),但仍高于对照组(P<0.05)。ASF-CM+SB203580组及ASF-CM+U0126组iPS细胞Ambn(SB203580组:44.1±8.1;U0126组:45.9±8.8)、ENAM(SB203580组:49.8±10.9;U0126组:50.1±7.5)和Ck14(SB203580组:38.3±9.2;U0126组:40.9±10.6)阳性细胞百分数与单纯ASF-CM组比较,差异无统计学意义(P>0.05,表3)。

表2 实时定量PCR检测
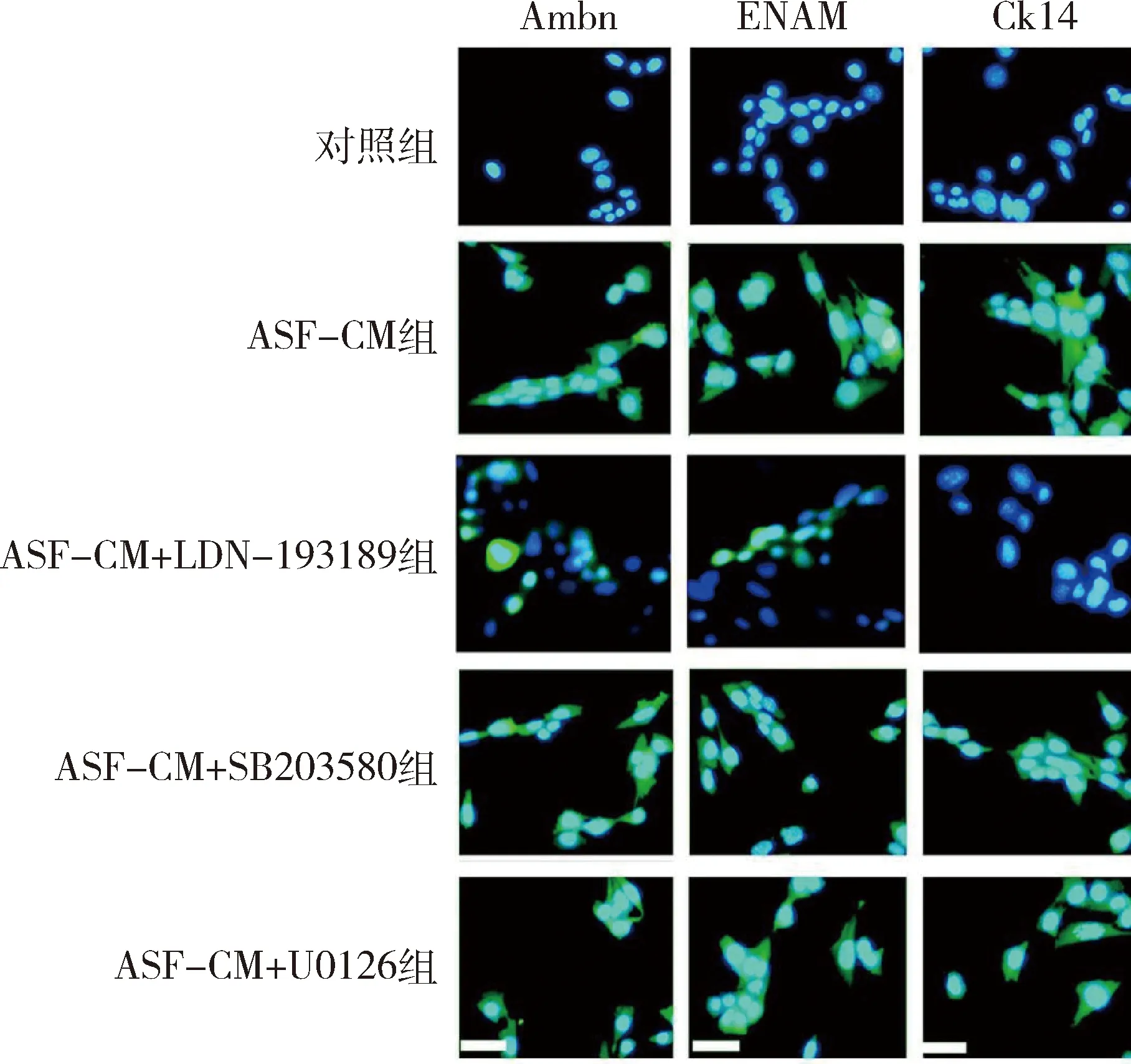
图4 免疫荧光染色观察(×40)
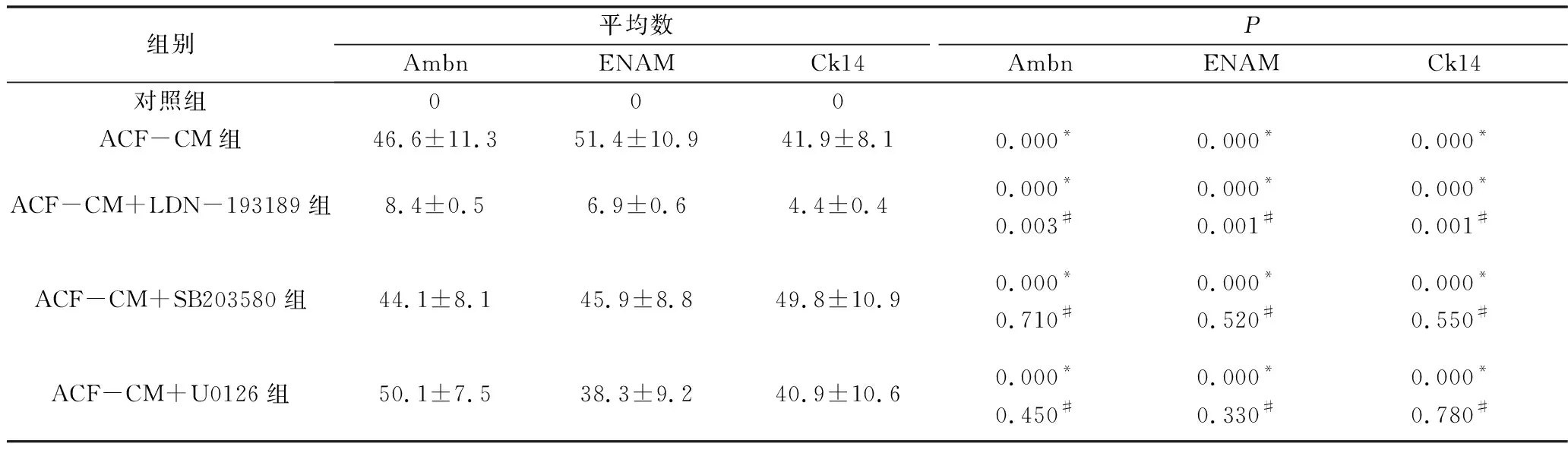
表3 免疫组化半定量比较
4.MTT结果:不同培养基组在不同时间下A值差异有统计学意义(不同培养基因素F=2.12,P<0.05,时间因素F=5.33,P<0.05,交互效应F=3.01,P<0.05)。采用对照培养基或ASF-CM培养iPS细胞1天(对照组:0.20±0.03;ASF-CM组:0.18±0.02)及7天(对照组:0.50±0.10;ASF-CM组:0.46±0.14),两组间iPS细胞增生活动在不同时间点比较差异均无统计学意义(P>0.05),当培养14天时,ASF-CM组iPS细胞增殖活动较对照组显著降低(对照组:0.78±0.06;ASF-CM组:0.56±0.11;P<0.05)。然而,在ASF-CM组中加入smad1/5、P38或ERK1/2信号通路抑制剂组iPS细胞增殖活动与单纯ASF-CM组细胞在1、4、7天比较,差异无统计学意义(P>0.05,图5)。
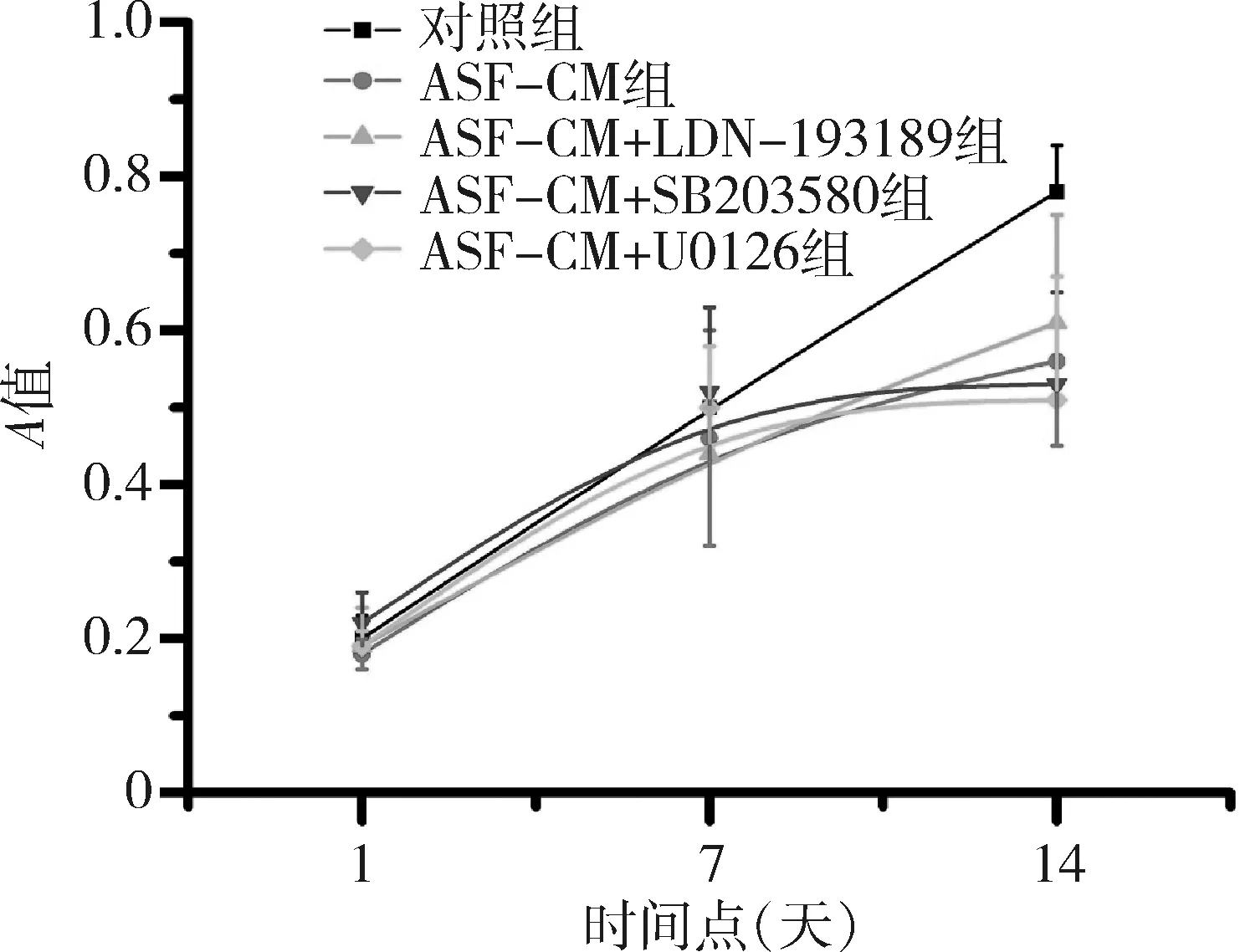
图5 MTT实验检测
讨 论
用于牙齿再生的干细胞主要包括牙源性干细胞和非牙源性干细胞,前者包括牙髓干细胞、牙周膜干细胞及脱落乳牙干细胞等,但由于患者特异性的牙源性干细胞的来源及细胞数量有限,限制了其在临床上的广泛应用[4~6]。非牙源性干细胞包括骨髓间充质干细胞、胚胎干细胞及iPS细胞等,其中骨髓间充质干细胞仍存在来源有限的问题[7];而胚胎干细胞长期受着伦理上的争议以及免疫排斥的缺陷,也不适合应用于临床治疗[8,9]。
本实验所采用的iPS细胞来源于成熟体细胞,因此克服了细胞来源受限、伦理和免疫排斥上的障碍,具有良好的临床应用前景[1]。Arakaki等[10]通过分离小鼠下切牙根尖端颈环组织构建了牙源性上皮细胞系,并将该上皮细胞与鼠源性iPS细胞共培养,结果显示上皮细胞可显著诱导iPS细胞分化为成釉细胞样形态,并表达Ambn、ENAM及Ck14等多种成釉细胞标志物;然而,Yoshida等[11]研究发现,相较于将Malassez上皮剩余细胞与iPS细胞共培养,采用Malassez上皮剩余细胞的条件培养基培养iPS细胞能够更有效地诱导其形成成釉细胞样细胞。Liu等[2]证明了成釉细胞无血清条件培养液(ASF-CM)可高效诱导iPS细胞向成釉细胞方向分化,表达成釉细胞标志物Ambn及Ck14。本实验结果显示ASF-CM 培养iPS细胞14天后,其成釉细胞标志物Ambn、ENAM和Ck14基因和蛋白表达水平均较对照组增高,这与Liu等[2]之前的结果一致。这些结果表明,利用成釉细胞条件培养基培养iPS细胞可诱导其分化为更接近成釉细胞的成熟细胞。牙齿的发育和形成是非常复杂生理过程,受到多种生长因子的调控,而这种动态过程不太可能仅由某种因子进行控制[12~15]。因此,本研究采用ASF-CM诱导iPS细胞成釉分化,已有实验证实ASF-CM包含BMPs、TGF-βs、Notch 1、纤维细胞生长因子等多种细胞因子[2,16~18]。然而,本研究并未鉴定本实验所采用的ASF-CM中的活性细胞因子成分,为了保证实验结果的重复性,实验中将所获得的ASF-CM混合在一起用于后续实验,从而确保实验的可重复性,后续实验可采用ELISA检测法鉴定ASF-CM中的活性细胞因子成分。
研究显示,BMPs是有效诱导iPS细胞分化的必要生长因子[19]。尽管smad1/5的激活被认为是BMPs经典信号转导通路,但研究显示BMPs亦可激活MAPKs信号通路,包括p38 MAPK、ERK1/2及JNK[20]。本实验结果显示,成釉细胞条件培养基培养iPS细胞14天后,可显著促进磷酸化smad1/5、P38和ERK1/2分子的表达,表明上述通路被激活。进一步信号通路抑制剂阻断实验结果显示,仅smad1/5抑制剂LDN-193189可显著反转ASF-CM促iPS细胞成釉分化的效应,而p38 MAPK及ERK1/2通路抑制剂对ASF-CM促iPS细胞成釉分化的效应均无显著影响。上述结果表明smad1/5信号通路在ASF-CM诱导的iPS细胞的成釉分化过程中发挥主要调控作用。后期实验中应采用体内功能验证实验进一步证实smad1/5信号通路在iPS细胞成釉分化过程中的作用。
P38 MAPK通路已被证实在BMP2及BMP7介导的牙齿发育中发挥重要调控作用[21,22]。例如调控胚胎期釉质结节p21的表达,以及成釉细胞成釉蛋白、釉质素及整合素-4的表达;外胚层P38敲除小鼠则表现出牙釉质缺陷和牙尖缺失[23]。ERK 1/2通路被证实在TGF-β1介导的组织增长,胶原蛋白改建以及牙源性干细胞分化发挥关键调控作用。由于ASF-CM中含有BMP2、BMP7、TGF-β1等细胞因子,本实验在后续研究中将进一步探明P38及ERK 1/2通路在ASF-CM诱导iPS细胞成釉分化中的作用。
综上所述,本研究结果显示smad1/5信号通路在ASF-CM诱导的iPS细胞成釉分化过程中发挥关键调控作用。后期需要体内实验进一步证实smad1/5信号通路对iPS细胞成釉分化的影响及相关机制。

