子宫腺瘤样瘤67 例临床病理分析
陈勇,冯艺,赵彩霞,汪勤,唐曼,张卫琴,刘婷珽,娄蓉,张和平
子宫腺瘤样瘤(Adenomatoid Tumors,ATs)是一种少见的间叶来源的良性肿瘤,常发生于生殖道,也可发生于肾上腺及腹膜等其它部位[1-3]。在女性生殖系统中,腺瘤样瘤常发生于子宫,也可发生于输卵管及卵巢[4,12]。发生于子宫的腺瘤样瘤由于临床特征、影像学特点及大体形态与子宫平滑肌瘤或腺肌瘤难以区分,组织学特征有其多样性,特别是出现假血管样或假腺样特征时,往往会引起诊断上的困难[5-6]。本研究收集 67 例子宫 ATs 病人的临床病理资料,探讨其临床病理学特征、免疫表型、鉴别诊断及治疗和预后。
子宫腺瘤样瘤67 例临床病理分析
(正文见1992页)
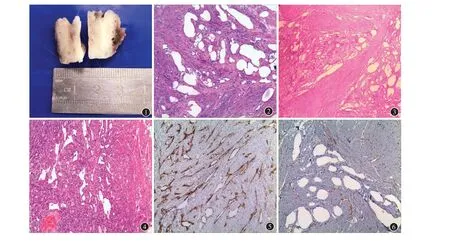
图1 子宫腺瘤样瘤(ATs)外观湿润,切面灰白色,见细小囊腔 图2 子宫腺瘤样瘤(ATs)由不规则管腔样结构构成(HE×100) 图3 子宫腺瘤样瘤(ATs)腺管样结构排列紊乱(HE×100) 图4 子宫腺瘤样瘤(ATs)肿瘤组织中管腔样结构呈乳头状(HE×100) 图5 子宫腺瘤样瘤(ATs)上皮样细胞Calretinin(+)(免疫组化EnVision二步法×100) 图6 子宫腺瘤样瘤(ATs)上皮样细胞CD34(-)(免疫组化EnVision二步法×100)插图10-2
1 资料与方法
1.1 一般资料收集安徽医科大学附属妇幼保健院病理科2012年1月至2018年1月诊断为子宫ATs的病例67例。病人对所受治疗均知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。所有切片均由两位病理专家复阅。
1.2 方法所有标本均由10%中性福尔马林固定,常规脱水,石蜡包埋,HE 染色及免疫组化EnVision二步法染色。免疫组化所用一抗细胞角蛋白广谱抗体(CKAE1/AE3)、钙网膜蛋白(Calretinin)、跨膜唾液酸糖蛋白(D2-40)、细胞角蛋白(CK5/6)、肿瘤增殖抗原(Ki-67)、高度糖基化的i 型跨膜糖蛋白(CD34)和二抗均购自北京中杉金桥公司。具体操作步骤按试剂盒说明进行。
2 结果
2.1 临床特点67 例子宫ATs 病人年龄范围24~64 岁,中位年龄39岁。临床表现非特异性,其中23例(34.3%)表现为不规则阴道流血,6例(9.0%)表现为腹部包块,2 例(3.0%)表现为腹部疼痛,13 例(19.4%)为影像学提示子宫肿瘤,其余23例(34.3%)病人均因其它疾病入院偶然发现。其中18例为妊娠剖宫产合并,2例合并卵巢囊肿,1例合并宫颈鳞状细胞癌,1例合并子宫内膜癌,1例为异位妊娠合并。67例病人行全子宫切除术23例,肿瘤剔除术44例。
2.2 病理检查
2.2.1眼观 67 例子宫ATs 外观与子宫平滑肌瘤类似,其中 34 例(50.7%)为单纯性 ATs,33 例(49.3%)为混合性ATs,合并子宫平滑肌瘤或腺肌瘤。单纯性 ATs 中,29 例(85.3%)为单发,5 例(14.7%)为多发(均为2 枚)。肿瘤位于子宫肌壁间37 例(55.2%),位于浆膜下30 例(44.8%)。本研究中66 例呈结节状(直径1.0~8.0 cm),平均直径2.7cm,肿块切面灰白或灰褐色,实性,质韧,部分呈黏液感或细小囊腔样,与周围组织界限不清(图1);1例呈巨大囊实性(直径12.0 cm),切面灰白色,见多量大小不等的囊腔,质地松软似海绵。
2.2.2镜检 肿瘤由大小不等的管腔样结构构成,被覆扁平或立方上皮细胞,呈单个或巢状分布,周围围绕平滑肌组织、胶原及弹力纤维等(图2)。大的管腔上皮样细胞挤压呈扁平状,衬附于腔隙内缘;小的管腔上皮样细胞呈脂肪空泡状,有的核偏位,呈印戒样。少数病例管腔内含淡蓝色黏液样物。其中1 例镜下见腺管样结构排列紊乱,似浸润性生长于平滑肌组织间(图3)。巨大囊实性肿块由不规则扩张性管状腔隙构成,部分腔隙呈乳头状(图4)。67例病例中其中1例肿瘤间质见灶状淋巴细胞浸润。所有病例肿瘤细胞均无明显异型性,细胞增殖指数低。
2.2.3免疫 表型免疫组织化学染色示上皮样细胞表达CKAE1/AE3、Calretinin、D2-40、CK5/6,其阳性表达分别为67 例(100%)、67 例(100%)、67 例(100%)、13 例(19.4%),Ki-67 增殖指数低,约1%~5%,CD34在上皮样细胞中不表达(图5,6)。
2.2.4随访 67例病例共随访56例,失访11例,随访时间范围12~84 个月,平均随访时间36 个月。随访病人中均无肿瘤复发或恶变。
3 讨论
ATs最初被描述为良性间叶性肿瘤,后由Golden 和Ash 于1945 年正式命名,用来描述一类良性、偶发、边界较清且间叶来源的肿瘤[2]。研究的早期,不少学者提出ATs的苗勒氏管、血管、淋巴管等组织起源。随着研究深入,有学者通过电镜观察及免疫组化研究发现肿瘤细胞具有明显的微绒毛、桥粒等间皮细胞的特征,间皮标记物染色阳性,证实其为间皮来源[7-8]。子宫ATs 可能是间皮细胞向下凹陷迷走于子宫内或胚胎发育过程中腹膜间皮细胞残留于子宫内而引起的[7,9]。最新WHO女性生殖系统已明确子宫ATs来源于子宫浆膜的间皮细胞[10]。
子宫ATs 常发生于育龄妇女,无相关特异性症状,通常因其它原因切除的子宫中偶然发现,约占子宫切除或肿瘤剔除标本的1.4%[11]。本研究67例病人的中位年龄为39 岁,临床症状缺乏特异性,大多表现为不规则阴道流血、腹部包块、腹部疼痛或合并其他疾病偶然发现。肿瘤发生于子宫浆膜下或肌壁间,最小者直径1.0 cm,最大者直径12.0 cm,除最大者为囊实性,其余均为结节状,肿块切面灰白或灰褐色,质韧,类似平滑肌瘤,少数肿块切面有黏液感,可伴微小囊腔。
子宫ATs通常境界不清,存在弥漫性生长,其弥漫性生长的原因多与器官移植、应用免疫抑制剂有关[12-13]。ATs 由不同大小和形状的管腔样结构组成。管腔样结构被覆扁平或立方上皮细胞[14],较大的管腔衬附上皮可不明显,小的管腔难与腺癌相区分。本研究中巨大囊实性肿物镜下除可见不规则扩张性管状腔隙,还可见少量粗短的乳头状结构。巨大囊实性子宫ATs 极为罕见,Nogales 等[9]报道了4例巨大子宫ATs,直径范围7.0~11.0 cm,切面可见多个扩张囊腔,其中2 例镜下可见上皮样细胞呈乳头状生长。这些肿瘤大多突出于子宫表面,具有明显的囊腔结构,切面呈海绵状[12]。所有病例上皮样细胞异型性不明显,核分裂像罕见。有些病例中腔隙内可见稀薄淡蓝色黏液样物,经特染证实为上皮样细胞分泌透明质酸形成[12,15]。部分肿瘤间质中可见淋巴细胞浸润,偶可形成淋巴滤泡。Sangoi 等[2]研究显示约13%女性生殖道ATs 中出现淋巴细胞,而男性生殖道ATs中均可见。本研究中有1例肿瘤间质中出现灶性淋巴细胞浸润。
Calretinin、D2-40及CK5/6是重要的间皮组织来源标记物[16-17],CKAE1/AE3为一广谱角蛋白标记物,而CD34主要表达于血管内皮及其他血管源性肿瘤或软组织肿瘤。本研究中行免疫组化检测CKAE1/AE3、Calretinin、D2-40、CK5/6、CD34及Ki-67在肿瘤中的表达,发现CKAE1/AE3、Calretinin、D2-40、CK5/6 的表达率分别为100%、100%、100%、19.4%,提示上皮样细胞来源于间皮细胞。CD34 在上皮样细胞中不表达,提示管腔样结构并非血管。Ki-67增殖指数低,范围为1%~5%,提示肿瘤是一种惰性的经过。廖谦和等[18]提出AB-PAS 染色对子宫ATs 的诊断有辅助作用。当然,典型子宫ATs形态学特征就可以诊断,但是当肿瘤细胞出现罕见特征时,如假腺样、乳头状时,运用一组免疫组化标记物会有助于诊断。
目前,对腺瘤样瘤分子机制的研究较少。Goode等[13]通过对31例男性和女性生殖道腺瘤样瘤基因组图谱分析中发现,突变型肿瘤坏死因子受体相关因子7(TRAF7)的表达增加了核因子kB(NF-kB)的磷酸化和L1细胞黏附分子(L1CAM)的表达。L1CAM 是NF-kB 通路激活的标志。免疫组化显示L1CAM 在腺瘤样瘤中高表达,而在正常间皮细胞、恶性腹膜间皮瘤和多房腹膜包涵体囊肿中不表达。这些研究表明,男性和女性生殖道的腺瘤样肿瘤是由TRAF7 突变决定的,TRAF7 突变驱动了异常的NF-kB通路激活。
子宫ATs需与以下四类肿瘤鉴别。①子宫平滑肌瘤:该肿瘤平滑肌束呈席纹状排列,其内的间质血管可能会与子宫ATs的内衬扁平上皮样细胞管腔样结构相混淆,但子宫ATs管腔内无红细胞[19],并且CD34 阴性同时可排除管腔的血管来源。②子宫腺肌瘤:肿块的界限可不清,但切面可散在紫蓝色出血点。镜下子宫腺肌瘤平滑肌束间可见子宫内膜腺体和(或)间质,而子宫ATs 只出现内衬扁平上皮的腔隙。③腺癌或印戒细胞癌:子宫ATs 管腔样结构可呈条索状“浸润性”生长于增生的平滑肌组织中,尤其当上皮样细胞呈空泡状,极易误诊为腺癌或印戒细胞癌。腺癌细胞异型性明显,核分裂像多见,免疫组化肿瘤细胞CEA及EMA阳性有助于区别子宫ATs。④子宫淋巴管瘤:此肿瘤非常罕见,淋巴管的结构类似子宫ATs 的管腔结构,但子宫ATs 的管腔内无淋巴细胞,且上皮样细胞Calretinin 阳性,CD34阴性。
子宫ATs 生物学行为呈良性,治疗首选手术切除。本研究共随访56例病人,随访时间范围12~84个月,均无肿瘤复发或恶变。巨大囊实性子宫ATs同样为良性肿瘤[15],无复发。
综上所述,子宫ATs 为起源于子宫浆膜间皮细胞的良性肿瘤,由于临床症状的不典型性及形态的多样性,常难以准确诊断。充分认识子宫ATs 的形态学特点并结合免疫组化染色可减少误诊率,提高诊断的准确性。
(本文图1~6见插图10-2)

