侵袭性血管黏液瘤研究进展
林雪梅 综述 王琼 审校
1983年,Steeper等[1]报道9例发生在育龄期妇女骨盆和会阴的肿瘤,首次详细描述了此肿瘤的病理学特点,并将其命名为侵袭性血管黏液瘤(aggressive angiomyxoma,AA)。“侵袭性”是指这类肿瘤富于血管、具有局部浸润和局部复发的生物学行为特点。2003年第3版和2013年第4版世界卫生组织(WHO)肿瘤分类最终将这类肿瘤纳入骨和软组织肿瘤类别,并将其划分为分化不确定的肿瘤[2]。
1 AA的流行病学及临床特征
AA较为少见,截至目前,暂无具体的文献统计其发病率,现有报道均为病例报告并文献复习。在已有的超过350 例[3]病案报道中,发病人群以女性居多,最小者9个月[4],最大者82岁[5],年龄段主要集中在生育期[6-7]。此外,老年男性也可发生,男女比约为1∶6.6[8]。女性好发部位为盆腔、阴道、臀部及外阴;男性则主要累及泌尿生殖道,特别是阴囊和腹股沟区[9]。患者临床表现各异,但均无特异性。多数患者可在下腹部及会阴区触及或发现缓慢生长的肿块;随着肿瘤逐渐增大,可出现各种与肿瘤相关的压迫症状,如腹部隆起[10]、臀部肿胀[11]、性交困难[12-13]、尿频、尿急、夜尿[14]、阴囊肿胀[11]、类似阴囊积液[15]等。由于上述症状不具有特异性,甚至部分患者无症状,因此临床上容易误诊,误诊率可达82%[16-17]。
2 AA的临床辅助检查手段及特点
AA 患者常规进行超声、(增强)CT、(增强)MRI检查。超声检查往往表现为表浅、低回声和边界清楚的软组织实性肿块[18]。T1加权MRI显示肿块密度与肌肉密度相当,T2加权显示肿块密度增强;静脉注射钆造影剂后,肿块密度呈强烈的增强;在T1 或T2加权MRI图像上可观察到特征性的漩涡状和(或)层状内部结构[19-20]。CT 则可观察到边界清楚、质地均匀的低密度肿块;静脉造影后,增强CT扫描可见漩涡状结构的低衰减或等衰减性肿块[19],见图1。
3 AA的病理学特点
3.1 大体检查
肿块表面光滑,呈分叶状或指状突起,带部分包膜或无包膜,颜色可呈灰白、粉红、棕黄或灰褐色,有时与周围的纤维脂肪组织黏连紧密。肿块体积大小不一,直径范围1~60 cm。切面呈胶冻状或呈灰蓝色均匀质地的黏液样外观,质软,也可质韧如纤维组织。有时可出现出血、纤维化等继发性改变[1,3,10]。
3.2 显微镜检查
1)肿瘤细胞排列稀疏,瘤细胞呈纺锤样或星芒状,胞浆少,边界不清,核呈椭圆形,核内染色质密集深染,偶见中位小核仁;2)瘤细胞形态温和,无明显异型性,核分裂像罕见;3)肿瘤背景中散在分布管径不一、无吻合、无分支的血管,血管形态表现多样(毛细血管、薄壁小静脉、较大的厚壁脉管均可见);4)最具特征性的改变是厚壁血管中“厚壁”的两种体现:由平滑肌细胞围绕血管壁而形成的厚壁肌性动脉和由嗜酸性红染的胶原纤维围绕血管壁而形成的“厚壁”形态的血管;5)间质内可有红细胞外渗;6)基质为黏液样基质;7)肿瘤边缘浸润周围成熟纤维脂肪组织;8)在肿瘤内,可见残存的、成熟的神经束[1,3,10]。见图2。
3.3 免疫表型
通常波形蛋白(vimentin)、雌激素受体(ER)、孕激素受体(PR)、高迁移率蛋白(HMGI-C)阳性;结蛋白(desmin)可以阳性,也可以阴性;平滑肌动蛋白(SMA)偶尔散在阳性;Ki-67增值指数低,见图2。
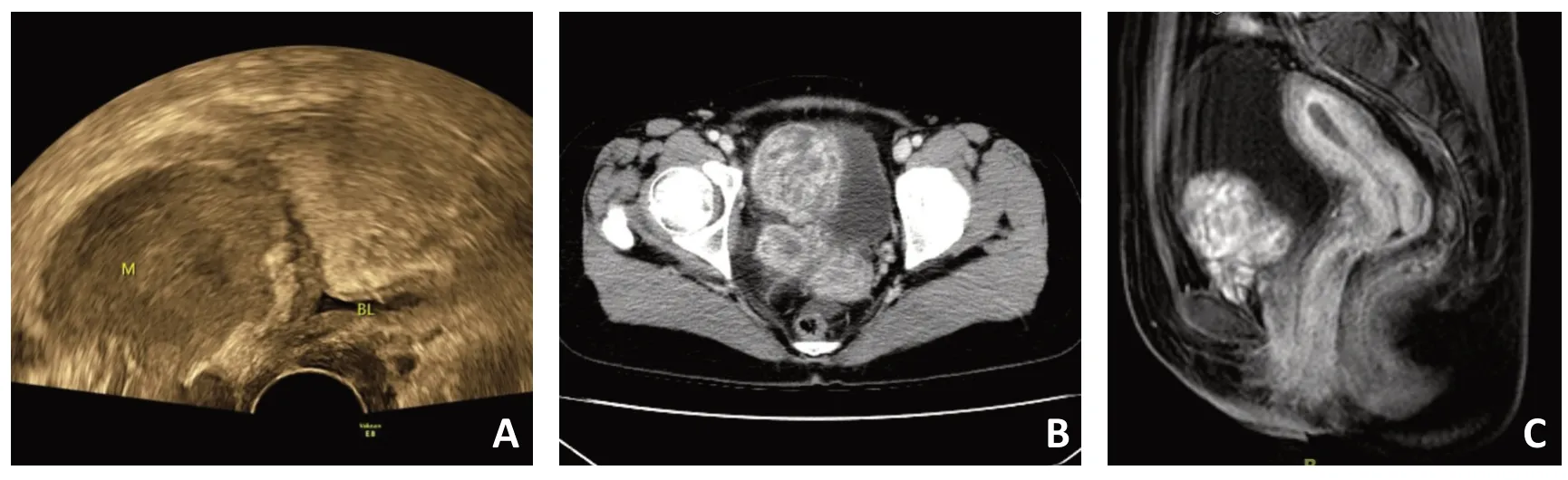
图1 AA的影像学表现
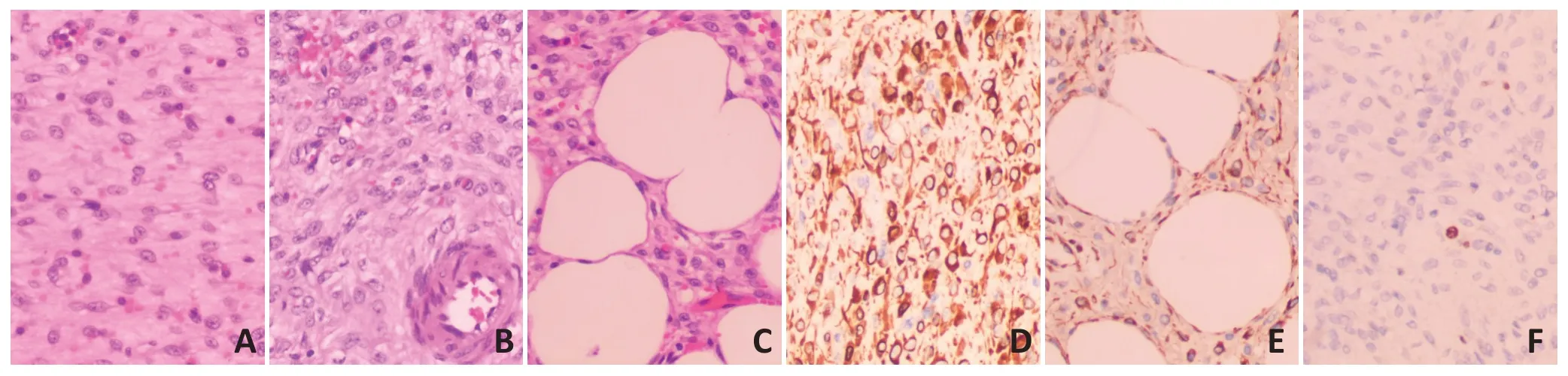
图2 AA的H&E特点和免疫组织化学特征
3.4 AA的组织学起源
关于AA 的组织学起源,一直均无明确的结论。与AA 相似的病例报道最早可追溯至1905年[21]。在2006年以前,有关肿瘤细胞的起源,学者们一直倾向于肌成纤维细胞或成纤维细胞。1983年,Steeper等[1]采用电子显微镜观察到AA 的纺锤样肿瘤细胞中存在细胞膜下胞饮小泡和肌动蛋白细肌丝,从而确定AA 的纺锤样肿瘤细胞具有肌成纤维细胞的分化特点。1991年,基于Sappino 等[22]的观点(肌成纤维细胞是一种参与创伤愈合、具有细胞骨架结构的、变异型成纤维细胞),Smith等[6]则认为肿瘤细胞起源可能是肌成纤维细胞,也有可能是成纤维细胞。2003年,Behranwala 等[23]报道称肿瘤细胞超微结构类似成纤维细胞而非肌成纤维细胞,同时瘤细胞表达vimentin、弱表达desmin,不表达肌球蛋白(myosin),从而认为肿瘤细胞是起源于成纤维细胞而非肌成纤维细胞。2006年,Alameda等[24]采用免疫组织化学和电子显微镜技术观察比较发生在会阴部的3种肿瘤(血管黏液瘤、AA 和血管肌纤维母细胞瘤),认为AA 起源于血管周的原始多能干细胞。
4 AA的发生机制与细胞遗传学
目前,细胞遗传学和分子生物学研究均表明,AA的发生涉及基因水平的多步骤改变[25-27],肿瘤细胞发生了8 号和12 号染色体异位,异常表达HMGI-C。DNA结构性转录因子HMGI-C,作为高迁移率族蛋白家族成员之一,在正常转录中具有重要的调节功能[28-29]。正常情况下,HMGI-C 仅表达于胚胎组织,而不表达于成人组织[30]。Nucci等[27]采用免疫组织化学技术检测发现,AA细胞核表达HMGI-C;有研究提议将HMGI-C 基因检测用于AA 微小残留病灶的诊断[26-27]。HMGI-C 基因位于12 号染色体q13-15 片段,而CDK4和MDM2基因位于12q13-15的上下游两端[31]。基于此,van Roggen 等[25]检测11例AA 肿瘤细胞的CDK4和MDM2表达情况,结果发现全部病例瘤细胞核均表达CDK4,1 例瘤细胞表达MDM2。同时分析认为细胞周期蛋白cyclin D 结合并激活CDK4,从而促进细胞周期进展;MDM2通过抑制野生型P53的活性,潜在促进MDM2扩增的同时也促进肿瘤细胞不受调控的增殖。
5 AA的治疗方式
5.1 外科手术切除
目前,外科手术切除为AA 的主要治疗方式,包括传统的外科肿块切除术、腹腔镜微创手术和机器人辅助手术[32-33]。由于AA的局部浸润和局部高复发特点,外科医生为了减少肿瘤的复发而采取肿块扩大切除,达到R0 手术切缘的目标。但由于肿瘤本身的结构和外观与周围正常组织相似,从而使得肿块扩大切除存在一定的手术风险和难度。Chan 等[8]报道5例AA,为求达到R0手术切缘,有2例就出现了严重的术后并发症:1例手术进行了右输尿管分离和再植入,患者失血量达4 000 mL;另1例则损伤了膀胱,同时患者失血量达5 000 mL。学者们[8,34-37]研究了R0和R1 不同手术切缘对预后的影响,结果证实患者术后肿块局部复发率与手术切缘的类型(R0/R1)无关。因此,目前手术方式的选择原则为存在根治术切除风险或需要保留生育能力的情况下,可以选择不完全切除,非必要进行淋巴结清扫[14],术后对患者进行长期密切随访,确保及时发现肿块复发并及时切除[37]。
5.2 激素治疗
可使用他莫昔芬、雷洛昔芬或促性腺激素释放激素。由于肿瘤细胞表达ER、PR,于是对患者尝试进行激素治疗。激素治疗可以有效缩小肿瘤体积,使得肿瘤体积较大者可行根治术切除[38];有效防止肿瘤复发[39];用于术后残存肿瘤的治疗。但长期使用激素后,患者可出现明显的不良反应(更年期症状、骨质疏松)[40]。此外,可造成肿瘤细胞耐药,或停止使用激素后,肿瘤可能复发[12]。综上所述,使用激素治疗有利有弊。有研究提出最佳的激素治疗时间,但激素最佳使用时间未定论[41]。另外,有研究提出,对于无生育要求的中年患者可采取双侧卵巢预防性切除[12],但治疗效果仍需进一步研究[34,41]。
5.3 其他治疗方式
对于术后复发风险高、肿瘤位置特殊、瘤体较大者还可采用动脉栓塞法[14]。由于肿瘤生长缓慢、瘤细胞生长指数低、核分裂像罕见、形态温和,因此化疗作用有限[23]。而对于放疗,仅少数病例报道术中或术后采用放疗,可有效减少肿瘤的复发[42]。目前,对于放疗的选择原则是将其用于对激素治疗和动脉栓塞治疗无反应的患者。
6 结语
AA 命名中的“侵袭性”体现了肿瘤局部浸润、局部复发的特性。其3年术后复发率为71%,5年复发率为85%,7年复发率达94%[8]。在所有的文献报道中,仅2例患者发生远处转移(均为肺转移)[43-44]。因此,AA 患者术后需要长期密切随访。在临床辅助检查手段中,首选MRI[45]。利用弥散加权成像磁共振(DW-MRI)和动态对比增强磁共振(DCE-MRI)作为随访复查手段[18],敏感性更佳。

