脑小血管疾病血脑屏障通透性与MRI总负担的相关性
李 曼,李 悦,高 帅,刘明熙,周 洋,左 龙,胡文立,蒋 涛*
(1.首都医科大学附属北京朝阳医院放射科,2.神经内科,北京 100020)
脑小血管疾病(cerebral small vessel disease, CSVD)包括腔隙性梗死(lacunes)、脑白质高信号(white matter hyperintensity, WMH)、脑微出血(cerebral microbleeds, CMB)、血管周围间隙扩大(enlarged perivascular spaces, EPVS)及脑萎缩(brain atrophy, BA)5种影像学表现[1]。CSVD发病机制尚不明确,既往研究[2]普遍认为血脑屏障(blood-brain barrier, BBB)内皮功能障碍在CSVD早期发生发展中起关键作用。动态增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)可根据药代动力学模型进行运算,得出反映局部组织微血管通透性的定量参数,是定量评价CSVD及其他低渗漏病变BBB通透性的首选检查方法[3]。此前有研究[4]应用DCE-MRI发现WMH、腔隙性卒中患者BBB通透性增加,但只局限于CSVD单种影像学表现与BBB通透性间的关系,未将CSVD影像学表现视为一个整体。本研究拟通过对CSVD患者进行颅脑DCE-MRI扫描并行定量分析,探讨CSVD总负担与BBB通透性之间的关系,以期为CSVD发病机制提供影像学依据。
1 资料与方法
1.1 一般资料 收集2016年4月—2017年6月104例就诊于首都医科大学附属北京朝阳医院患者,行颅脑常规MR及DCE-MR检查。排除标准:①有症状性脑卒中病史,或症状性颈动脉狭窄≥50%、冠心病等;②阿尔茨海默病、癫痫、退行性神经疾病及多发性硬化等;③外伤、肿瘤、感染等;④MR检查及对比剂禁忌证,或拒绝接受MR检查;⑤滥用药物及酒精,精神障碍(如抑郁症或精神分裂症等)。采用2013年国际血管改变神经影像学标准报告小组(standards for report in vascular changes on neuroimaging, STRIVE)CSVD影像学诊断标准进行CSVD总负担评分[5],根据评分结果(0~5分)分为CSVD0组(0分)~CSVD5组(5分)共6组。本研究经院伦理委员会批准,检查前患者均签署知情同意书。
1.2 方法
1.2.1 MRI扫描参数 采用Siemens Prisma 3.0T MR扫描仪,64通道头部线圈,先行常规轴位及矢状位T1W、轴位T2W、液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)、DWI及矢状位T1W序列扫描,参数:T1W(TR 2 000 ms,TE 9 ms)、T2W (TR 5 000 ms,TE 94 ms)、FLAIR(TR 9 000 ms,TE 81 ms)、DWI(TR 4 000 ms,TE 86 ms),FOV为 230 mm×230 mm,层厚5 mm,矢状位T1W(TR 2 000 ms,TE 9 ms,FOV 230 mm×230 mm,层厚3 mm)。采用容积内插屏气检查(volumetric interpolated breath-hold examination, VIBE)技术,先采集2个T1-mapping序列(FA 3°、15°)图像,然后行DCE-MRI:TR 5.08 ms,TE 1.8 ms,FA 15°,FOV 230 mm×230 mm,分辨率1.2 mm×1.2 mm×3.0 mm,采集时相为60个,于第5个时相开始经肘静脉置管团注Gd-DTPA 0.1 mmol/kg体质量,注射流率2.5 ml/s,随后用10 ml生理盐水冲洗,总采集时间6 min 31 s。
1.2.2 图像处理及分析 采用Nordic ICE软件进行图像后处理。应用Patlak模型[6]勾画上矢状窦[7],获得动脉输入函数(arterial input function, AIF)时间-强度曲线,行图像运动及时间、空间校正及平滑,自动生成DCE-MRI各项定量参数伪彩图(图1)。由1名具有8年工作经验的放射科主治医师手动勾画WMH、常规MRI表现正常的脑白质区(normal-appearing white matter, NAWM)、皮层灰质区(cortical gray matter, CGM)及深部灰质区(deep gray matter, DGM)4个区域的ROI(5 mm2),获得相应区域渗漏速率(Ktrans)、渗漏曲线下面积(area under the curve, AUC)及局部脑血浆容量(fractional blood plasma volumes, Vp),测量CGM及WMH时避开脑脊液;各参数均测量4次,取平均值作为结果。
1.2.3 统计学分析 采用SPSS 21.0统计分析软件。以±s表示正态分布计量资料,采用单因素方差分析进行比较,继而以SNK多重比较检验确定两两间差异。对连续变量非正态分布数据采用中位数(上下四分位数)表示,用Kruskal-Wallis检验进行比较。计数资料以例数(百分比)表示,行χ2检验或Fisher精确概率法进行比较。采用Spearman相关分析观察NAWM、
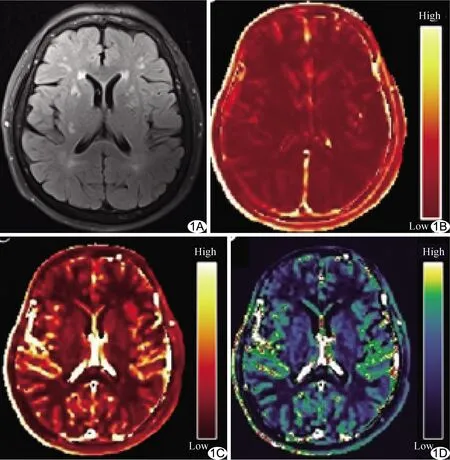
图1 患者女,77岁 A.FLAIR序列图像; B~D.经Patlak模型处理后获得的相应层面Ktrans(B)、AUC(C)、Vp(D)伪彩图
WMH、CGM及DGM的Ktrans、Vp、AUC与CSVD总负担的相关性,P<0.05为差异有统计学意义;行单因素回归分析,并以多因素线性回归分析校正年龄、性别和血管危险因素。
2 结果
2.1 一般资料 最终纳入99例,男49例,女50例,年龄49~90岁,平均(70.3±9.1)岁。CSVD0组23例,CSVD1组25例,CSVD2组17例,CSVD3组14例,CSVD4组12例,CSVD5组8例,组间性别差异无统计学意义(P>0.05),年龄差异有统计学意义(P<0.01),高血压、糖尿病、高脂血症、吸烟及体质量指数(body mass index, BMI)等差异均无统计学意义(P均>0.05),见表1。
2.2 BBB通透性与CSVD总负担的关系 各组NAWM、WMH、CGM及DGM 4个区域Ktrans及AUC差异均有统计学意义(P均<0.05),NAWM与DGM Vp差异有统计学意义(P均<0.05),余差异均无统计学意义(P均>0.05)。各区域CSVD总负担较高者具有较大的Ktrans和AUC,NAWM及DGM区域的Vp随患者CSVD总负担增高而降低。见表2。
2.3 相关性分析 分别以Ktrans、AUC和Vp为因变量,以CSVD总负担评分为自变量进行单因素线性回归分析;再以Ktrans、AUC和Vp分别为因变量,以年龄、性别及血管危险因素、CSVD总负担为自变量进行多因素线性回归分析。NAWM、WMH、CGM及DGM 4个区域的Ktrans、AUC与CSVD总负担呈正相关(P均<0.05),NAWM、CGM及DGM 3个区域的Vp与CSVD总负担呈负相关(P均<0.05)。见表3。
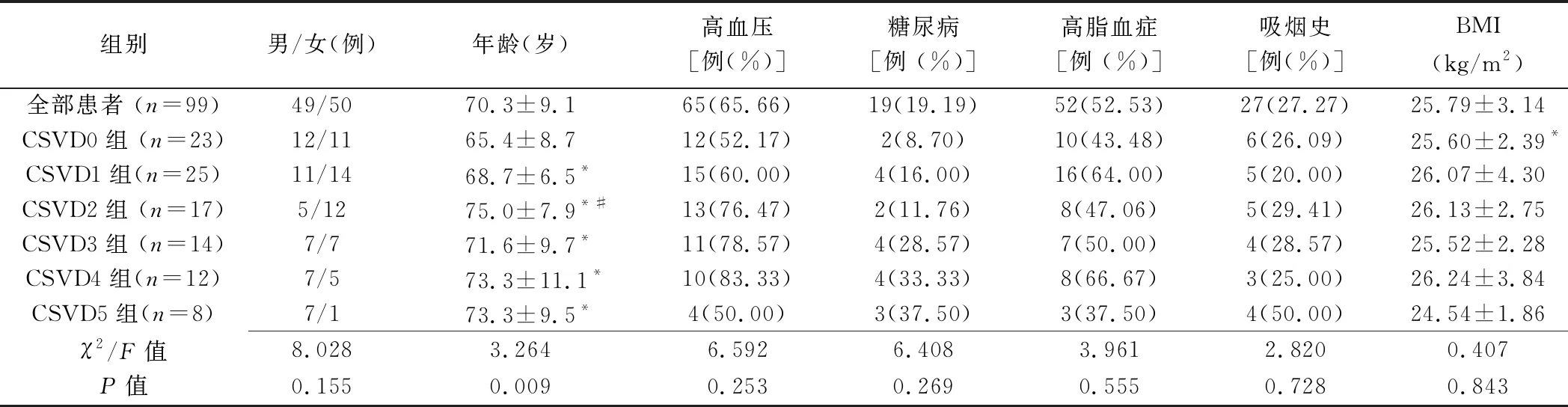
表1 各组基线资料及临床特征比较
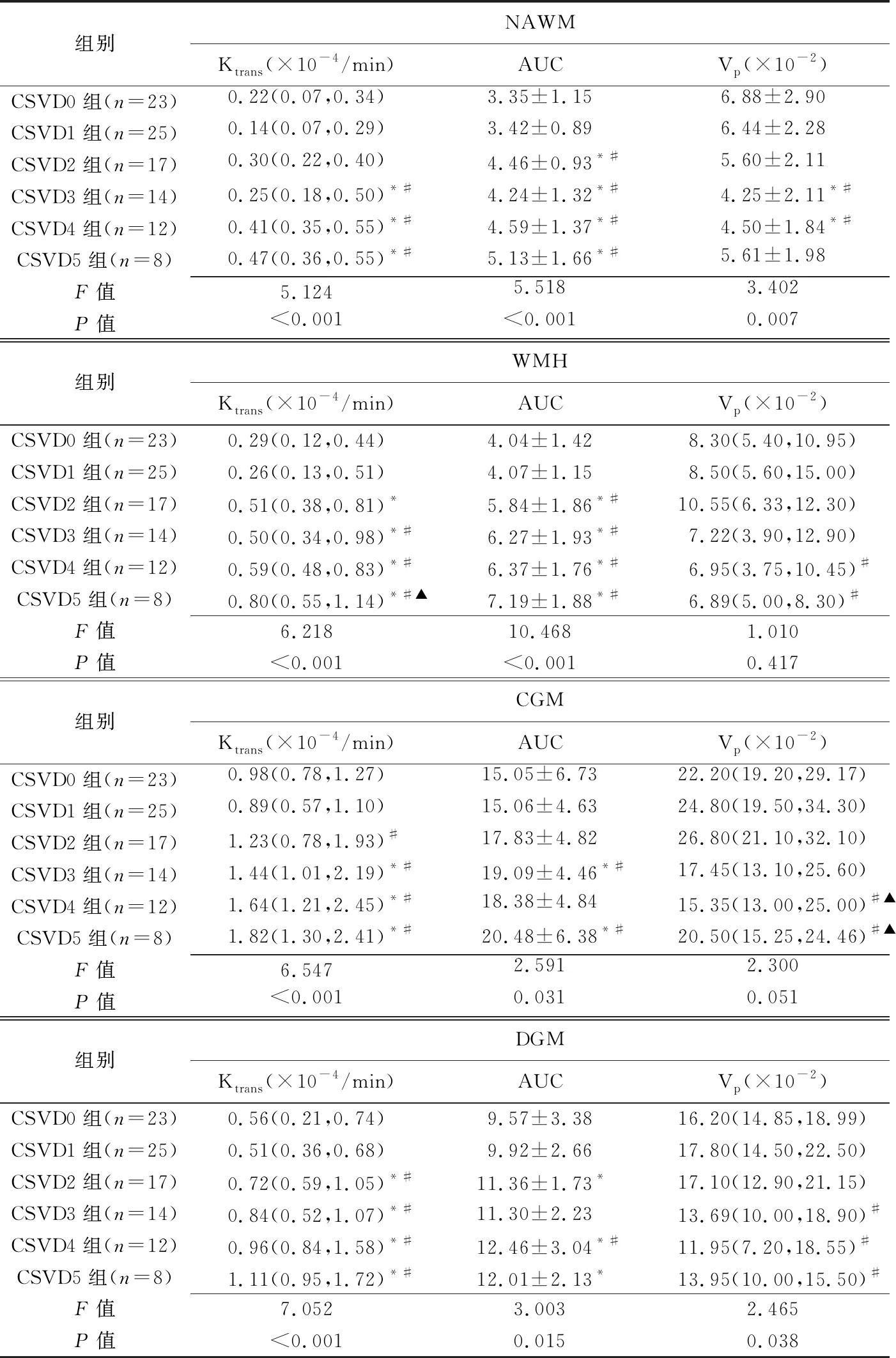
表2 各组不同区域Ktrans值,AUC值及Vp值比较
3 讨论
本研究结果显示,NAWM、WMH、CGM和DGM 4个区域CSVD总负担与Ktrans、AUC呈正相关,即随着CSVD总负担评分增高,BBB通透性增加;在NAWM、CGM和DGM 3个区域,CSVD总负担增加而Vp降低。既往研究[4,8-9]显示CSVD患者BBB通透性增加,但多仅关注腔隙性脑卒中、WMH及EPV等单个CSVD影像学表现与BBB通透性的关系。CSVD常同时存在多种影像学表现,CSVD总负担可能较单一表现更适合用于评价。本组CSVD患者NAWM、WMH、CGM和DGM 4个区域的BBB通透性增加,且与疾病严重程度相关。既往研究[4]对首发腔隙性脑卒中的CSVD患者和轻度血管性认知功能障碍患者进行DCE-MRI观察,发现NAWM、WMH和CGM 3个区域Vp明显高于对照组,但组间NAWM、WMH、CGM、DGM 4个区域的Ktrans差别无统计学意义;本研究结果与之存在不同,原因可能在于观察对象不同:本研究排除了症状性脑卒中患者,以防止症状性脑卒中对实验结果的影响。本研究团队此前曾观察脑小血管病的BBB通透性[10],其中CSVD总负担仅包括腔隙、WMH、CMB及EPVS等,未包括脑萎缩,而脑萎缩也是CSVD的重要影像学表现之一[1],故本研究加以进一步完善。
CSVD与BBB通透性改变的病理生理机制尚未完全清楚[5]。有学者[11]应用脑卒中易感型自发性高血压大鼠(spontaneously hypertensive stroke-prone rats, SHRSP)进行一系列实验,推测BBB破坏可能是CSVD的主要病理始动因素。BBB是脑组织与血液间的结构及生理屏障,由毛细血管内皮细胞、基底膜、星形胶质细胞、周细胞和神经元组成[12],内皮细胞是BBB的主要结构,具有连续的细胞间紧密连接、极低的胞吞作用和开窗孔。紧密连接是维持BBB的最主要结构[13],可防止血管内物质渗漏到脑实质内,其功能破坏会导致血浆内容物外渗,进而改变细胞极性,影响细胞转运机制[12,14],引发炎性反应和氧化应激,进而引起脑内小血管壁玻璃样变性、血管周围水肿和神经毒性损伤,导致神经纤维密度下降,髓鞘脱失,少突胶质细胞轴突损伤,星形胶质细胞增生、肿胀,神经突起瓦解,小神经胶质细胞激活[15],致CSVD出现多种影像学表现。
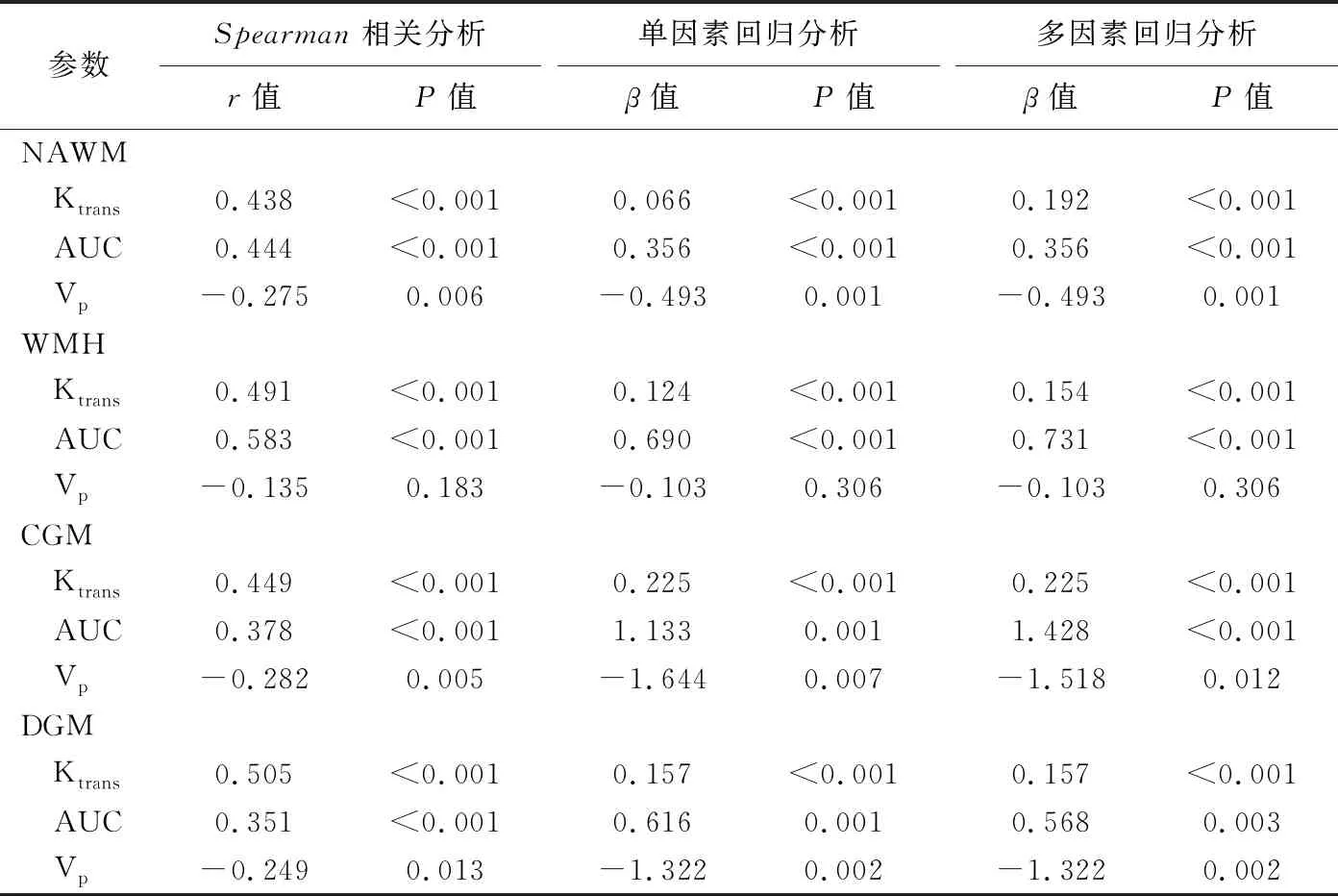
表3 不同区域Ktrans、AUC及Vp与CSVD总负担间相关及回归分析结果
本研究发现CSVD患者NAWM、CGM和DGM 3个区域 Vp减低,且随CSVD总负担增加逐渐减低。既往研究[16]发现CSVD患者WMH和NAWM区域脑血流量减低,其原因一方面可能是脑组织容积减小、总体耗氧量及代谢率减低、局部血流灌注代偿性减少[17],另一方面则是神经血管单位内的各种细胞,包括星形胶质细胞、血管平滑肌细胞、内皮细胞和周细胞,在组织灌注和血流动力学反应中起作用,CSVD患者一氧化氮合酶受损,内皮细胞功能破坏,引起血管平滑肌细胞松弛及平滑肌细胞减少,导致灌注压下降,且其毛细血管丢失及功能异常也可导致局部脑血流灌注减低[18]。
本研究的局限性:为单中心横断面研究,观察对象非属社区随机抽样人群,糖尿病、高血压等基础病的患病率较高,CSVD总负担评分可能高于社区人群;手动测量DCE-MRI参数,测量4次取平均值可在一定程度上减小误差;无法确定BBB通透性改变与CSVD总负担间的确切因果关系以及BBB通透性对CSVD的发展是否存在影响。
综上所述, CSVD患者全脑BBB通透性增高与其CSVD总负担相关;BBB受损可能是CSVD病理生理过程的关键因素之一。

