关于铜氨配离子结构解释及稳定性的讨论
范晓辉
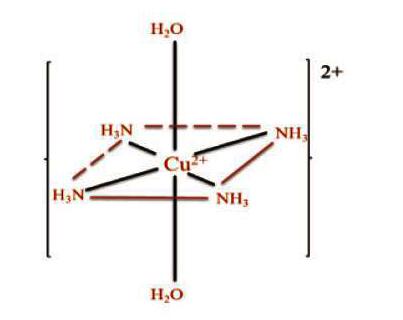
摘 要:本文试通过处理配位化合物的两种理论——价键理论(VB法)和晶体场理论处理铜氨配离子的结构问题,解决一线教师关于其结构困惑,为教学提供理论支撑。
关键词:铜氨配离子 晶体场理论 Jahn-Teller效应 几何构型
配位化合物的研究是现代无机化学研究的重点方向,而作为基础教育与高等教育衔接的普通高中教学过程中受限于课时与学生认知能力的双重限制,配位化合物的结构与基本理论是有所缺失的。故而在教学过程中会出现一些争议性的问题。如:在人教版化学选修3中有关铜氨配离子的结构的几何构型的解释出现了问题。在蓝色的CuSO4(aq)中加入浓NH3·H2O(aq),实验现象为先出现蓝色的沉淀,继续滴加浓氨水时沉淀溶解,溶液变为深蓝色。反应方程式为:2CuSO4 + 2NH3·H2O = Cu2(OH)2SO4 ↓+ (NH4)2SO4
Cu2(OH)2SO4 + 10NH3·H2O =2[Cu(NH3)4](OH)2 + 8H2O + (NH4)2SO4
一、價键理论
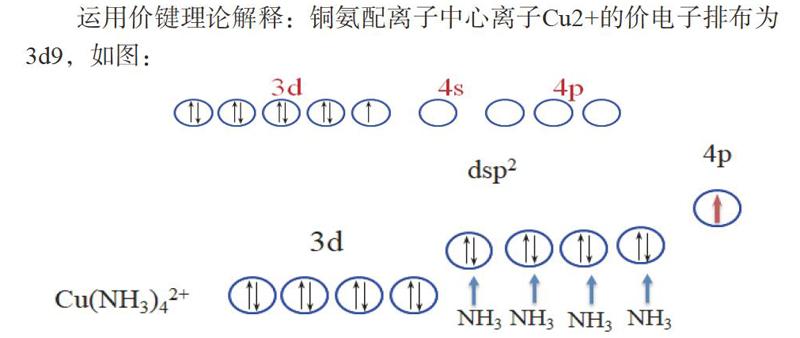
运用价键理论解释:铜氨配离子中心离子Cu2+的价电子排布为3d9,如图:
3d轨道中的单电子激发到4p轨道,然后中心离子采用dsp2杂化[1]。
此时其配离子的几何构型符合平面四方的几何构型,但是由于杂化过程势必存在单电子3d轨道的激发到能量更高的4p轨道,这意味着铜氨配离子具有较强的还原性易被氧化产生更高氧化态,而实际铜氨配离子很稳定,不易被氧化,与实际不符。那就说明此时采用价键理论去解释其结构是不合理的。而关于其结构可用晶体场理论进行较完美的解释。
二、晶体场理论
运用晶体场理论:铜氨配离子为平面四方结构是因为Jahn-Teller效应。1937年英国化学家Jahn和美国理论物理学家Teller发现:配位化合物中心原子或离子的d能级电子云如果出现不对称结构,配体也会随之出现不对称,正八面体结构会因此发生畸变。结果是降低分子的对称性和轨道的简并度,降低体系的能量,这一现象称为Jahn-Teller效应。
d9的Cu2+在Oh场(八面体场)中分裂为(t2g)6(eg)3,二重简并的eg轨道上有3个电子,其电子可按照两种方式排布,即(t2g)6(dz2)1(dx2-y2)2或(t2g)6(dz2)2(dx2-y2)1,前一种和d10构型比较,相当于z轴上减少一个电子,这样,使得在z轴方向的电子对中心原子的屏蔽作用减小,增大了Cu2+对NH3的作用力,z轴方向的键长减小,得到4个长键和2个短键,形成一个压扁的八面体构型;后一种电子排布方式dx2-y2轨道上只有一个电子,使得在xy平面上的4个配体受到中心原子的引力增加,从而得到4个短键和2个长键,形成一个拉长的八面体。Jahn-Teller效应无法预测得到配合物的构型究竟是拉长的八面体还是压扁的八面体[2],只能通过实验测定来确定真实几何构型。实验表明,Cu2+离子的配合物大多是拉长八面体,配位数为6,或忽略长轴方向上的较弱的两根键,则配位数也可认为是4,其结构为:
拉长八面体的能级分裂如图所示,dz2与dx2-y2轨道能量差为q,t2g轨道分裂成dxy和二重简并的dyz和dxz也为q。d9构型的畸变八面体和正常的八面体相比较依据能量不变原理,t2g电子没有净能量变化。但是对于eg电子,出现了Jahn-Teller稳定化能。此时晶体场稳定化能
CFSE=-6Dq-0.5q。所以畸变的拉长的八面体更为稳定,其能量的下降为“畸变”提供了动力。如果将位于拉长八面体z轴上配体继续移动到无穷远处,则在z轴上中心原子的电子所受到排斥力也将继续减小,dz2轨道能级继续下降,直到变为平面正方的D4h构型。
此外,可从稳定常数佐证其结构特点。如,[Cu(NH3)4(H2O)2]2+溶液中很容易形成,两个水位于长轴方向,而[Cu(NH3)6]2+只有在液氨中才能形成,说明两个NH3在长轴与Cu(II)结合很弱。
综上所述,电子结构不对称的Cu2+在浓氨水的作用下,由于Jahn-Teller效应的影响,产生额外的晶体场稳定化能,形成一个拉长的变形八面体构型,其配位数为6,但由于长轴方向的键较弱,故而在高中教学实践过程中,位于长轴方向上的H2O被忽略,从而认为其配位数为4。
三、教学建议
在此教学时,可将其结构呈现给主体学生,进而让学生更加精准的掌握铜氨配离子的真实构型;对于化学竞赛生而言,作为化学竞赛教练更应该清晰明了的讲解其结构特殊的原因。从实际的教学效果来看,无论是普通高中生还是竞赛生当教师讲解清楚后,终端效果良好。
参考文献
[1]北京师范大学,华中师范大学,南京师范大学.无机化学(下册)[M].第4版.高等教育出版社,2002:709.
[2]张祖德.无机化学[M].第2版.中国科学技术大学出版社,2014,312.

