人造岗石废渣合成甲酸钙晶体的工艺研究
汤 泉,莫福旺,画 莉,黄志强,宁美芳,吴春蓉
(贺州学院材料与化学工程学院,贺州 542899)
0 引 言
甲酸钙又称蚁酸钙,其分子式为Ca(HCOO)2,主要呈白色结晶或结晶粉末状[1-2],略带有吸湿性,无毒、无潮解性、极易溶于水、不溶于醇类的有机溶剂,加热至400 ℃左右就会发生分解,其水溶液的pH值呈中性。甲酸钙用途比较广泛,作为动物饲料添加剂,具有酸化、防腐、防霉的功效[3],也可作为高硫燃料烟气脱硫的助剂、水泥的助磨剂[4]、植物生长的调节剂、建筑材料的助剂、合成草酸的中间体[7],除此之外,甲酸钙还可以用于煤砖粘合剂和纤维辅助材料[8]等。由于甲酸钙的用途较为广泛,市场对甲酸钙的需求量也逐渐增大,甲酸钙的合成工艺研究也逐步成为热点,生产甲酸钙的工艺研究主要有: 作为多羟基醇生产的副产物[9]、中和法[10]、渗析法[11]以及氢氧化钙与甲醛合成[12-13]等。多羟基醇生产副产物优点是得到的副产物为甲酸钙,缺点是产量较低,并受多羟基醇的制约。中和法是以HCOOH和CaCO3或Ca(OH)2为原料制备甲酸钙的主要方法,优点是操作简单,产品纯度高,缺点是能耗大,整个生产成本较高,效率和利润低。渗析法合成甲酸钙是一种较为绿色环保的方法,主要以甲酸钠和氢氧化钙为原料,采用两张阴离子交换膜组成三室渗析系统,缺点是整个过程的传质速度非常慢,效率相对较低。Ca(OH)2在催化剂的作用下与甲醛反应合成甲酸钙,由于甲醛的价格非常昂贵,在碱性条件下容易聚合发生糖化作用,所以此方法并不具备工业生产的价值。
人造岗石是以大理石、石灰石等为原料,以不饱和树脂为胶黏剂,配以适量的固化剂、稀释剂、促进剂、铁系染料等混合、搅拌、真空压制成型,经切割与打磨而成[14]。由于人造岗石中重质碳酸钙颗粒被三维立体网络状的不饱和树脂紧密包覆后固化,结构复杂,目前还没有低成本的方法对企业生产过程中的人造岗石废渣进行分离和资源化利用。企业采用的方法一般是简单填埋和露天堆放,不仅占用大量的土地,而且产生大量的挥发性有机物,给环境造成二次污染,也给企业的可持续发展带来了困扰,同时对资源也是巨大的浪费[15]。人造岗石废渣中重质碳酸钙约占90%~91%,不饱和树脂约占8%~9%,铁系染料和其他助剂约占0.5%,利用人造岗石废渣中各组分的特点,本文拟通过加入甲酸与人造岗石废渣中的重质碳酸钙反应,可以把不饱和树脂和不溶于甲酸的其它固体杂质分离,在滤液中加入硫化物沉淀剂,将人造岗石废渣和铁系染料中的重金属离子进行沉淀分离,再采用浓缩结晶可合成甲酸钙。以工业为导向,为人造岗石可持续发展奠定基础。
1 实 验
1.1 原料、药剂与仪器
主要原料:人造岗石废渣,由广西利升石业有限公司提供。
主要药剂:甲酸、氢氧化钙、硫化钠、1,10-菲啰啉、盐酸羟胺、无水醋酸钠、乙二胺四乙酸二钠、钙羧酸指示剂、碘化钾、硫酸、硫代硫酸钠、可溶性淀粉、高锰酸钾均为分析纯。
主要仪器: DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限公司;TG16-WS高速离心机,湖南湘仪实验室仪器开发有限公司;SHZ-D(Ⅲ)循环水式多用真空泵,河南省予华仪器有限公司;DHG-9140A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;722型可见分光光度计,上海光谱仪器有限公司;Ultima lV X射线衍射仪,日本理学公司;JSM-7610F扫描电子显微镜,日本电子股份有限公司;Spectrum红外光谱仪,美国珀金埃尔默股份有限公司;JED-2300T 能谱仪,日本电子股份有限公司。
1.2 实验过程
在烧杯中加入10 g人造岗石废渣,按1∶5比例用蒸馏水稀释,再加入一定量浓度为50%的甲酸,放入水浴锅中加热,以一定的搅拌速度反应一段时间后将溶液过滤,滤液转移到烧杯中,滤渣烘干。(实验室没有考虑CO2气体的排放,在生产中可以收集气体用于碳化法制备轻质碳酸钙)
将滤液放入水浴锅中,在相同的温度下滴加浓度为25%的石灰乳调节pH值为7~8,并保温1.5 h,然后加入一定体积的硫化物沉淀剂,硫化物沉淀剂主要由5 g硫化钠、10 mL水和30 mL甘油混合组成[16],反应完成后将其过滤,通过蒸发结晶的方式得到晶体,在离心机中转动15 min,过滤得到产品,将产品放入80 ℃左右的烘箱烘干。
1.3 表 征
采用扫描电子显微镜观察形貌,在测试之前通过对样品喷金预处理来增强材料的导电性,设定扫描电压为9~30 kV,电流为20 mA,放大倍数范围5 000~100 000。
采用XRD分析物相,扫描电压为40 kV,扫描电流为40 mA,步长0.02°,扫描速度为8°/min。
采用红外光谱仪分析在400~4 500 cm-1范围内所振动的吸收峰。
采用能谱仪对产物进行全谱元素分析。
1.4 铁离子浓度的测定
首先配置系列的铁标准溶液,在波长为510 nm的分光光度计下读取吸光值,作铁离子标准曲线。
取5 mL除铁前后的甲酸钙溶液(0 mL、0.05 mL、0.10 mL、0.15 mL、0.20 mL、0.25 mL)进行实验。其中以水(空白)为参比,波长为510 nm条件下测量吸光值,计算处理前后甲酸钙溶液中铁离子的浓度,并计算铁离子的去除率。
1.5 钙离子和甲酸钙浓度的测定及收率的计算
结合文献[17],采用络合滴定和氧化还原滴定相结合的方法测定钙离子和甲酸钙的浓度,从而计算出甲酸钙的收率。其计算钙离子的浓度公式如下:
(1)
CEDTA—EDTA标准液的浓度,mol/L;VEDTA—消耗EDTA标准液的体积,mL。
计算甲酸钙的浓度公式如下:
(2)
V1—滴定空白实验所消耗硫代硫酸钠标准液的体积,mL;V2—滴定产品所消耗硫代硫酸钠标准液的体积,mL;CNa2S2O3—硫代硫酸钠标准液的摩尔浓度,mol/L。
甲酸钙的收率为:
(3)
2 结果与讨论
2.1 甲酸加入量对人造岗石废渣利用率的影响
称量10 g人造岗石,反应温度控制在80 ℃,反应时间为30 min,转速为380 r/min的条件下,改变投料比,分析人造岗石废渣与甲酸的投料量质量比(1.0∶0.7、1.0∶0.9、1.0∶1.1、1.0∶1.3、1.0∶1.5)对人造岗石废渣利用率的影响,实验结果如图1所示。
由图1可知,随着人造岗石废渣与甲酸的投料量质量比增大,人造岗石废渣的利用率逐渐升高,直到最后趋势较为平缓。当投料量质量比在1.0∶1.3至1.0∶1.5区间时趋于平缓,主要原因是甲酸与人造岗石废渣中的碳酸钙已反应完全,而甲酸又不与树脂参与反应,所以再加入甲酸,人造岗石废渣利用率的变化也不太大,故选择人造岗石废渣与甲酸投料量的质量比1.0∶1.3作为最优条件。
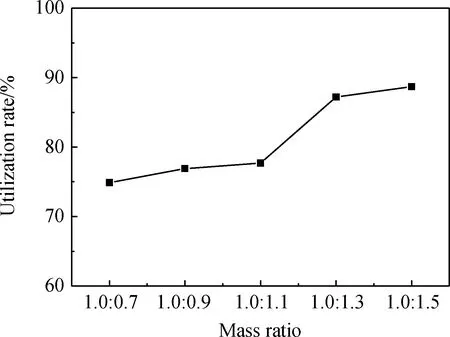
图1 甲酸加入量对人造岗石废渣利用率的影响Fig.1 Effect of formic acid adding amount on the utilization rate of artificial granite waste residue
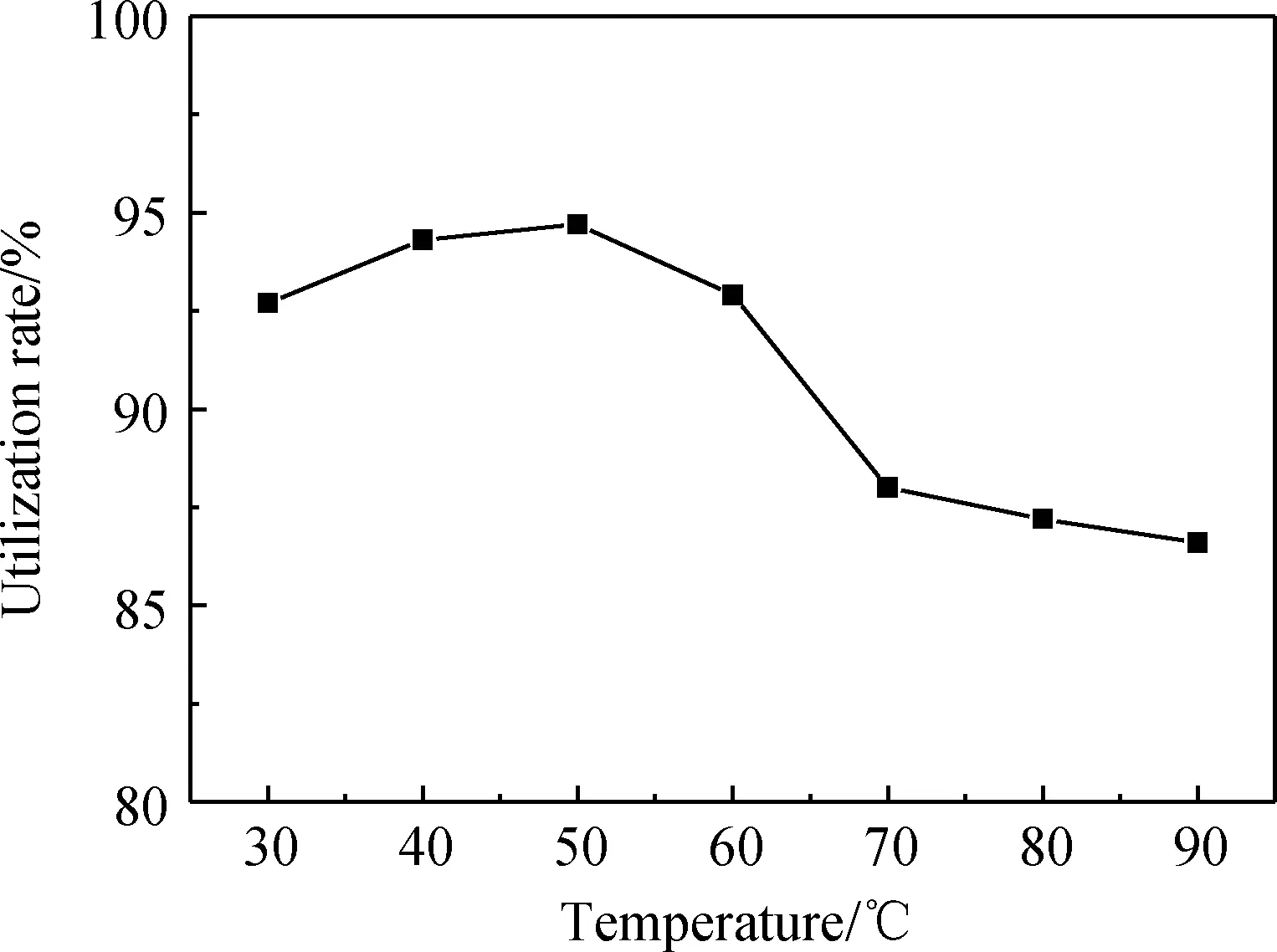
图2 反应温度对人造岗石废渣利用率的影响Fig.2 Effect of reaction temperatures on the utilization rate of artificial granite waste residue
2.2 反应温度对人造岗石废渣利用率的影响
在人造岗石废渣与甲酸的投料量质量比为1.0∶1.3,反应时间为30 min,转速为380 r/min的情况下改变反应温度,分析不同的反应温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃)对人造岗石废渣利用率的影响,实验结果如图2所示。
从图2可知,反应温度在30 ℃到90 ℃区间呈现的曲线规律是先升高后降低的趋势,其中在50 ℃时出现一个最高点,这时人造岗石废渣利用率为94.7%,而出现这个转折点的主要原因是当反应温度较低时,反应物中存在较多的甲酸未参与反应,反应不完全。当反应温度过高时,甲酸会挥发,只有部分甲酸与人造岗石废渣参与反应,造成滤渣中含有部分的人造岗石废渣,故选择最优的反应温度为50 ℃。
2.3 搅拌速度对人造岗石废渣利用率的影响
在人造岗石与甲酸的投料量质量比为1.0∶1.3,反应温度为50 ℃,反应时间为30 min的情况下改变搅拌速度,分析不同的搅拌速度(320 r/min、380 r/min、430 r/min、490 r/min、540 r/min)对人造岗石废渣利用率的影响,实验结果如图3所示。
如图3可知,随着搅拌速度的增大,人造岗石废渣的利用率呈现先降低后升高的趋势,变化的趋势较小;当搅拌速度为430 r/min时,人造岗石废渣利用率为93%,造成这种曲线变化的主要原因可能是当搅拌速度较低时,搅拌不均匀,反应不完全,导致部分的人造岗石废渣未能参与反应;当搅拌速度较高时,搅拌过于剧烈,在反应过程中会产生飞溅的现象,导致最后得到的滤渣量减少,故选择430 r/min为最优的搅拌速度。
2.4 反应时间对人造岗石废渣利用率的影响
在人造岗石废渣与甲酸的投料量质量比为1.0∶1.3,反应温度为50 ℃,搅拌速度为430 r/min的情况下改变反应时间,分析不同的反应时间(20 min、30 min、40 min、50 min、60 min)对人造岗石废渣利用率的影响,实验结果如图4所示。
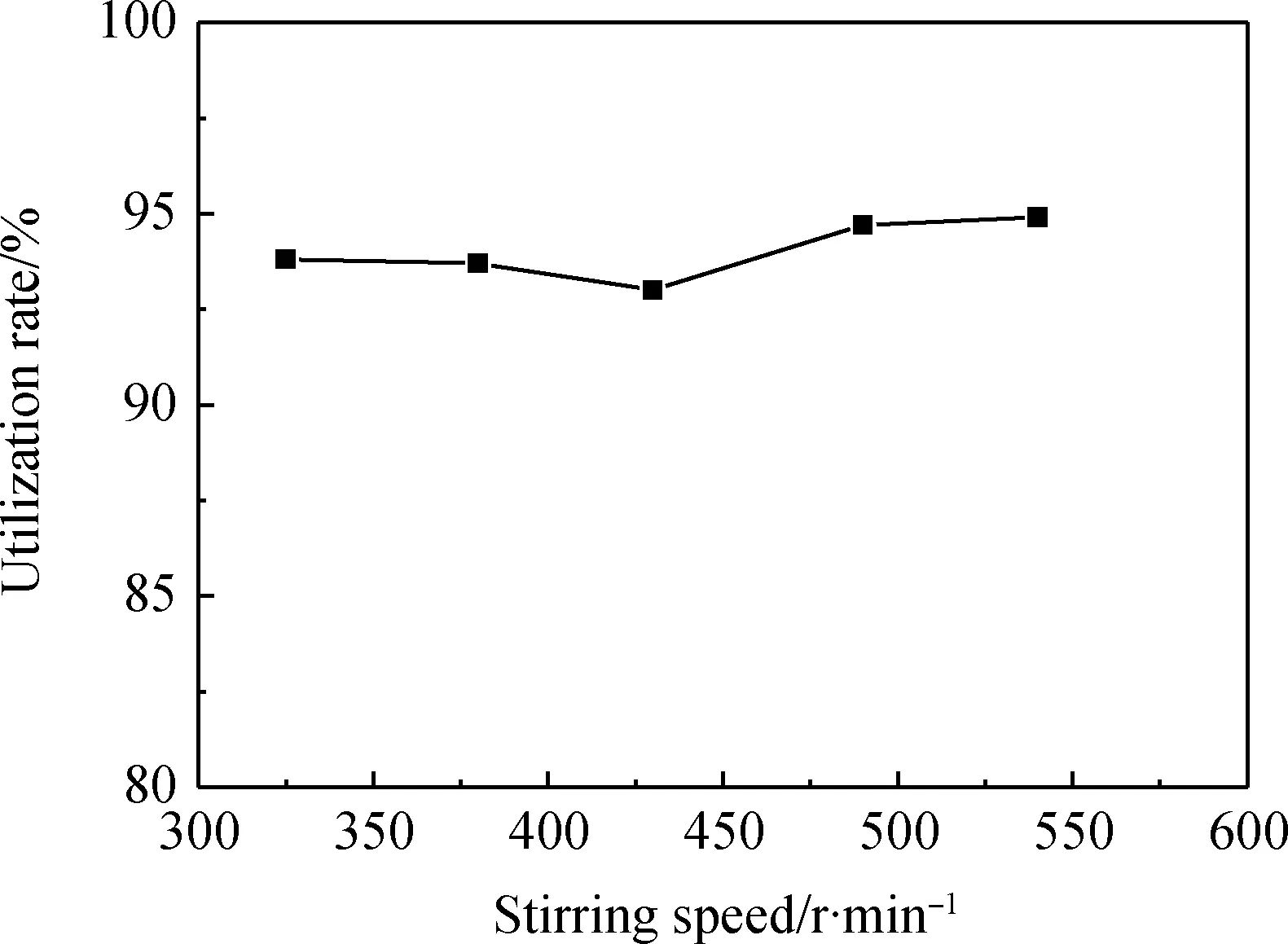
图3 搅拌速度对人造岗石废渣利用率的影响Fig.3 Effect of stirring speed on the utilization rate of artificial granite waste residue
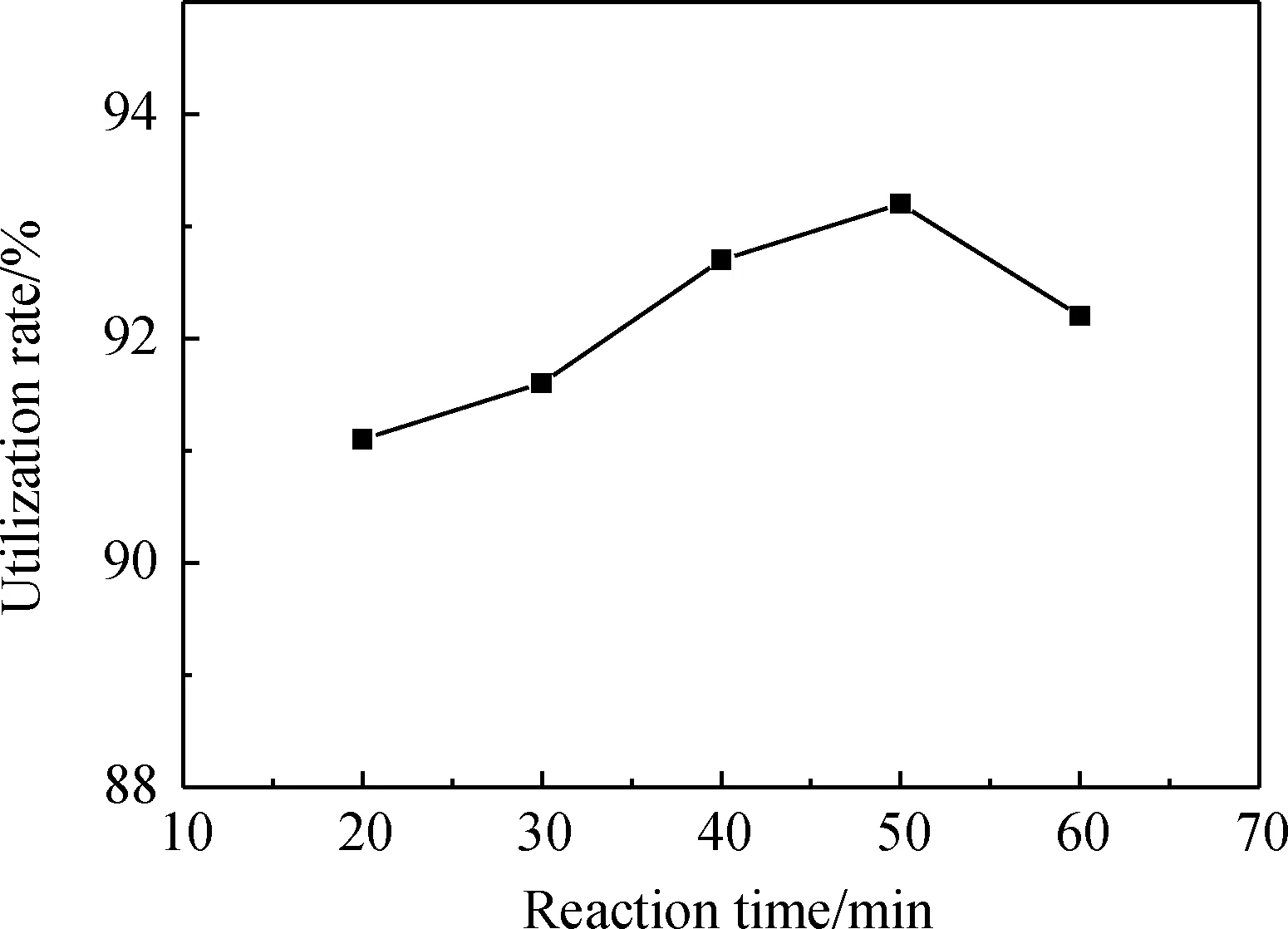
图4 反应时间对人造岗石废渣利用率的影响Fig.4 Effect of reaction time on the utilization rate of artificial granite waste residue

图5 硫化物沉淀剂的添加量对铁离子去除率的影响Fig.5 Effect of the amount of sulfide precipitator on iron ion removal rate
由图4可知,随着反应时间的增加,人造岗石废渣的利用率呈现出先升高后降低的趋势,在50 min时出现最高点,利用率为93.2%,造成这个曲线变化的原因是当反应时间过短时,还有部分甲酸未参与反应,产生大量气泡的现象;当反应时间过长时,造成甲酸挥发量损失过多。故选择50 min为最优的反应时间。
2.5 硫化物沉淀剂的加入量对铁离子去除率的影响
其他条件不变的情况下,取5 mL处理前后的甲酸钙溶液进行实验,改变硫化物沉淀剂的添加量,分析不同硫化物沉淀剂的添加量(0 mL、0.05 mL、0.10 mL、0.15 mL、0.20 mL、0.25 mL)对铁离子去除率的影响,其结果如图5所示。
采用分光光度法测定铁离子吸光度,经计算未添加硫化物沉淀剂的甲酸钙溶液中铁离子浓度为11.012 4 μg/mL。从图5可以看出,当滴加0.15 mL硫化物沉淀剂时,此时甲酸钙溶液中铁离子浓度为0.135 4 μg/mL,铁离子的去除率为98.77%,随着硫化物沉淀剂添加量增加反而呈下降的趋势,这是因为人造岗石废渣中铁系染料成分主要为氧化铁,与甲酸反应后,在中性条件下以Fe3+存在,添加稍过量的硫化物沉淀剂后生成Fe2S3沉淀,过滤后可以去除,当足量时,添加的硫化物沉淀剂反而影响了吸光度,造成铁离子去除率降低。故选择滴加0.15 mL硫化物沉淀剂作为最优条件。
2.6 钙离子和甲酸钙浓度及收率的计算
EDTA标准液的浓度为0.05 mol/L,硫代硫酸钠标准液的浓度为0.1 mol/L,空白实验所消耗硫代硫酸钠标准液的体积为13.23 mL,其相关数据如表1所示。
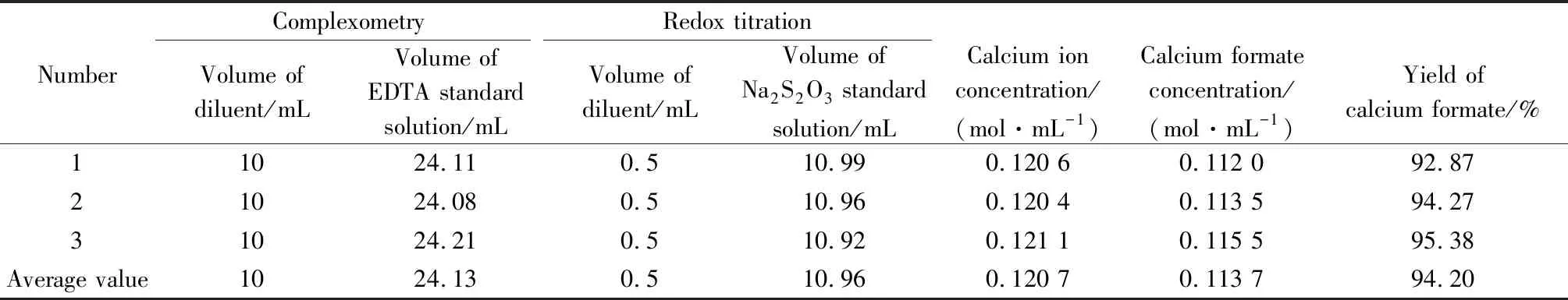
表1 产品定量分析Table 1 Quantitative analysis of products
从表1可以看出,以人造岗石废渣为原料合成甲酸钙的工艺研究是可行的,其钙离子的浓度为0.120 7 mol/mL,甲酸钙的浓度为0.113 7 mol/mL,收率为94.20%。为了提高产物的质量,可加入少量的甲酸调节pH值,其目的是为了去除杂质碳酸钙。
2.7 人造岗石废渣与甲酸钙的形貌分析
图6为人造岗石废渣的SEM照片,图7为人造岗石废渣合成甲酸钙的SEM照片,由图6可知,人造岗石废渣表面有固化的不饱和树脂粘连在一起,较为光滑,看不出颗粒状的重质碳酸钙,并呈现不规则的形状;从图7可以看出在放大倍数为20 000倍下,合成的甲酸钙晶体颗粒团聚,晶体紧密连在一起,晶体呈现八面体的形状,还有部分晶体生长的现象,平均粒径为1 μm,说明人造岗石废渣合成的甲酸钙按照一定的晶型逐渐生长。

图6 人造岗石废渣SEM照片Fig.6 SEM image of artificial granite waste residue

图7 产物甲酸钙SEM照片Fig.7 SEM image of calcium formate
2.8 人造岗石废渣与产物甲酸钙的物相分析
对人造岗石废渣和产物甲酸钙进行XRD分析,结果如图8和9所示。
图8为人造岗石废渣的XRD图谱,通过与标准碳酸钙图谱对比分析,在相对应的2θ处,大部分的衍射峰都与标准碳酸钙图谱相对应。通过查询资料可知,在2θ为29.36°、39.32°、47.46°时有对应的方解石(104)、(112)、(018)晶面。故可判断人造岗石废渣的组成主要为方解石型碳酸钙[18];图9为人造岗石废渣合成甲酸钙的XRD图谱,和标准甲酸钙图谱数据对比分析,在相对应的2θ处,标准甲酸钙图谱与合成甲酸钙的特殊峰基本重合,只是峰的衍射强度不同,其中在2θ为59.96°、61.13°、62.52°、65.45°的衍射角与碳酸钙标准图谱相对应,故可判断人造岗石废渣合成的产物为甲酸钙。
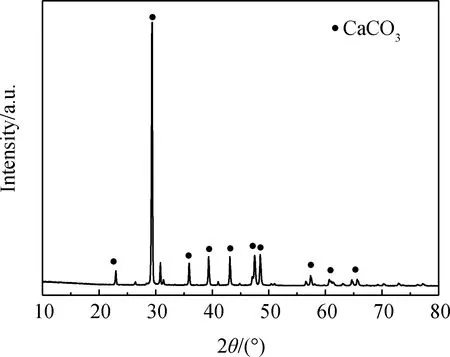
图8 人造岗石废渣XRD图谱Fig.8 XRD pattern of artificial granite waste residue

图9 人造岗石废渣合成甲酸钙的XRD图谱Fig.9 XRD pattern of synthetic calcium formate from artificial granite waste residue
2.9 人造岗石废渣与产物甲酸钙的红外光谱分析
对人造岗石废渣和产物甲酸钙进行红外光谱测定,结果如图10和11所示。并对两个图的吸收峰与标准图谱数据进行比较。
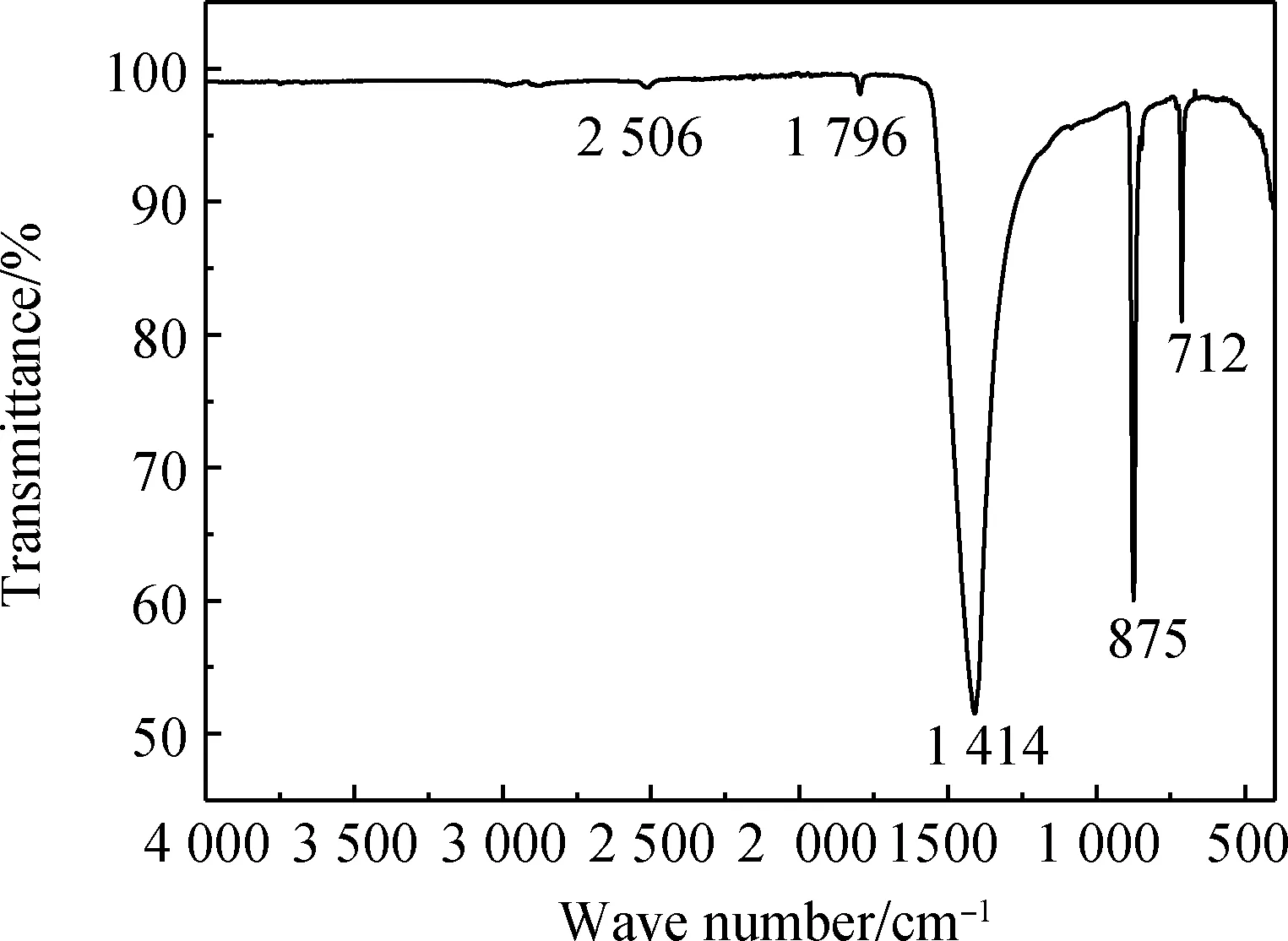
图10 人造岗石废渣红外光谱Fig.10 IR spectrum of artificial granite waste residue
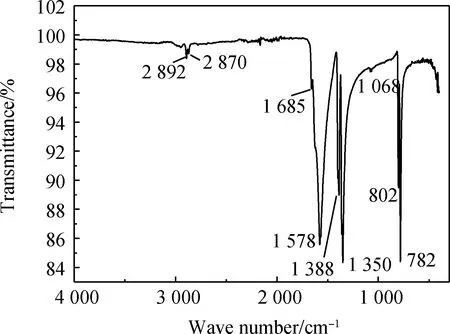
图11 产物甲酸钙的红外光谱Fig.11 IR spectrum of calcium formate
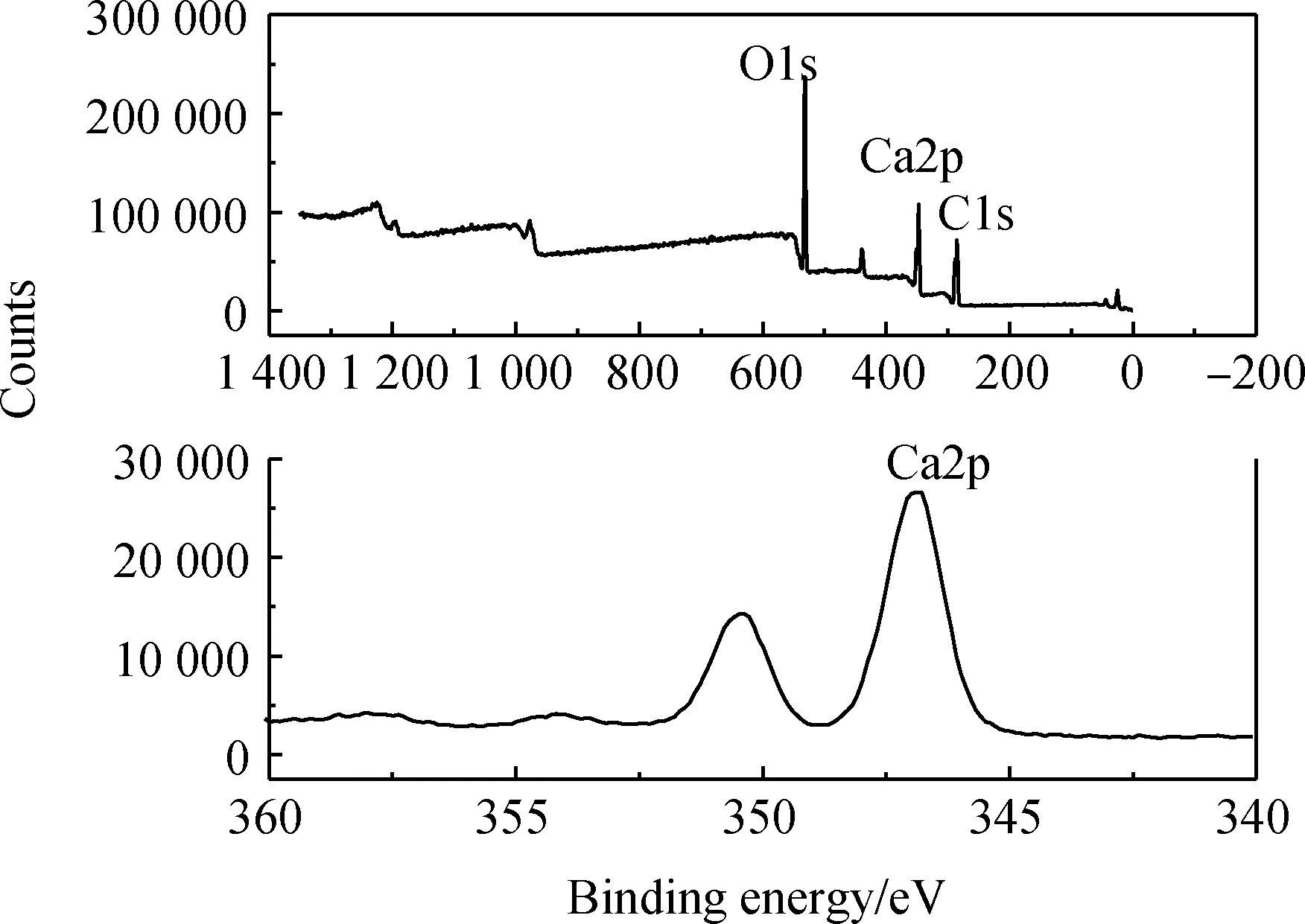
图12 产物甲酸钙的XPS全谱图和Ca元素的XPS图谱Fig.12 XPS full spectrum of calcium formate and XPS spectrum of Ca element
图10为人造岗石废渣的红外光谱图,通过资料可知,当波数为712 cm-1、876 cm-1、1 421 cm-1时,碳酸钙为方解石型[19],其中人造岗石废渣的特征吸收峰为712 cm-1、875 cm-1、1 414 cm-1,故可判断人造岗石废渣的物相主要为方解石型碳酸钙;图11为产物的红外光谱图,结合标准甲酸钙图谱与产物的红外光谱有相对应的吸收峰,说明合成的产物主要为甲酸钙,其中波数782 cm-1、802 cm-1、1 068 cm-1是由C-O键伸缩振动引起的;波数在1 350 cm-1、1 388 cm-1时为羧酸根的对称伸缩振动吸收带,1 578 cm-1为羧酸根的反对称伸缩振动吸收带;波数为2 870 cm-1、2 892 cm-1时有吸收峰是由于醛基中的C-H键伸缩振动引起的,以上大部分的峰值都能与标准甲酸钙图谱相对应,故可判断合成的产物为甲酸钙。
2.10 产物甲酸钙的能谱分析
图12为产物甲酸钙的XPS全谱图和Ca元素的XPS谱,从图12产物甲酸钙的XPS全谱中可以看出甲酸钙晶体中含有Ca、O、C元素,经XPS峰面积积分计算得到产物的原子比接近于1∶2∶4,从Ca元素的XPS谱可知Ca的化合价态为+2价,表明所得产物的化学式为Ca(HCOO)2。
3 结 论
(1)以人造岗石废渣为原料,采用中和法合成甲酸钙,最优的工艺条件为:人造岗石废渣与甲酸投料的质量比为1.0∶1.3、反应温度为50 ℃、搅拌速度为430 r/min、反应时间为50 min、滴加硫化物沉淀剂的体积为0.15 mL。
(2)加入硫化物沉淀剂,通过分光光度计测定吸光度,计算出甲酸钙溶液中铁离子去除率为98.77%;并采用络合滴定和氧化还原滴定法计算出钙离子的浓度为0.120 7 mol/L,甲酸钙的浓度为0.113 7 mol/L,从而计算出甲酸钙的收率为94.20%。
(3)表征结果说明:人造岗石废渣呈现不规则的形状,表面较为光滑;产物甲酸钙呈现八面体的形状,平均粒径为1 μm,说明合成的甲酸钙按照一定的晶型逐渐生长成型,结合红外光谱和能谱分析可判断为甲酸钙晶体。

