HPV16型L1蛋白优势表位原核表达及其血清学验证
侯江厚,张灵霞,孙雯娜,刘艳华,杨秉芬,孙卫国
(1.昆明市妇幼保健院,云南 昆明 650013;2.解放军总医院第八医学中心结核病研究所全军结核病防治重点实验室 结核病诊疗新技术北京市重点实验室,北京 100091)
人乳头瘤病毒(human papillomavirus,HPV)的持续感染是宫颈癌的主要病因,其中HPV16型与宫颈癌的关系最为密切[1]。另外,其他癌症,如喉癌、食管癌、骨髓癌等也与HPV16型感染相关[2]。HPV基因是双链闭环DNA分子,编码含有10个开放阅读框架,晚期编码区的L1蛋白结构比较保守,是HPV主要的病毒衣壳蛋白,其含有多个线性表位和构象表位,这些表位分散于整个病毒衣壳的表面,是诱发机体产生保护性体液免疫反应的主要抗原[3-4]。L1基因的最初129个核苷酸中有1个主要的RNA抑制因子[5],该蛋白N端由15~30个疏水性氨基酸残基组成1个保守的疏水区,这种连续疏水性氨基酸的多肽不利于蛋白在原核系统中的表达,目前获得L1重组蛋白大多采用酵母细胞或昆虫细胞[6]。利用原核系统表达L1虽然有诸多报道,但均未形成规模化商品,存在的问题主要是表达量太低、纯化困难。本课题组前期通过序列分析软件DNAStar对HPV16型L1蛋白的二级结构、优势表位、亲水性等多个参数进行分析,比较蛋白序列潜在的B细胞表位,同时采用BLAST同源性匹配分析来保证预测表位的特异性[7],最终筛选出其C端335~496位氨基酸序列作为L1蛋白B细胞表位的优势序列。孙卫国等[8]利用构建的原核融合表达载体pET-DsbC获得多个抗原表位序列的原核可溶性表达并具有良好的生物活性,作为伴侣分子的DsbC能辅助底物蛋白进行正确的空间折叠,可表现出重组抗原的空间表位,提高血清学应用的敏感性。本研究拟将生物信息学预测的L1蛋白中的335~496位氨基酸序列通过构建pET-DsbCHPV16 L1表达载体进行原核重组、纯化并检测其免疫学活性,为后期HPV16型疫苗的研制,尤其是HPV感染的临床血清学诊断奠定基础。
1 材料和方法
1.1 材料
原核表达载体pET-DsbC、大肠埃希菌Rosetta(DE3)及其感受态细胞由结核病诊疗新技术北京市重点实验室制备并保存。引物和全基因由华大基因公司合成,聚合酶链反应(polymerase chain reaction,PCR)所需试剂、常规分子生物学实验试剂盒均购自天根生化科技(北京)有限公司,限制性内切酶HindⅢ和XhoⅠ、T4 DNA连接酶购自美国NEB公司,蛋白质相对分子质量Marker DNA2000购自美国Sigma公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗人IgG抗体和化学发光检测试剂盒均购自北京中杉金桥生物技术公司。Ni-Sepharose chelating Sepharose Fast Flow亲和树脂填料购自美国GE公司,自行装填纯化柱。LB培养基、磷酸盐缓冲液(phosphatebuffered saline,PBS)配制试剂等均为分析纯试剂。
10份HPV16型感染并发宫颈癌患者单人份血清样本由昆明市妇幼保健院肿瘤科保存,经PCR-荧光探针法(上海之江生物科技股份有限公司)和酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)(上海盈公生物技术公司)检测确认为HPV16型阳性。10份健康人单人份血清由昆明市妇幼保健院体检中心提供。
1.2 方法
1.2.1 全基因合成 根据谷鸿喜等[9]报道的中国妇女感染的HPV16型基因L1片段序列,对335~496位氨基酸对应的核酸序列进行全基因合成,3'端加入大肠埃希菌终止密码子taa。5'和3'端分别引入内切酶HindⅢ和XhoⅠ位点序列,同时合成鉴定引物为:正义引物5'-gatactacacgcagtac-3',T7反义引物5'-gctagttattgctcagc-3'。
1.2.2 pET-DsbC-HPV16 L1表达载体的构建 采用限制性内切酶HindⅢ和XhoⅠ对全基因合成的克隆载体pUC19- L1及表达载体pET-DsbC分别进行双酶切,回收酶切后的L1片段和pET-DsbC,按照摩尔比3∶1的浓度混合后于16 ℃恒温条件下连接过夜,连接产物转化感受态大肠埃希菌Rosetta(DE3),采用菌落PCR筛选阳性克隆株并进行测序鉴定,获得表达菌株pET-DsbCHPV16 L1。
1.2.3 重组HPV16 L1蛋白的原核表达与纯化 将保存的阳性工程菌株于37 ℃震荡培养8 h后进行活化,次日按1∶100比例转种含50 μg/mL卡那霉素的LB培养基中扩大培养,当细菌生长A600nm值约为0.4时加入终浓度为0.3 m m o l的异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG),然后37 ℃条件下诱导7 h,将沉淀菌体在冰浴状态下进行超声破碎,取上清和沉淀分别进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),分析重组蛋白的表达形式。采用镍离子螯合亲和层析柱对上清进行层析(流速为1 mL/min),PBS平衡层析柱5个柱积,以50 mmol/L咪唑除去菌体自身杂蛋白,以150 mmol/L咪唑洗脱收集目的蛋白,采用12% SDS-PAGE分析重组蛋白的纯度,计算纯化得率。
1.2.4 重组HPV16 L1蛋白的免疫印迹法与ELISA分析 取保存的重组DsbC蛋白和重组融合蛋白DsbC-HPV16 L1,用PBS配制成1 mg/mL的母液备用,分别取2 μL进行常规15%SDS-PAGE,半干法电转到硝酸纤维素膜上,然后分别以1∶20稀释后的宫颈癌患者阳性血清、体检健康者血清进行孵育,采用磷酸盐吐温缓冲液(phosphate-buffered saline Tween,PBST)洗涤,以1∶3 000稀释的HRP标记羊抗人IgG抗体进行第2次孵育,漂洗干净后,通过化学发光暗室自动曝光显影,采用免疫印迹法判断该重组蛋白的抗原性。采用ELISA分析重组蛋白的免疫学活性。将用碳酸钠盐溶液稀释的DsbC-HPV16 L1(终浓度为7 μg/mL)包被96孔酶标板,以DsbC蛋白作为阴性对照(包被浓度7 μg/mL),每孔100 μL包被过夜,封闭、洗板,将用PBST 1∶20稀释的HPV16型阳性血清和健康人血清分别加入包被孔和对照孔,每孔100 μL,37 ℃孵育1 h,充分洗板后每孔加入1∶1 000稀释的HRP标记的羊抗人IgG抗体100 μL,37 ℃震荡孵育30 min,充分洗板,加入四甲基联苯胺,室温避光反应30 min,加入2 mol/L H2SO4终止反应。采用GEN-PROBD酶标仪(美国ThermoFisher Scientific公司)检测450 nm波长处的A值。
2 结果
2.1 pET-DsbC-HPV16 L1原核重组表达载体的构建
对HPV16 L1蛋白的335~496位氨基酸对应的核酸序列进行分析,按大肠埃希菌密码子偏性、使用频率和优化RNA结构的原则进行全基因合成,然后克隆到pET-DsbC表达载体上,以设计的鉴定引物进行PCR鉴定,1%琼脂糖核酸电泳显示片段大小为570 bp,与预期值相符,见图1。经测序鉴定证实构建成功。
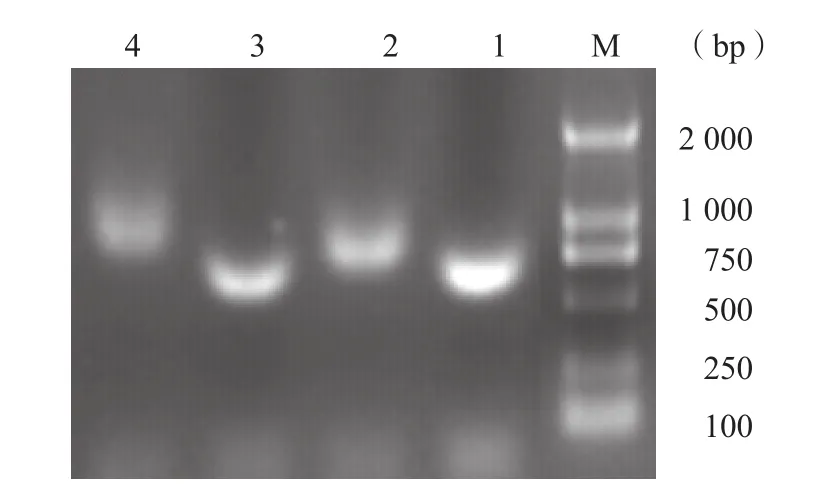
图1 HPV16 L1 C端核酸PCR鉴定凝胶电泳结果
2.2 DsbC-HPV16 L1融合蛋白表达与纯化
DsbC-HPV16 L1融合表达载体经转化大肠埃希菌Rosetta(DE3)宿主菌后以IPTG诱导,可获得目的蛋白的原核表达,冰浴超声破碎后进行SDS-PAGE。结果显示,在目的相对分子质量46 000处(DsbC蛋白为28 000)有明显的蛋白表达,目的蛋白占菌体蛋白的30%以上。超声破碎后的上清液中可溶目的蛋白占表达蛋白的50%以上。见图2。
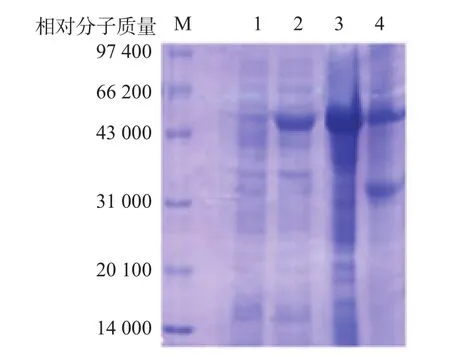
图2 HPV16 L1原核表达产物分析
超声破碎后的上清液以亲和层析纯化,150 mmol/L咪唑洗脱获得的纯化融合蛋白经SDSPAGE分析,纯度为95%,见图3。采用BCA蛋白定量法(重组蛋白纯化得率=纯化后的目的蛋白/上样前上清液总蛋白×50%)计算得重组蛋白纯化得率为22%。
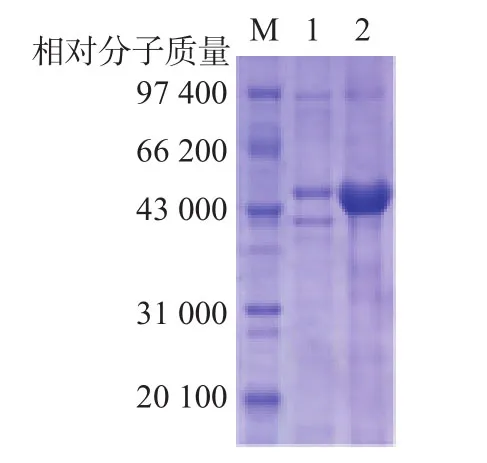
图3 DsbC-HPV16 L1亲和纯化后的电泳分析分析结果
2.3 重组融合蛋白抗原性的免疫印迹法结果
以重组DsbC蛋白为阴性对照,采用免疫印迹法分析原核系统获得的重组DsbC-HPV16 L1蛋白的抗原性。以HPV16型阳性血清为一抗,HRP标记的羊抗人IgG为二抗。获得的重组DsbC-HPV16 L1蛋白与HPV16型阳性血清产生特异的抗原-抗体反应,与重组DsbC蛋白或健康人血清无交叉反应。该重组蛋白具有特异的抗原性。见图4。

图4 DsbC-HPV16 L1重组蛋白免疫印迹法分析结果
2.4 DsbC-HPV16 L1融合蛋白免疫反应性的ELISA分析结果
以重组DsbC-HPV16 L1蛋白、重组DsbC蛋白为包被抗原,采用ELISA检测宫颈癌患者血清特异性HPV16 L1抗体水平。重组DsbC-HPV16 L1蛋白与HPV16型阳性血清有较强的免疫反应性,A450nm均值为0.56,高于健康人血清和PBS阴性对照(A450nm均值分别为0.24和0.21)。重组DsbC蛋白与HPV16型阳性血清、健康人血清和PBS阴性对照的A450nm均值分别为0.31、0.30和0.28,三者之间无差异。见图5。

图5 重组DsbC-HPV16 L1蛋白、重组DsbC蛋白与HPV16型阳性血清、健康人血清和PBS阴性对照的ELISA结果
3 讨论
针对HPV的九价疫苗目前已在国内上市,接种后可诱导出良好的预防效果。英国葛兰素史克公司研发的二价疫苗Cervarix和美国默克公司研发的四价疫苗Gardasil在预防宫颈癌方面有良好的效果[10],但价格昂贵。通过原核表达系统、酵母表达系统、杆状病毒-昆虫细胞表达系统以及转基因植物等均可获得重组HPV16 L1蛋白,但原核系统,尤其是以大肠埃希菌作为宿主菌具有代时短、易控制、遗传背景清楚和廉价等特点,是基因工程工艺首选的宿主菌。重组HPV L1蛋白含有HPV大部分抗原表位,其在多种表达体系中均能自我组装成病毒样颗粒(virus-like particle,VLP)。VLP具有与天然病毒相似的抗原表位和免疫学特性,以VLP免疫动物,获得的免疫血清显示出良好的活性,HPV L1蛋白或其优势表位序列可以成为预防性疫苗或疫苗的组成部分。由于HPV L1蛋白含有较多的稀有密码子和较复杂的结构,国内外虽然有成功利用原核系统完整表达L1蛋白的报道[11],但因表达量低、包涵体复性困难,很难开发成成规模化工艺。本研究通过对HPV16 L1蛋白的氨基酸序列进行分析,同时通过信息学软件对其B细胞表位进行综合预测,发现其C端335~496位氨基酸含有较丰富的B细胞表位,与王爱萍等[12]预测的结果较为一致。对这段序列进行密码子和二级结构的优化,通过原核系统获得了HPV16 L1蛋白C端的高效可溶性融合表达,重组蛋白的纯化得率为22%。血清学验证结果显示,重组DsbC-HPV16 L1蛋白与HPV16型阳性血清能产生特异的抗原-抗体反应,且有较强的免疫反应性。目前,筛查宫颈癌患者HPV主要采用PCR技术,存在着假阳性问题,且取材也有一定的困难,因此经典的血清学方法,如ELISA更为适合。以本研究获得的重组蛋白为抗原建立检测HPV16型的ELISA方法,将为宫颈癌患者或类似疾病患者进行早期预防筛查或术后复查提供一种简单、可行的方法。本研究的局限性在于阳性样本量较小,后期将扩大样本量,进一步验证本研究结果,以期能研制出新型的检测试剂盒,造福患者。
综上所述,本研究采用原核表达系统实现了HPV16型L1蛋白优势抗原表位的可溶性高表达,获得的重组蛋白具有良好的免疫原性和免疫学活性,这为HPV预防性疫苗、宫颈癌早期筛查及临床诊断试剂的开发奠定了基础。

