甲状腺癌患者超声血管化指数与肿瘤标志物和血管新生指标水平的相关性
梁丽媚 刘绍明 袁建均 陈俊君 袁智帆 何文旭 何志忠
甲状腺癌是头颈部常见的恶性肿瘤,其发病率约占全身恶性肿瘤的1%[1]。早期甲状腺癌接受治疗后5 年生存率较高,因此,其早期准确诊断是治疗的关键。三维能量多普勒超声是近年新兴的超声检查方法,该方法将能量多普勒和血管三维技术结合起来,能有效评估受检部位内部血流信号[2]。报道[3]显示,应用三维能量多普勒超声检测甲状腺血管化指数(vasculanzation index,VI)有助于甲状腺良恶性肿瘤的鉴别诊断。甲状腺癌患者的肿瘤标志物甲状腺球蛋白(TG)、癌胚抗原(CEA)、半乳糖血凝素-3(Gal-3)水平均会升高[4],血管内皮生长因子(VEGF)、血管生成素-2(Ang-2)、胰岛素样生长因子-Ⅱ(IGF-Ⅱ)则可以反映血管新生情况[5]。目前关于甲状腺癌患者VI 的研究尚不多见,本研究通过分析甲状腺癌患者VI与肿瘤标志物和血管新生指标的相关性,旨在为甲状腺癌的诊断和病情评估提供依据。
资料与方法
一、研究对象
选取2017 年10 月至2019 年10 月我院收治的经病理证实的甲状腺癌和甲状腺腺瘤患者各60例(甲状腺癌组和甲状腺腺瘤组)。甲状腺癌组中男26 例,女34 例,年龄27~70 岁,平均(49.15±6.85)岁;肿瘤直径5~16 mm,平均(7.73±1.24)mm;其中乳头状癌25 例,滤泡癌13 例,髓样癌16 例,未分化癌6 例;TNM 分期Ⅰ期13 例,Ⅱ期20 例,Ⅲ期19 例,Ⅳ期8 例;淋巴结转移者19例,未转移者41例。甲状腺腺瘤组中男25例,女35 例,年龄25~72 岁,平均(48.56±7.67)岁;肿瘤直径5~15 mm,平均(7.65±1.22)mm。两组患者一般资料比较差异均无统计学意义。纳入标准:①均为原发性甲状腺肿瘤;②均经病理证实;③均为初次发病,检查资料完整;④均行三维能量多普勒超声检查。排除标准:①合并甲状腺功能亢进或减退者;②妊娠期和哺乳期妇女;③术前行放化疗及免疫治疗者;④合并其他系统肿瘤者。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
使用Philips iU Elite、iU 22 彩色多普勒超声诊断仪,探头频率7.5~10.0 MHz。患者取仰卧位,头部后仰,充分暴露颈部,先行常规超声检查,确定结节位置、数量、大小等,然后切换至三维能量多普勒超声模式,在6个平面勾画出甲状腺结节的轮廓,计算VI。
患者入院时常规采集外周静脉血5 ml,应用酶联免疫吸附法检测血清TG、CEA、Gal-3、VEGF、Ang-2及IGF-Ⅱ水平,试剂盒购自北京华夏远洋科技有限公司,严格按照试剂盒操作说明进行。
比较两组VI及实验室检查指标的差异。
三、统计学处理
应用SPSS 24.0统计软件,计量资料以x±s表示,两组比较行t检验,多组比较采用单因素方差分析。VI与肿瘤标志物和血管新生指标的相关性采用Pearson相关分析法。P<0.05为差异有统计学意义。
结 果
一、两组三维能量多普勒超声检查情况
三维能量多普勒超声检查示甲状腺癌组病灶血供丰富,VI 为2.63±0.72,显著高于甲状腺腺瘤组(0.92±0.26),差异有统计学意义(t=17.303,P=0.000)。见图1。

图1 两组三维能量多普勒超声图像
二、实验室检查指标比较
1.肿瘤标志物水平比较:甲状腺癌组患者血清TG、CEA、Gal-3水平均高于甲状腺腺瘤组患者(均P<0.05)。见表1。
2.血管新生指标水平比较:甲状腺癌组患者血清VEGF、Ang-2、IGF-Ⅱ水平均高于甲状腺腺瘤组患者(均P<0.05)。见表1。

表1 两组肿瘤标志物和血管新生指标比较(x±s)
三、不同类型甲状腺癌患者VI水平比较
不同肿瘤直径、病理分型甲状腺癌患者VI比较差异均无统计学意义,TNM 分期Ⅲ~Ⅳ期甲状腺癌患者VI 高于Ⅰ~Ⅱ期患者,淋巴结转移患者VI 高于未转移患者(均P<0.05)。见表2。
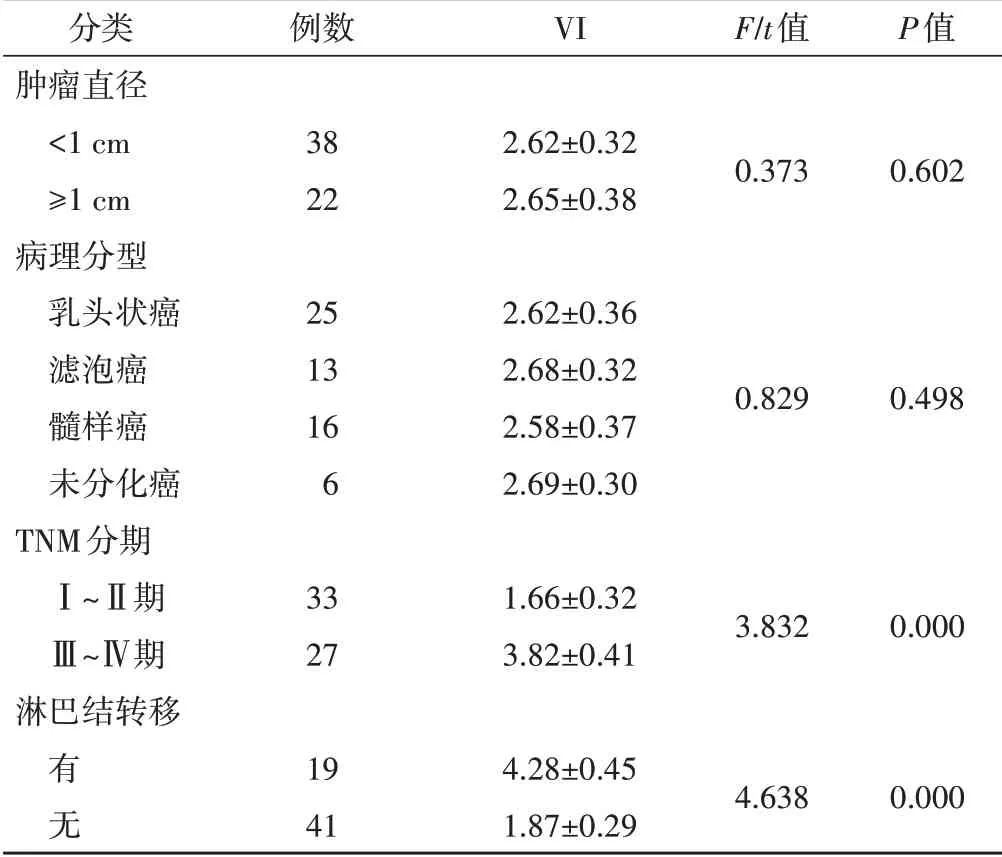
表2 不同类型甲状腺癌患者VI比较
四、相关性分析
Pearson 相关分析显示,甲状腺癌患者VI 与血清TG、CEA、Gal-3、VEGF、Ang-2 及IGF-Ⅱ水平均呈正相关(r=0.623、0.443、0.528、0.629、0.608、0.483,P=0.019、0.031、0.024、0.019、0.021、0.028)。
讨 论
近年来,随着临床诊断筛查技术的不断发展,甲状腺肿瘤的检出率逐渐升高,如何鉴别其良恶性成为临床面临的重要问题。目前,病理检查仍是诊断甲状腺癌的“金标准”,但细针穿刺细胞学检查属于有创检查,其应用临床受限[6]。CT 和MRI 虽可以显示甲状腺癌的影像资料,但价格昂贵,且结果具有滞后性,目前主要用于诊断怀疑发生远处转移的甲状腺癌。常规超声是临床筛查甲状腺疾病的常用方法,但其鉴别甲状腺结节良恶性及评估肿瘤恶性程度的效果欠佳。三维能量多普勒超声是近年新兴的超声检查方法,其应用能量多普勒超声技术对血流中的红细胞密度和散射强度进行成像,再应用三维重建对组织中的血流灌注情况进行立体成像,以反映检测器官和组织的血流灌注情况和血管化情况[7]。
甲状腺癌患者的甲状腺血流丰富,了解器官和病灶的血流灌注情况及血管新生情况对评估病变具有重要意义。本研究发现甲状腺癌组患者VI 高于甲状腺腺瘤组患者(2.63±0.72 vs. 0.92±0.26),差异有统计学意义(P<0.05),与樊小虎等[8]研究结果一致,原因可能是在甲状腺癌发生过程中,病灶内有大量新生血管形成,血流灌注和血管密度均显著增加,故甲状腺癌患者VI 水平升高。本研究还对不同类型甲状腺癌患者VI 进行了分析,结果表明TNM 分期Ⅲ~Ⅳ期甲状腺癌患者VI 高于Ⅰ~Ⅱ期患者,淋巴结转移患者VI 高于未转移患者,差异均有统计学意义(均P<0.05)。分析原因主要是在肿瘤生长过程中不断有新生血管形成,因此VI 升高,而新生血管的管壁结构不完整,管壁较薄,肿瘤细胞容易穿透血管内皮细胞发生转移,导致肿瘤进展和转移[9-10],这也提示VI 可以为甲状腺癌淋巴结转移风险和预后评估提供依据。
检测肿瘤标志物是目前诊断恶性肿瘤的另一种重要方法,本研究对甲状腺癌和甲状腺腺瘤患者血清TG、CEA、Gal-3 水平进行了比较,发现甲状腺癌患者血清TG、CEA、Gal-3 水平均高于甲状腺腺瘤患者(均P<0.05),说明恶性肿瘤的肿瘤标志物水平明显升高,原因是TG 为甲状腺滤泡上皮细胞分泌的大分子糖蛋白,当发生甲状腺癌时,机体可生成大量TG,并释放入血,导致血清TG 水平升高[11]。CEA 是一种广谱肿瘤标志物,在肝癌、乳腺癌、结肠癌及甲状腺癌患者血清中会升高,Gal-3 是一种半乳糖结合蛋白,具有促进肿瘤增殖和转移的作用[4,12]。本研究还发现甲状腺癌患者血清VEGF、Ang-2 及IGF-Ⅱ水平均高于甲状腺腺瘤患者(均P<0.05),分析原因为甲状腺癌患者体内的肿瘤细胞恶性增殖需要更多的营养供给,从而促使体内新生血管形成。VEGF 和Ang-2 是促进血管生成的重要分子,两者协同作用可以促进肿瘤血管生成[5]。研究[13]表明,VEGF 还可以通过与VEGF 受体结合,增加血管通透性,促进肿瘤的转移。IGF-Ⅱ是一种肽类激素,其可以促进血管内皮细胞增殖,在肿瘤血管结构的重建中起到重要作用[14]。上述结果提示实验室检查发现血管新生指标升高时,应对患者进行重点关注和早期干预,以减少病情恶化的风险。
本研究还发现甲状腺癌患者VI 与血清TG、CEA、Gal-3、VEGF、Ang-2、IGF-Ⅱ水平均呈正相关(均P<0.05),提示VI 可以反映甲状腺癌血管新生情况和肿瘤恶性程度。分析原因可能是能量多普勒超声可对血流中的红细胞密度和散射强度进行成像,能反映组织中的血流灌注情况和血管新生情况,而血清TG、CEA、Gal-3、VEGF、Ang-2、IGF-Ⅱ则可以反映肿瘤的生长情况、血管新生情况及肿瘤恶性程度,因此VI 与上述实验室检查指标均呈正相关,这也提示临床可以应用三维能量多普勒超声检测VI 来反映肿瘤标志物和血管新生指标水平,为甲状腺癌的诊断及恶性程度评估提供一定参考。
综上所述,甲状腺癌患者VI、肿瘤标志物和血管新生指标水平均升高,且VI与TG、CEA、Gal-3、VEGF、Ang-2、IGF-Ⅱ均呈正相关,可以反映肿瘤内血管生成情况,为肿瘤诊断和恶性程度评估提供可靠依据。

