肿瘤内坏死与胰腺导管腺癌预后的相关性研究
李勃,丁秀文,时霄寒,沈硕,高绥之,张国虓,潘亚奇,郭世伟,许熊飞,金钢
(1.海军军医大学长海医院肝胆胰外科,上海 200433;2.联勤保障部队北戴河康复疗养中心,河北 秦皇岛 066100;3.海军军医大学长海医院临床实验中心,上海 200433)
胰腺导管腺癌(pancreatic adenocarcinoma,PDAC)恶性程度高, 5年生存率小于9%,术后5年存活率仅为20%~25%[1],所以基于术后病理因素的分期系统在病人术后生存期预测及精准管理中发挥不可替代的作用。然而目前胰腺癌常用的美国癌症联合会(AJCC)第八版TNM分期系统不能很好地预测术后生存期,即使相同TNM分期病人预后相差亦甚大[2],可能与PDAC异质性大相关[3]。因此,在组织病理学方面进一步寻找有预后预测能力的因素具有重要的临床价值。组织内低氧是肿瘤普遍存在的一个现象[4],且是肿瘤预后不良的一个危险因素[5]。PDAC的一个显著特点是间质显著增生纤维化,可能加剧肿瘤内部乏血供状态,所以PDAC组织内低氧状态持续存在,在组织形态学上表现为坏死[6]。此外,与缺血性坏死不同的颗粒状坏死(granular necrosis,GN)亦受到关注,其特点是可见与肿瘤明显分界的局灶坏死,一般为镜下可见,最大可为几毫米或更大,表现为广泛的细胞核颗粒状碎裂和细胞质碎片,不伴中性粒细胞浸润[7],而且研究发现GN与肿瘤分化差相关,在恶性肿瘤中可作为预测预后的指标之一[7]。由于GN相对缺血所致的坏死面积小,既往研究病理诊断中可能存在漏诊漏报的现象。此外,PDAC异质性显著,肿瘤局部评估亦可能导致坏死诊断的漏诊。因此本研究的目的是应用数字化全组织病理图像全面细致评估坏死(包括缺血所致坏死及GN)在PDAC中作为预测预后指标的价值。
资料与方法
一、病人资料
回顾性分析2016年12月至2017年8月在海军军医大学长海医院肝胆胰腺外科行胰腺手术治疗并术后病理诊断为PDAC的病人资料。排除标准:①无随访数据;②术后生存期<90 d;③远处转移或R2(肉眼可见肿瘤切缘残留)切除。检索查阅相关病历,共检索出230例,排除不符合纳入标准30例(其中7例无随访数据,13例术后生存期<90 d,远处转移或R2切除10例),200例纳入本研究。
二、病理检查及随访
严格按照海军军医大学长海医院病理科胰腺病理标本处理规范并出具格式化的病理报告。肿瘤部位分为胰头颈钩突、胰体尾和多部位。TNM分期依据AJCC(第八版);分化程度(G)和切缘状态(R)评价依据胰腺癌美国国家综合癌症网络(NCCN)指南(2020.Verion 1),其中G1~3分别为高中低分化,R1定义为距切缘1 mm内肿瘤细胞累及。神经侵犯和脉管侵犯分为有和无。两位高年资病理医生利用数字化全组织病理图像重新评定坏死,包括缺血所致坏死和GN,肿瘤内存在其中任何一种形式即记为有坏死。随访开始于病人出院,终点为死亡,本研究随访截止时间为2020年4月,随访主要采用电话和查阅门诊病历系统两种方式完成。术后病人按照NCCN指南(2020.Verion 1)进行辅助治疗。总生存期(over survival,OS)为病人术后生存时间。
三、统计学处理
采用SPSS(25.0版)统计软件,分类变量采用χ2检验或者Fisher确切检验,等级分类变量采用两独立样本Mann-WhitneyU秩和检验。Logistic多因素回归分析与坏死独立相关的因素。生存分析采用乘积极限法(Kaplan-Meier法)和Cox比例风险模型进行生存分析,并进行对数秩检验(Log-Rank检验)。以P<0.05为差异有统计学意义。
结 果
一、坏死与临床病理因素的相关性分析
200例病人中,男女比例为1.67∶1。91例(45.5%)评定为有坏死,109例为无坏死,2组病例具体临床特征比较见表1。单因素分析中,坏死与G(P<0.001)、脉管内癌栓(P=0.014)和T分期(P<0.001)密切相关;Logistic多因素分析中坏死独立相关因素为:G3/G1~2[OR=5.23,95%CI(2.56,10.67),P<0.001];T2/T1[OR=3.38,95%CI(1.61,7.12),P=0.001];T3/T1[OR=6.65,95%CI(2.13,20.8),P=0.001]。
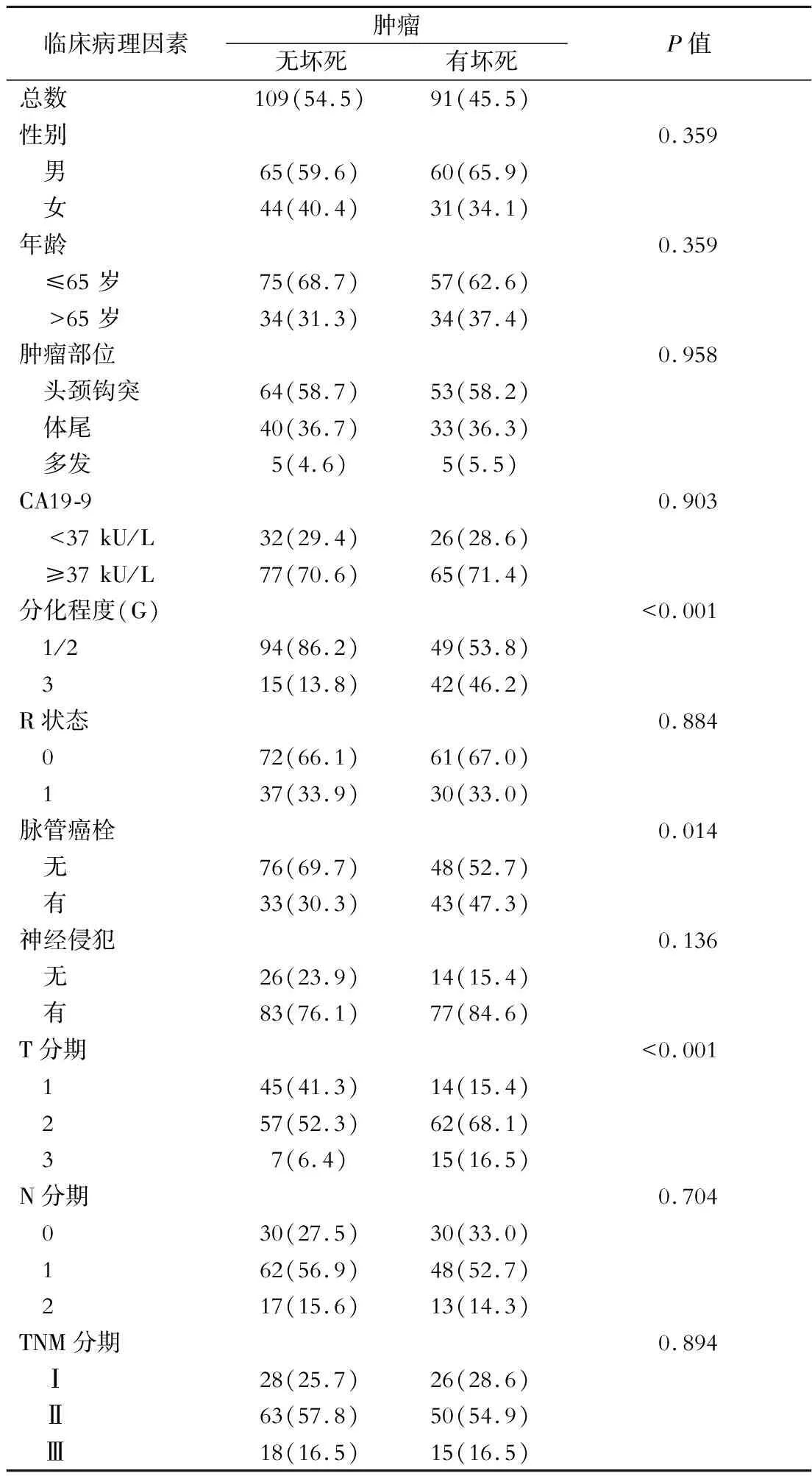
表1 坏死与临床病理因素的相关性分析[例(%)]
二、生存分析
本研究病例随访时间为3.2~39.3个月,中位随访时间为14.4个月,随访期间106例(106/200)病人死亡,中位生存时间为16.9个月。单因素Cox分析提示TNM分期、坏死、G、神经侵犯、脉管癌栓和R状态与生存密切相关(P<0.05),而Cox多因素分析提示仅前4个因素与生存独立相关(表2),其中有坏死组较无坏死组术后生存风险显著升高[HR=1.78,95%CI(1.18,2.69),P=0.006]。
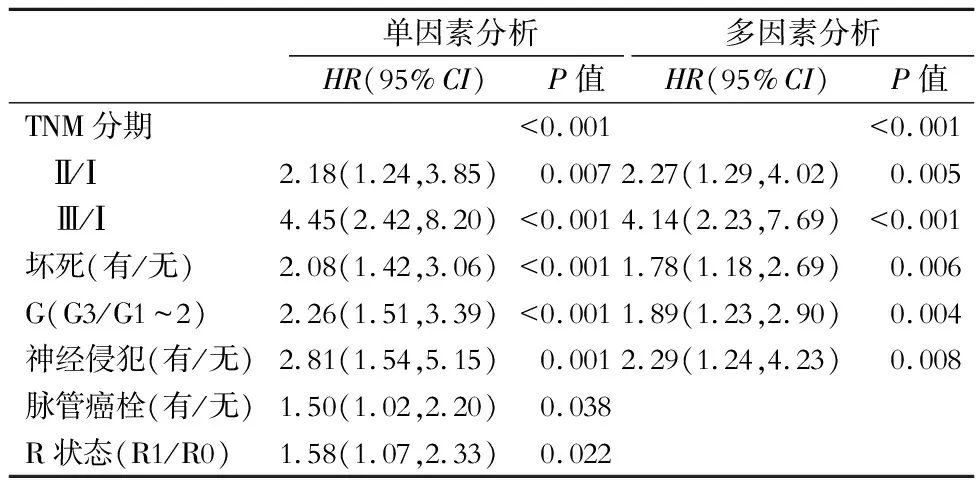
表2 临床病理因素的Cox回归分析
三、坏死优化TNM分期系统预测预后的研究
本研究发现TNM分期预测预后的效能有待优化(图1A),尤其是TNMⅡ期病人113例,其异质性大,同一分期病人预后差异大。且本研究中发现坏死预测预后的效能优(图1B),所以在TNM分期的基础上进行坏死分层(有/无)研究,生存分析见图2A。进一步整合为4分类,即分类A(28例): TNMⅠ期无坏死;分类B(89例):TNMⅠ期有坏死和TNMⅡ期无坏死;分类C(68例): TNMⅡ期有坏死和TNMⅢ期无坏死;分类D(15例):TNMⅢ期有坏死,统计分析结果显示4分类间生存预后差异有统计学意义(P<0.001,图2B)。
讨 论
PDAC预后差,异质性大,即使同一分期病人预后亦存在显著差异。所以为了实现病人的精准管理,改善病人预后,亟待发掘可优化目前分期的病理指标。肿瘤内部的低氧状态形成的局部微环境可能与肿瘤的耐药和复发相关[8],且肿瘤内部低氧状态与肿瘤坏死密切相关[9]。而肿瘤内坏死的评估相对低氧的检测方法简单易行,可由病理医生在术后病理检查中完成,所以坏死有望成为优化病理分期的指标。然而,病理组织学诊断坏死的标准还存在诸多不一致,Hiraoka等[6]在PDAC研究中将坏死分为大片坏死和微小坏死,且2类坏死的病人预后差异无统计学意义。而新近研究将坏死分为GN和缺血性坏死,GN既往被命名为凝固坏死或微小坏死[7]。综上所述,本研究中坏死包括GN和缺血性坏死。
本研究证实肿瘤直径越大、分化程度越差,肿瘤内部出现坏死的概率越高,既往研究亦证实上述结论[6],提示分化差肿瘤增殖快,体积大,肿瘤内部血供差,更易发生坏死。进一步生存分析发现,除外目前广泛采用的预测预后的TNM分期,坏死、G分期和神经侵犯是预后的独立危险因素,但是G1~2和G3病例数分别为143例和57例,有神经侵犯和无神经侵犯病例数分别为160例和40例,可见二者分类存在明显的不均衡,不适合作为诊断指标对病人进行分层研究。而坏死二分类均衡性较好,适合作为PDAC病人术后预测预后的分层指标。在TNM分期的基础上,进一步研究坏死对术后病人生存分层的价值,其中TNMⅠ期伴坏死和TNMⅡ期无坏死、TNMⅡ期伴坏死和TNM Ⅲ期无坏死在术后生存上差异无统计学意义,所以TNM分期结合坏死可将术后PDAC病人分为4类,据此可更好地预测病人的术后生存期,进而优化病人术后管理。
此外,影像学的研究中发现在壶腹周围癌中,PDAC更多见肿瘤内坏死[10]。而且增强CT中的非强化区域(poorly enhanced area,PEA)与病理学坏死诊断相关性好,PEA与肿瘤复发和总生存期密切相关[11]。由此可见,坏死亦可用于肿瘤不可手术切除病人的预后判断,指导病人的诊疗,如新辅助化疗方案的选择,伴坏死肿瘤是否对特定的化疗方案敏感,有待未来深入研究、明确。
坏死与PDAC肿瘤细胞可能存在相互作用的关系,肿瘤自身生物学特性(如低分化增殖快)决定了其内部易出现缺氧状态,进而导致肿瘤腺体破裂成碎片及黏液从腺体内溢出,即产生微小的坏死灶。随着肿瘤腺体破坏的增多,坏死灶亦不断增大,形态出现不规则,并且可加速周围胶原纤维束的形成[11]。此外坏死可分泌或趋化大量的细胞因子于肿瘤内部,由此可见坏死可能通过改变肿瘤微环境而影响肿瘤的预后[8]。
我们利用单中心回顾性数据研究发现,PDAC肿瘤内坏死的独立危险因素包括肿瘤分化程度和肿瘤大小。且肿瘤内坏死是PDAC预后的独立危险因素,在TNM分期的基础上整合肿瘤坏死,可将PDAC术后病人分为4类,其有助于准确判断病人预后,指导病人的术后管理。本研究存在回顾性研究的常见局限性;结论来源于单中心数据,有待外部数据的验证。

