盆底腹膜缝合在直肠癌根治术中的应用
毛献双 肖昌高 梁开才 梁帮强

【摘要】目的 通过对比试验了解腹腔镜直肠癌根治术后对盆腔腹膜缝合在直肠癌根治术中的应用。方法 纳入我院2014年04月-2016年04月间进行腹腔镜直肠癌根治术的患者60例,观察2组患者的术后相关数据及恢复状况:术后下床时间、创口愈合时间和肠蠕动恢复时间;观察患者术后并发症:肠梗阻、内疝、盆腔感染;观察患者术后肿瘤复发率;术后康复时间、住院时间;术后需放疗患者是否有放疗性肠炎症状。结论 通过术后长期随访观察实验组较对照组患者,肛门排气时间及住院时间少于对照组,止痛药次数亦少于对照组,引流管引流液少(创面渗液少),可缩短引流管留置时间,减少肠梗阻几率及会阴切口感染,在术后行放疗亚组患者放疗性肠炎的发生率也少于对照组患者。即Miles术后行盆底腹膜缝合患者近期或远期并发症均少于未行盆地腹膜缝合患者。
【关键词】直肠癌;盆腔;腹膜缝合;并发症
【中图分类号】R574.63 【文献标识码】A 【文章编号】2107-2306(2020)03-105-02
直肠癌属于临床常见的消化系统恶性肿瘤[1],其中低位直肠癌占总发病率的70%~75%[2]。近年来,随着人们生活方式与饮食结构的改变,直肠癌发病率不断升高[3]。目前,直肠癌腹腔镜切除已成为治疗直肠癌的主要治疗方式[4],随着手术方式的不断改进,吻合器的应用和辅助治疗的推广,使直肠癌手术不断完善,1908年Miles开展了经腹会阴联合切除治疗直肠癌,术后易发生会阴切口感染、肠梗阻等,严重影响患者术后生活质量,主要原因为盆腔与腹腔未完全封闭缝合,导致腹腔镜直肠癌Miles术后盆腔腹膜常有较大缺损[5],尤其在联合子宫、附件、膀胱等多脏器切除时[6]。由于Miles手术的切除范围较大,手术后盆腔内已无组织支撑,关闭盆底腹膜的张力高或腹膜关闭时可能存在裂隙,术后易因盆腔感染蔓延至腹腔以及术后由于重力作用可能导致腹膜缝线断裂,小肠通过腹膜裂隙钻入盆底更容易造成梗阻或内疝[7],也有部分学者则持相反意见,段东明等采用修补盆底腹膜,将小肠与骶前间隙隔开,减少了形成内疝及粘连性肠梗阻机会[8]。且大网膜血运丰富,具有抗感染及较强的修复能力,能促进创口早期愈合[9]。目前关于直肠癌Miles手术是否关闭盆底腹膜的问题一直是处于争论的问题。本研究选择60例腹腔镜低位直肠癌患者作为研究对象,分析Miles手术缝合腹膜后并发症的出现;生存率;肿瘤复发情况。
1资料与方法
1.1 一般资料
选择腹腔镜直肠癌Miles术60例,随机分为观察组和对照组,每组30例,对照组中,男16例,女14例;平均年龄:67.1(21.1±25.9)岁;平均病程:5.4(3.9±5.6)个月;BMI:22.5(3.6±3.1)kg/m2;、肿瘤TNM 分期。观察组中,男21例,女9例;平均年龄:64.6(24.6±20.4)岁;平均病程:5.5(4±4.5)个月;BMI:22.3(4.8±3.6)kg/m2;肿瘤TNM分期,2组患者临床资料比较差异无统计学意义(P>0.05)。其中,观察组:30例,腹腔镜直肠癌Miles术缝合盆腔腹膜,对照组:30例,腹腔镜直肠癌Miles术不缝合盆腔腹膜。同时将两组中术后需再行放疗患者分为2个亚组,收集4组的相关数据进行比较研究,采用统计学方法,观察分析对比两组患者的疗效。
1.2 纳入标准
①术前经肠镜活检与术后病理诊断均为直肠癌,具有腹腔镜直肠癌手术适应证;②严格遵守操作标准,行RO切除;③术中留置引流管,术后保证引流畅通;④本次研究经医院伦理委员会批准,且所有患者均对研究内容知情同意
1.3治疗方法
两组患者均行微创腹腔镜直肠癌根治术,根据全直肠系膜切除(total mesorect alexcision,TME)原则锐性分离切除直肠系膜与直肠肿瘤。其中观察组30例患者应用腹腔镜直肠癌Miles术缝合盆腔腹膜,对照组30例,应用腹腔镜直肠癌Miles术不缝合盆腔腹膜。
1.4 疗效观察
观察2组患者的术后相关数据及恢复状况:术后下床时间、创口愈合时间和肠蠕动恢复时间;观察患者术后并发症:肠梗阻、内疝、盆腔感染;观察患者术后肿瘤复发率;术后康复时间、住院时间;术后需放疗患者是否有放疗性肠炎症状。
1.5统计学处理
数据采用SPSS 13.0软件进行统计分析,统计学方法采用t检验和x2检验,计量资料用( )表示,比较采用t检验;计数资料用(%)表示,比较采用x2检验。以p<0.05表示差异有统计学意义。
2 结果
1.41 2组患者术后恢复情况比较 观察组患者术后下床时间、创口愈合时间、肠蠕动恢复时间及住院时间均明显短于对照组(P<0.05),见表1
1.42 2组患者术后并发症发生情况比较 观察组患者术后并发症总发生率显著低于对照组 (P<0.05),见表2
1.43 2组患者术后复发率比较 观察组患者术后复发率明显低于对照组(P<0.05),见表3
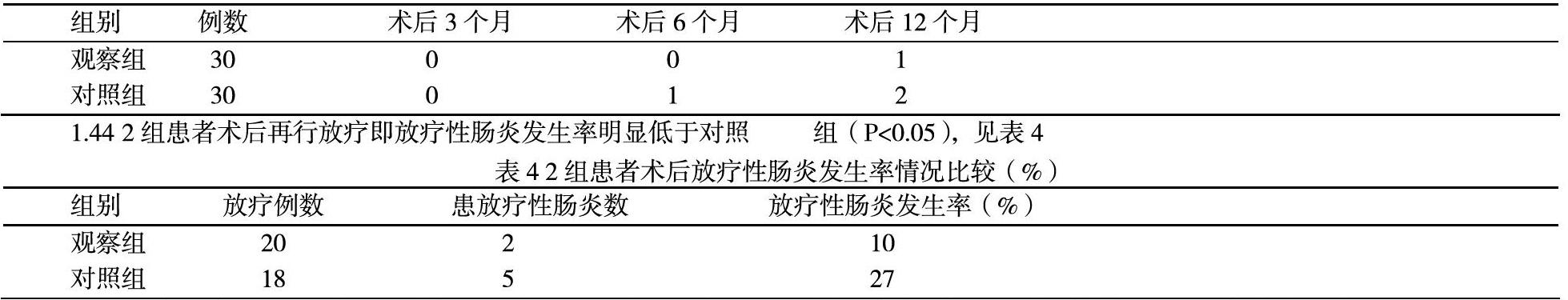
1.44 2组患者术后再行放疗即放疗性肠炎发生率明显低于对照组(P<0.05),见表4
60例患者出院时胃肠功能均已恢复,在术后15天内,观察组患者术后下床时间、肠蠕动时间、平均住院时间经均少于对照组病人,两组病人比较差异均有统计学意义(P<0.05)。在术后共有10例患者出现并发症患者经保守对症治疗后均治愈,其中术后共有5例患者发生肠梗阻,4例出现盆腔感染,分别占8.33%、6.66%; 5例肠梗阻患者中,其中观察组中1例为术后麻痹性肠梗阻,经保守治疗后,术后第5天患者症状好转,对照组中4例患者,其中3例為麻痹性肠梗阻,1例为机械性肠梗阻,均行非手术治疗后治愈出院。4例盆腔感染均出现轻到中度腹膜刺激征,通过腹腔充分引流、抗生素的使用亦出院。在两组患者住院期间观察组病人术后止痛药次数亦少于对照组,引流管引流液少(创面渗液少),可缩短引流管留置时间,减少肠梗阻几率及会阴切口感染,从统计学数据可以看出观察组患者并发症出现率明显低于对照组。
在术后38例患者行放射治疗,两组病人的临床资料比较差异均有统计学意义(P<0.05),两个亚组患者行放疗后放疗性肠炎的发生率通过数据可以发现观察组少于对照组患者。即Miles术后行盆底腹膜缝合患者近期或远期并发症均少于未行盆地腹膜缝合患者。
3 讨论
近年来,随着微创技术的不断发展与完善,更多直肠癌患者选择腹腔镜下直肠癌根治术,以便降低对术后手术对机体的创伤[10],然而,术后并发症是影响手术效果和预后质量的一项难题,目前,临床对于直肠癌Miles术后是否关闭腹膜仍存在争议,因此对于术后并发症的研究并采取有效的预防性措施十分必要。
鉴于以上情况,此次研究设计了盆腔腹膜缝合在腹腔镜直肠癌Miles术中的应用,采用全直肠系膜切除术(TEM) ,由于腹部手术中长时间的暴露、广泛的粘连分离、术中腹腔内的积血或积液、术后腹腔内炎症等原因可导致肠壁水肿和渗出的患者可形成的一种机械性与动力性同时存在的粘连性肠梗阻[11];通过对残余腹膜再次缝补链接封闭腹腔防止小肠、结肠下坠和渗液或积血因重力作用流至盆底引起肠管粘连,此外,由于全直肠系膜切除术是通过沿着脏层与壁层筋膜间准确进行锐性分离,创面光滑平整,不损伤直肠系膜和淋巴管道,有助于保护骨盆神经丛[12],等多种因素的影响下,可患者加快患者短期内恢复,较少因术后炎性渗出使会阴切口感染几率、内疝及粘连性肠梗阻等并发症的几率也同时降低,虽然腹腔镜低位直肠癌的治疗具有显著优势,腹腔镜直肠癌切除术较开腹手术手术视野好,但对于部分患者行全直肠系膜切除术(TEM)后导致再行腹膜缝合时增加延长了手术时间增加了手术风险,术者在入路初期就要做好关闭腹腔行盆底腹膜缝合的准备,在保证标准TME手术同时直肠两侧腹膜尽量多地保留,减少盆底腹膜缝合关闭后的张力,同时也可减少缝合不完整形成裂孔进而形成内疝,即在行腹膜缝合时需避免手术误伤,加强手术操作技巧,术前做好肠道准备等,对于部分低位直肠癌患者术后仍需行放射治疗,盆腔照射靶区的射线量为一般为45~50Gy[13],在既往的文献报到中,Zhu 等[14]研究发现, 放疗会引起肠壁血管损伤、缺血和纤维化,容易造成放射性肠炎,通过对行放疗后亚组患者在行放疗过程中通过缝合腹膜使得小肠无法坠入盆腔,可显著减少了放疗性肠炎的发生。本研究结果显示,通过对实验组患者长期随访可发现肠梗阻等术后并发症发生率明显低于对照组(p<0.05),观察组患者术后下床时间、创口愈合时间、肠蠕动恢复时间、住院时间均明显短于对照组(p<0.05),观察组患者术后复发率均明显低于对照组(p<0.05)。2个行放射治疗的亚组结果表明观察组患者术后放疗性肠炎发生率明显少于对照组(p<0.05)。此术式在提高患者术后生存质量的同时,并不影响生存率及肿瘤复发率,可保证最佳生活质量。虽然Miles术后并发症的发生是多因素导致的,由于本院医疗条件受限缺少大量样本分析,本文研究结果只单因素分析了盆腔腹膜的缝合对并发症的影响,但临床也应给予足够的重视,有待更多的经验总结,总之,通过对腹膜的缝合后的应用能明显改善患者术后并发症的发生,使患者恢复加快,该术式操作简单易行,值得推广。
参考文献
[1] 汪建平.低位直肠癌保肛手术的再认识[J].中国普外基础与临床杂志,2012,19(6):577-582.
[2] 郑荣寿,张思维,吴良有,等.中国肿瘤登记地区2008年恶性肿瘤发病和死亡分析[J].中国肿瘤,2012,21(1):1-12.
[3]刘云庚,张 磊,黄箕然,等. 腹腔镜下直肠前切除术中
保留左结肠动脉对促进患者术后的康复作用〔J〕. 南方医科大学学报,2017,37( 9) : 1261-1264.
[4] 李世拥.实用结直肠癌外科学[M].北京:人民卫生出版社,2012.
[5] 黄志强. 腹部外科手术学. 湖南科学技术出版社, 2002, 504-507.
[6] 张东铭.大肠肛门局部解剖与手术学. 安徽科学技术出版社, 1998, 344-350.
[7] Stewart RM, Page CP, Brender J, et al. The incidence and risk of early postoperative small bowl obstruction. Am J Surg, 1987, 154: 643-647.
[8]段东明,王轶伟,张建志,等.直肠癌根治术盆底腹膜缺损的盲肠填充术[J].临床外科杂志,2004,12(10):649.
[9]高增书,尹长恒,宋德余,等. 直肠癌根治术中带蒂大网膜移植的价值[J].华人消化杂志,1998,6(10):875.
[10]Yoon WH,Kim HJ,Kim CH,et al. Oncologic impact of pathologic response on clinical outcome after preoperative chemoradiotherapy in locally advanced rectal cancer〔J〕.Ann Surg Treat Res,2015,88( 1) : 15-20.
[11]李幼生,黎介寿.再论术后早期炎性肠梗阻〔J〕.中国实用外科杂志,2006,26(1) :38-39.
[12] 程桂福,赵起辉.全 直 肠 系 膜 切 除 术 治 疗 老 年 中 低 位 直肠癌的临床效果探析[J].中国医药指南,2016,14(25):79.
[13]沈历宗,华一兵,吴文溪等.慢性放射性肠炎外科治疗探讨《 中国实用外科杂志 》 , 2004
[14]Zhu H, Bai B, Shan L, et al. Preoperative radiotherapy for patients with rectal cancer: A risk factor for non-reversal of ileostomy caused by stenosis or stiffness proximal to colorectal anastomosis[J] .Oncotarget, 2017, 8( 59) : 100746-100753.
通訊作者:毛献双,男,副主任医师,邮箱:503522778@qq.com
课题来源:贺州市科学研究与技术开发项目(项目编号:贺科攻1407021)

