低压低氧环境对脊髓损伤大鼠呼吸及运动功能的影响
高坡,江海龙,靳磊,王琦*
1安徽医科大学空军临床学院急诊科,北京 100142;2空军特色医学中心急诊科,北京 100142
脊髓损伤(spinal cord injure,SCI)可分为原发性损伤和继发性损伤,前者由机械性外力引起,后者由炎症、缺氧、局部缺血、脱髓鞘等引起,可进一步造成神经细胞死亡,从而引发感觉及运动功能障碍、神经源性膀胱及肠道功能障碍、性功能障碍等后遗症,严重限制患者的社交活动并降低其生活质量。有调查显示,和平时期SCI发病率为(15~39)/100万,其中颈部损伤约占60%[1]。SCI的具体治疗方式及时机尚存在争议,现有证据建议进展性损伤应尽早行手术治疗,可将伤员通过航空医疗救援迅速转运至具备手术条件的高级医疗场所。航空转运中,低气压、震动、加速度、噪音等环境均会对患者造成一定的影响,但最终会造成何种影响目前尚无明确结论。长距离飞行所使用的固定翼飞机舱内压力一般维持在海拔2000~3000 m水平,较海平面低约30%,飞行时间多在1~3 h[2]。本研究探索航空转运中低压低氧环境对C5脊髓损伤大鼠呼吸及运动功能的影响。
1 材料与方法
1.1 主要仪器 DWDYC2013-Ⅰ型动物低压舱(空军航空医学研究所);ABL90FLEX血气分析仪[雷度米特医疗设备(上海)有限公司];ADVIA2120i血细胞分析仪[西门子(中国)有限公司];LeicaDM3000显微镜及成像系统[徕卡显微系统(上海)贸易有限公司];HE染色制片系统[赛默飞世尔科技(中国)有限公司]。
1.2 实验动物及分组 SPF级雄性SD大鼠20只,体重200~220 g,由北京华阜康生物科技股份有限公司提供[动物许可证号:SCXK(京)2019-0008]。适应性喂养1周后,采用随机数字表法分为假手术组(n=4)、脊髓损伤组(n=8)与脊髓损伤+低压组(n=8)。实验动物的相关方案通过实验动物伦理委员会批准。
1.3 第五颈髓损伤大鼠模型制备 采用3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠,使用有齿镊钳夹大鼠后颈部皮肤观察是否存在应激性反应以评估麻醉效果,如麻醉效果不满意,以10%为梯度逐步追加麻醉剂量。
将大鼠俯卧位固定于动物恒温手术台,触摸定位第二颈椎(C2)及第一胸椎(T1)棘突,用左手大拇指与无名指在大鼠枕骨后方固定头颅,食指与中指在中线两侧固定颈部皮肤,使用手术刀于C2-T1之间沿中线做纵行切口,切开后颈部皮肤。食指向下触摸颈椎棘突,在棘突正上方使用手术刀划开筋膜等皮下软组织,暴露颈后的肌肉,将衬垫置于大鼠T1前下方,使颈椎后曲。使用血管钳于颈椎棘突正上方向下钝性分离软组织至椎骨。使用弯头血管钳固定T1棘突,向上提拉保证颈椎后屈,使用手术刀由棘突两侧向外刮除椎板上附着的软组织,以暴露椎板及椎间韧带,由T1棘突处向上计数定位C5。
提拉T1棘突,保证颈椎极度后曲,增加椎管骨缝宽度,使用拉钩向两侧打开固定手术视野,使用手术刀刀尖离断骨缝间软组织,使用血管钳钳除椎板即可显露脊髓。采用接触面积为2.5 mm2的金属棒迅速压迫脊髓,持续1 s。大鼠出现四肢抽动、摆尾即造模成功。逐层缝合切口并再次消毒,置于保温垫上复温。
1.4 颈动脉插管 麻醉后沿气管右侧剪开皮肤,钝性分离肌肉,暴露右侧颈动脉并分离血管。使用弯头无齿眼科镊将颈动脉悬空抬起,采用7-0丝线结扎血管远心端,使用活结结扎近心端,在远心端用微型剪在血管上剪V形口,使用眼科镊将PE管向心方向插入颈动脉2~2.5 cm,打开近心端活结,结扎固定颈动脉及PE管链接处,用镊子将PE管引导至颈背部并缝合创口。
1.5 低压处理 造模后24 h将脊髓损伤+低压组大鼠置入低压舱,低压舱内压力以10 m/s速度降至预定的海拔2500 m水平,持续4 h。完成后舱内压力以10 m/s速度升至常压水平完成低压处理。
1.6 观察指标
1.6.1 动脉血气指标检测 将大鼠转出低压舱置于恒温手术台,使用注射器经颈动脉插管抽取1ml动脉血进行动脉血气分析,包括pH、氧分压(partial pressure of oxygen,PaO2)、氧饱和度(oxygen saturation,SaO2)、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)、乳酸(lactic acid,Lac)、葡萄糖(blood glucose,Glu)、碱剩余(base excess,BE)、缓冲碱(buffer base,BB)等指标。
1.6.2 Basso-Beattie-Bresnahan(BBB)评分评估大鼠后肢运动功能 采集动脉血后将脊髓损伤组、脊髓损伤+低压组大鼠顺序打乱,由3人在相互隔离环境下分别进行BBB评分,取平均值。
1.6.3 血细胞计数 再次经腹腔麻醉后,使用手术剪打开腹腔,暴露下腔静脉,使用注射器经下腔静脉采集静脉血进行血细胞计数,包括白细胞计数(WBC)、中性粒细胞百分比(NEUT%)、淋巴细胞百分比(LYMPH%)、单核细胞百分比(MONO%)、红细胞计数(RBC)、血红蛋白(HGB)、血细胞比容(HCT)、网织红细胞计数(Ret)及网织红细胞百分比(Ret%)等指标。
1.7 肺组织及脊髓损伤区组织病理学检测 采集右肺下叶及C5对应的脊髓节段,常规方法组织脱水、透明、浸蜡、包埋、切片,厚度3 μm。切片脱蜡至水,行HE染色,显微镜下观察出血、间质水肿及炎性细胞浸润情况。
1.8 统计学处理 采用SPSS 24.0软件进行统计分析。所有数据以±s表示,动脉血气及血细胞计数指标多组间比较采用单因素方差分析,方差齐时组间两两比较采用LSD-t检验,方差不齐时组间两两比较采用独立样本Kruskal-Wallis法进行非参数检验。BBB评分组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组动脉血气指标比较 3 组大鼠p H、PaO2、PaCO2、SaO2、Glu、Lac、BE、BB等动脉 血气指标比较,差异均无统计学意义(P>0.05, 表1)。
2.2 各组血细胞计数结果比较 脊髓损伤组大鼠Ret%低于假手术组(P=0.034);脊髓损伤+低压组与假手术组、脊髓损伤组大鼠Ret%比较,差异均无统计学意义(P=0.178,P=0.282)。3组大鼠WBC、NEUT%、LYMPH%、MONO%、RBC、HGB、HCT、Ret等指标比较差异均无统计学意义(P>0.05,表2)。
表1 各组实验大鼠动脉血气指标比较(±s)Tab.1 Comparison of the arterial blood gas indexes in each group (±s)
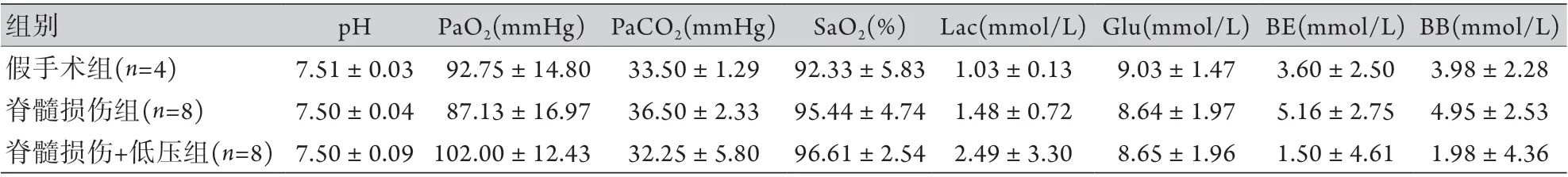
表1 各组实验大鼠动脉血气指标比较(±s)Tab.1 Comparison of the arterial blood gas indexes in each group (±s)
PaO2. 氧分压;PaCO2. 二氧化碳分压;SaO2. 氧饱和度;Lac. 乳酸;Glu. 葡萄糖;BE. 碱剩余;BB. 缓冲碱
组别 pH PaO2(mmHg) PaCO2(mmHg) SaO2(%) Lac(mmol/L) Glu(mmol/L) BE(mmol/L) BB(mmol/L)假手术组(n=4) 7.51±0.03 92.75±14.80 33.50±1.29 92.33±5.83 1.03±0.13 9.03±1.47 3.60±2.50 3.98±2.28脊髓损伤组(n=8) 7.50±0.04 87.13±16.97 36.50±2.33 95.44±4.74 1.48±0.72 8.64±1.97 5.16±2.75 4.95±2.53脊髓损伤+低压组(n=8) 7.50±0.09 102.00±12.43 32.25±5.80 96.61±2.54 2.49±3.30 8.65±1.96 1.50±4.61 1.98±4.36
表2 各组实验大鼠血细胞计数比较(±s)Tab.2 Comparison of blood routine data in each group (±s)

表2 各组实验大鼠血细胞计数比较(±s)Tab.2 Comparison of blood routine data in each group (±s)
WBC. 白细胞计数;NEUT%. 中性粒细胞百分比;LYMPH%. 淋巴细胞百分比;MONO%. 单核细胞百分比;RBC. 红细胞计数;HGB.血红蛋白;HCT. 红细胞压积;Ret. 网织红细胞计数;Ret%. 网织红细胞百分比;与假手术组比较,(1)P=0.034。
组别 WBC(×103/μl) NEUT% LYMPH% MONO% RBC(×106/μl)HGB(g/dl)HCT(%)Ret(×103/μl) Ret%(%)假手术组(n=4) 6.85±1.38 51.15±11.63 44.23±11.39 3.58±0.35 5.64±1.51 11.73±3.23 29.68±7.48 173.35±13.87 2.88±0.20脊髓损伤组(n=8) 7.85±1.57 54.81±11.04 38.20±9.79 4.93±3.42 6.42±0.92 12.38±1.69 34.38±6.50 133.25±51.88 2.05±0.69(1)脊髓损伤+低压组(n=8) 7.65±1.75 51.66±11.54 40.00±9.65 6.21±2.89 6.05±1.77 12.23±3.92 33.26±10.39 154.64±39.58 2.37±0.59
2.3 脊髓损伤组、脊髓损伤+低压组大鼠BBB评分比较 脊髓损伤组、脊髓损伤+低压组大鼠BBB评分比较(7.54±6.02 vs. 9.92±5.95),差异无统计学意义(t=-0.794,P=0.440)。
2.4 肺组织及脊髓损伤区组织病理学变化 HE染色结果显示,假手术组大鼠脊髓损伤区组织未见明显出血及渗出性改变,结构完整。脊髓损伤组、脊髓损伤+低压组大鼠脊髓损伤区均可见明显出血、渗出、水肿性改变,其组织结构完整性与假手术组比较发生明显改变,但两组间组织结构完整性未见明显差异(图1)。各组大鼠肺泡内均未见明显出血、渗出、水肿性改变,肺泡结构完整,无肺泡塌陷,间质亦未见明显水肿及炎性浸润(图1)。
3 讨 论
航空转运具有不受道路交通条件限制、转运速度快等优势[3-5]。目前美国及德国航空转运体系的建设以转运流程、装备、护理及流行病学等方面为主,处于各国前列。关于航空转运过程中特殊环境对患者病理生理的影响目前仅见少量报道,各国对于航空转运建立的指南、规范等均是以地面环境为基础,通过理论推测及转运经验制定的。
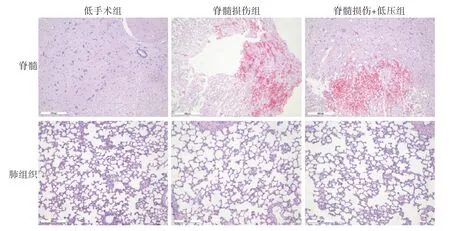
图1 各组实验大鼠脊髓损伤区组织和肺组织病理学变化(HE ×40)Fig.1 Pathological changes of spinal cord injury area and lung tissues of each group of rats (HE ×40)
呼吸主要包括肺通气、肺换气和氧输送3个部分。在部分无心肺基础疾病的患者中,由颅脑及中枢神经系统损伤引起的肺水肿称为神经源性肺水肿(neurogenic pulmonary edema,NPE)。目前NPE的发病机制尚不明确,存在血流动力学理论、肺血管通透性增加理论、冲击伤理论等多种解释。NPE的发病机制虽未明确,但其最终表现形式为肺水肿。本研究HE染色结果显示,3组大鼠肺组织均未见明显出血、间质渗出及水肿性改变,血细胞计数亦未见明显变化,动脉血气未见呼吸衰竭表现,表明实验动物未发生NPE,即4 h的低压低氧环境并未引起C5脊髓损伤大鼠的肺换气障碍。
肺通气主要受气道情况及膈肌运动的影响[6]。 人类最重要的呼吸肌膈肌的支配神经膈神经由C3-C5组成,其中C4是主要成分。C1-C2损伤的伤病员往往在现场即已死亡;由于C3-C4损伤可影响膈神经中枢,C3-C4损伤的伤病员也常于早期因呼吸衰竭而死亡。本课题组前期预实验中C1-C3损伤大鼠基本上在造模后0.5 h内即死亡,C4损伤大鼠4 h内死亡率约为50%,C5损伤大鼠在同一批次实验中死亡均为1~2只,因此本研究选择C5作为实验节段。创伤性脊髓损伤最常发生于颈椎(60%)[1],提示一旦发生脊髓损伤,多数患者会出现呼吸功能异常,一方面膈肌功能受损,深呼吸及排痰功能异常,引起通气功能障碍;另一方面损伤节段以下出现感觉及运动障碍,心理压力增大,引起机体耗氧量增加。肺通气的动力来源于大气压与肺内压的差值,阻力主要包括弹性阻力和非弹性阻力,其中弹性阻力来自于肺本身,约占肺通气阻力的2/3,非弹性阻力主要来自于气道阻力,气道阻力与大气压和肺内压的差值成正比。SCI后神经功能受损主要影响膈肌运动,导致大气压与肺内压的差值减小,但占据肺通气阻力主要部分的弹性阻力并未改变,因此肺通气受限。本研究中虽然脊髓损伤组大鼠PaCO2较假手术组有所升高,但差异无统计学意义,提示C5损伤虽然对呼吸功能有所影响,但因其并非膈神经的主要成分,并未对肺通气功能造成明显影响。
航空环境中的低氧主要是由于大气压降低而导致氧分压下降。民航密封舱内压力通常维持在海拔2000~3000 m水平,在该高度下大气压在69~78 kPa,相应的氧分压亦降至海平面的70%左右,因此既往多认为飞机舱内低压环境会导致动脉氧分压下降[7]。本研究中脊髓损伤+低压组大鼠血气结果并未进一步恶化,氧分压反而有所上升,结合PaCO2结果,分析原因为膈神经主要是由C4组成,C5损伤尚未对呼吸中枢至膈肌的调控能力造成不可逆的损伤,航空环境中的低氧并未达到引起脊髓损伤+低压组大鼠血气结果明显恶化的程度,即4 h的低压低氧环境并未对C5脊髓损伤大鼠的肺通气功能造成影响。
目前对于低氧导致肾脏促红细胞生成素(EPO)增加进而加速红细胞生成这一过程的具体机制尚未完全明确[8]。目前研究表明,在2000 m海拔水平暴露时间以“周”为单位时,可引起明显的血液学改变[9]。虽然航空转运过程中舱内压力维持在2500 m左右水平,但转运时间通常为4~6 h,即使跨洲转运,转运时间亦不会超过一周,因此并不会对红细胞及血红蛋白造成明显影响,本研究中虽然假手术组、脊髓损伤组Ret%差异有统计学意义,但在实际临床中并无太大实际意义,因此氧输送过程并无明显变化。
尚咏等[10]发现,航空运送过程中的低压低氧环境不会导致脊髓损伤大鼠运动功能及脊髓损伤情况发生变化,与本研究结果一致,表明大鼠模型病理变化过程受操作、麻醉等因素影响较小。但其大鼠的氧分压及PaCO2结果与本研究结果差别较大,本研究造模与低压处理之间相隔24 h,并且通过颈动脉插管抽取动脉血,基本可排除麻醉、手术等操作对实验动物的影响,而尚咏等[10]的研究是在造模同一天进行低压处理,并在麻醉后抽取动脉血,结果相差较大可能与此有关。
假手术组大鼠未进行脊髓损伤手术,因此仅脊髓损伤组、脊髓损伤+低压组大鼠在动脉血气分析后进行BBB评分,结果显示两组BBB评分差异不明显。BBB评分主要评估大鼠的运动功能,而运动功能的变化通常需要数周或数月的时间。因此,即使4 h的低压过程会影响受伤部位的炎症反应,28 h仍不足以使两组大鼠的运动功能产生明显的变化。由此可见,短期航空运输不会进一步加重脊髓损伤,但是否会影响脊髓损伤患者的后期康复尚需进一步研究。而更长的转运时间或不同的转运等待时间、其他脊髓节段或多节段损伤情况如何尚需进一步动物实验及临床病例来验证。
本研究未能对呼吸频率、潮气量、每分钟通气量、第一秒用力呼气容积等呼吸参数进行检测。呼吸参数及动脉血气分析均须在大鼠离开低压舱后的数分钟内进行,否则无意义。动脉血气分析可比呼吸参数更好地反映大鼠的呼吸功能,因此本研究选择动脉血气分析。脊髓损伤组和脊髓损伤+低压组大鼠BBB评分之间的个体差异较大,分析原因为:①本研究使用压迫法造模。用于压迫的金属棒的接触表面相同,但各大鼠脊髓直径存在差异,且金属棒的直径小于脊髓的直径,无法精确地保证压迫的确切位置。在预试验中,重物坠落(WD)法同样存在不同大鼠BBB评分个体差异较大的问题,而压迫法可以确保建模时间的一致性。②BBB评分包括22个等级,以后肢运动功能评估脊髓损伤后的恢复情况。在进行评分时,必须同时观察前肢作为比较以评估后肢的运动情况。因此,主要评价对象为胸腰椎脊髓损伤的动物。本研究中大鼠脊髓损伤段为C5,会影响前肢的运动,因此,当用前肢作为对照时,会不可避免地影响评分的准确性。
综上所述,既往认为航空转运中的低压低氧环境会影响SCI患者的呼吸功能,但本研究结果提示,至少4 h的低压低氧环境并不会对C5脊髓损伤大鼠的呼吸及运动功能造成明显影响。

