CD4+CD25+调节性T细胞在AIHA患者外周血中的表达及临床意义
肖 捷 杨丽萍 肖 健 黄继贤▲
1. 汕头大学医学院附属粤北人民医院体检中心,广东韶关 512025;2. 汕头大学医学院附属粤北人民医院血液内科,广东韶关 512025;3. 汕头大学医学院附属粤北人民医院药学部,广东韶关 512025
自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)是一种人体B 淋巴细胞免疫调节紊乱,产生针对红细胞进行破坏的自身抗体,继而导致红细胞寿命缩短和破坏加速为特征的获得性免疫障碍贫血[1]。AIHA 的发病率约为3/10 万,是一种少见病,近95% 成人和75% 的儿童患者为温抗体型AIHA[2]。AIHA 好发于中老年,女性较男性常见。体液免疫在AIHA 发病机制中的作用已被认识多年。近年来,细胞免疫在AIHA 发病机制中的重要作用逐渐引起重视。调节性T 细胞诱导和维持外周免疫耐受,对预防过度的免疫反应和自身免疫中起至关重要的作用[3]。我们的前期研究[4]通过流式细胞仪检测AIHA 初治患者和正常人的外周血CD4+CD25+调节性 T 细胞(CD4+CD25+regulatory T cell,Tregs)后发现,初治患者的Tregs 较正常人下降,提示Tregs 与AIHA 的细胞免疫异常机制有关。因此,我们延长了研究时间,检测了完全缓解和复发AIHA 患者外周血Tregs 的变化情况,以期进一步确定Tregs 与AIHA 细胞免疫紊乱的可能关系。现报道如下。
1 资料与方法
1.1 一般资料
选择2009 年1 月~2019 年11 月就诊于汕头大学医学院附属粤北人民医院的AIHA 患者,均为温抗体型AIHA。健康对照组来自同期我院体检中心的正常人。
1.2 方法
1.2.1 诊断标准 纳入的患者均至少完成血细胞分析、网织红细胞计数、胆红素、直接和间接抗人球蛋白试验、骨髓象、肝、胆、脾、胰B 超等检查,AIHA的诊断标准以及疗效判定标准均符合《血液病诊断及疗效标准(第三版)》[5]。AIHA 复发的定义为AIHA 发病治疗后达到完全缓解,其后疾病再次发作并达到诊断标准。
1.2.2 纳入及排除标准 纳入标准:符合《血液病诊断及疗效标准(第三版)》[5]的AIHA 诊断标准。排除标准:(1)合并有严重心、肝、肾脏等重要器官功能不全者;(2)预期生存期短于半年者;(3)不能或拒绝配合随访的患者。
1.2.3 Tregs 检测 AIHA 患者分别于初治时、治疗后达完全缓解时、复发时采集外周血标本,以 CD45、CD4 和 CD25 抗 体(均 是 BECKMAN COULTER 公司产品)荧光标记活细胞及避光孵育,经溶血素处理后再次避光孵育,磷酸盐缓冲液洗涤后重新悬浮细胞,通过流式细胞仪(BD 公司的FACSCalibur 型)检测 CD4+T 细胞和 Tregs,具体方法参考我们的前期研究[4]。
1.3 统计学处理
本研究使用SPSS 20.0 软件进行,计量资料以(x± s)表示,各组间的比较采用单因素方差分析,P <0.05 为差异有统计学意义。柱状图使用GraphPad Prism 7.0 软件绘制。
2 结果
2.1 一般资料
共收集到符合条件的AIHA 患者28 例,其中男 8 例,女 20 例,中位发病年龄 47 岁(14 ~ 77)岁。患者起病时的血红蛋白中位数为54(23 ~102)g/L,总胆红素中位数为42.20(7.40 ~165.64)μmol/L,间接胆红素中位数为33.65(6.60 ~123.50)μmol/L,直接胆红素中位数为10.65(0.80 ~53.23)μmol/L。健康对照组为同期的健康体检者,均无自身免疫性疾病及肿瘤病史,且年龄和性别与AIHA 患者相匹配,男 8 例,女 20 例,中位发病年龄 47(14 ~ 77)岁。
2.2 CD4+T细胞的分析
初治组和复发组AIHA 的CD4+T 细胞比例均较健康对照组低,差异有统计学意义(P <0.05),见表1,图1A。而初治组AIHA 和复发组AIHA 的CD4+T 细胞比例虽均较完全缓解组低,差异无统计学意义(P > 0.05)。
另外,初治组AIHA 的CD4+T 细胞比例和复发组比较差异无统计学意义(P >0.05);完全缓解组AIHA 的CD4+T 细胞比例和健康对照组比较差异无统计学意义(P >0.05)
2.3 Tregs的分析
初治组和复发组AIHA 的Tregs 比例较健康对照组和完全缓解组均低,差异有统计学意义(P < 0.05)。见表 1,图 1B。
另外,初治组AIHA 的Tregs 比例和复发组比较,差异无统计学意义(P >0.05);完全缓解组AIHA 的Tregs 比例和健康对照组比较,差异无统计学意义(P > 0.05)。

表1 各组外周血CD4+T细胞和CD4+CD25+调节性T细胞的比较(x ± s,%)
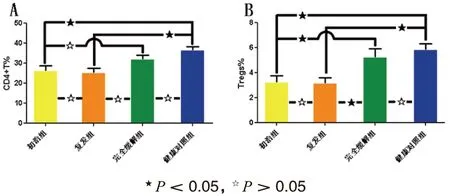
图1 (A)AIHA 初治组、复发组、完全缓解组和健康对照组外周血CD4+T 细胞的比较;(B)AIHA 初治组、复发组、完全缓解组和健康对照组外周血Tregs 的比较
3 讨论
调节性T 细胞是T 细胞的一个亚群,具有调节免疫、免疫抑制和维持自身耐受的功能,能够通过产生白介素-10、转化生长因子等细胞因子抑制机体T 细胞的活化、增殖和发挥效应。调节性T 细胞按起源分为天然型调节性T 细胞(naturual regulatory T cell,nTreg)和诱导型调节性 T 细胞(induced regulatory T cell,iTreg)。CD4+CD25+既是nTreg 免疫表型,也是iTreg 的免疫表型,且nTreg和iTreg 具有类似的免疫抑制功能[6],但两者的作用有所差别。nTreg 在胸腺中分化、发育和成熟,在增强对自身抗原的耐受性方面起关键作用;而在外周免疫器官中诱导发育成熟的iTreg,分布于外周淋巴组织,与nTreg 不同,偏向于识别非自身抗原[7]。调节性T 细胞被认为通过各种可溶性细胞因子(包括IL-10,IL-35 和TGF-β)以及细胞表面分子(如CD25 和CTLA-4)(快速循环至/ 从细胞中回收)维持外周对自身抗原的耐受性方面至关重要[8]。
调节性T 细胞的细胞比例异常与1 型糖尿病、类风湿性关节炎、系统性红斑狼疮(SLE)、多发性硬化、重症肌无力等自身免疫病的发病机制可能有关。Ghonaim 等[9]对64 例1 型糖尿病患儿进行流式细胞术检测外周血Tregs 后发现,1 型糖尿病患儿Tregs 减少,可能与1 型糖尿病的发病机制有关。Zhang 等[10]对37 例活动期和18 例慢性期的类风湿性关节炎患者及20 例正常人进行Tregs 等指标检测后发现,类风湿性关节炎患者的Tregs 比例显著低于健康对照组,而活动期组和慢性期组间则无明显差异。Morita 等[11]对类风湿性关节炎与Treg相关的31 项研究进行Meta 分析后发现,Tregs 在类风湿性关节炎患者外周血的表达降低,而在滑液的表达却升高。Li W 等[12]对总共纳入628 例活动期SLE 患者和601 例正常人的18 项研究进行Meta 分析后发现,活动期的SLE 患者的调节性T 细胞抑制能力未见异常,但活动期调节性T 细胞百分比较缓解时明显下降,因而考虑,调节性T 细胞的减少可能在活动期SLE 的发病机理中起作用。Danikowski的研究表明[8],虽然目前尚未完全阐明自我耐受能力受损在多发性硬化和重症肌无力的潜在机制,但调节性T 细胞的数量、功能和(或)迁徙缺陷是可能的细胞免疫致病机制之一。
调节性T 细胞与AIHA 患者的细胞免疫紊乱可能有关。Mqadmi A 等[13]给对照组小鼠反复输入少量异体红细胞后AIHA 的发生率为30%;而发病组以CD25 单抗清除小鼠体内的Tregs 后再反复输入少量异体红细胞,制成缺乏CD25 表达的AIHA模型,发现AIHA 的发生率上升至90%。此时如果输注Tregs 给这些发病的小鼠,可减少红细胞的自身抗体生成,继而减轻溶血的发作;但不输注Tregs而改为注输注CD4+CD25-调节性T 细胞,却不能减轻溶血发作。从而证明了Tregs 与小鼠的AIHA 的发病机制中的细胞免疫紊乱有关。我们的前期研究[4]通过流式细胞仪检测外周血标本分析AIHA患者和正常人的Tregs,发现AIHA 初治者的Tregs较正常人下降。孙丽霞等[14]也通过流式细胞仪对AIHA 初治者、缓解的AIHA 患者和正常人的外周血标本进行Tregs 检测,得出了与我们前期研究相同的结论(初治AIHA 患者的Tregs 较正常人下降),并发现缓解AIHA 患者Tregs 较发病时显著上升。本研究再次验证了我们前期研究及孙丽霞等[14]的结论,且进一步发现复发的AIHA 患者的外周血Tregs 也较正常人下降,与初治患者无统计学差异,从而进一步证明了外周血Tregs 与AIHA 的细胞免疫紊乱机制可能有关。
本研究还发现,AIHA 初治组和复发组CD4+T细胞比例均较健康对照组低。国内有学者发现特发性血小板减少性紫癜的患者,发病时检测外周血CD4+T 细胞比例也减少[15]。本研究结果提示CD4+T细胞可能也与AIHA 的发病有关,其细胞比例的异常是否与Tregs 导致CD4+T 细胞的活化和增殖受限有关,值得进一步探讨。
综上所述,Tregs 在维持外周对自身抗原的耐受性方面至关重要,与自身免疫性疾病的发病机制有关。本研究发现,AIHA 初发病和复发患者的外周血Tregs 均较完全缓解和正常人下降,治疗达完全缓解时明显上升,与正常人无明显差异,进一步提示Tregs 与AIHA 患者发病的细胞免疫紊乱机制可能有关。

