CSF-1自背根节向脊髓转运对长春新碱诱导神经病理性痛大鼠小胶质细胞活化及其炎症的影响
付宝军,姜静静,黄玉琼,林宗航,李 恒
(1.广州医科大学附属第六医院//清远市人民医院麻醉科,广东清远 511518)
长春新碱是一种常用化疗药物,被用于治疗各种癌症,特别是急性淋巴细胞白血病、霍奇金淋巴瘤和非霍奇金淋巴瘤,但它常常诱导产生神经病理性疼痛(chemotherapy-induced neuropathic pain,CINP)副作用,并呈剂量限制性[1]。目前用于化疗引起的神经性疼痛的治疗药物仅限于抗惊厥药、阿片类药物和三环抗抑郁药[2-3],但这些药物往往因其本身不可接受的副作用而限制临床应用。因此阐明CINP 发生机制,对于探索药物作用靶点、开发有效的治疗药物具有重大现实意义。集落刺激因子-1(colony stimulating factor-1,CSF-1)是一种巨噬细胞谱系特异性生长因子,在多种病理生理中发挥着作用,最近其在神经病理性疼痛中作用倍受关注[4-6]近期研究证实[7],Cre 介导的感觉神经元内CSF1 敲除可完全阻止神经损伤诱导的机械痛敏反应,减少小胶质细胞的活化和增殖。相反,鞘内注射CSF-1 可诱导机械痛敏和小胶质细胞增生。另外,CSF-1介导关节炎症促进关节炎导致痛觉过敏,以及阻断CSF-1 治疗将有效预防和治疗关节炎导致痛觉过敏[8-9],提示CSF-1 在慢性疼痛信息调制中发挥重要重作用,但是其在化疗药物诱导神经病理性疼痛中作用以及作用下游靶点未见报道。本研究拟观察长春新碱(vincristine)诱导神经病理性疼痛大鼠背根节和脊髓CSF-1 的表达变化,并通过预先鞘内注射特异性CSF-1 中和抗体,观察其对长春新碱导致的痛觉过敏大鼠脊髓小胶质细胞激活的影响和行为学的改变,探讨CSF-1在长春新碱诱导神经病理性疼痛中的作用及其可能机制,为CINP 的发生机制提供了新的理论基础,同时也为CINP 的防治提供了新的科学依据。
1 材料与方法
1.1 实验动物与分组
清洁级雄性Sprague Dawley(SD)大鼠,体质量200~230 g,10~12 周龄,由清远市人民医院实验动物中心提供[动物生产许可证号:SYXK(粤)2019-0206]。于12 h 光照-黑暗循环、安静环境下单笼饲养,自由饮水摄食。室温(22.0±0.5)℃,湿度(55±10)%。所有实验操作均符合广州医科大学附属第六医院动物实验中心动物伦理要求并按照实验动物使用原则进行。鞘内置管成功SD 大鼠54 只,适应饲养1 周后按随机数字表法分3 组(n=18):对照组(Control 组);化疗痛组(CINP 组);化疗痛+CSF-1 中和抗体组(CINP+anti 组)。CSF-1 中和抗体(10 μg 体积为10 μL)(CINP+anti组)或正常IgG(10 μg 体积为10 μL)(CINP 组和Control 组)从第1 天开始连续7 d 于行为学测试前30 min 鞘内给药,每次给药后用10 μL 生理盐水冲洗PE 管;Control 组为正常对照组,于鞘内给药后30 min 腹腔注射等体积生理盐水,CINP 组、CINP+anti 组于鞘内给药后30 min 腹腔注射长春新碱。
1.2 鞘内置管
参照Yaksh 等[10]报道方法鞘内置管,大鼠置管成功后观察其肢体运动情况,如有运动功能障碍大鼠将被剔除后续实验。根据经导管注射利多卡因后30 s 内出现双后肢麻痹现象确认导管位置正确,置管5 d 后即可用于实验。
1.3 化疗痛动物模型建立
大鼠进行隔日腹腔注射长春新碱(浙江海正药业股份有限公司,中国),每次注射量为125 μg/kg(共计4 次),注射当天视为1 d,通过检测痛阈值变化确定化疗药物诱导的神经病理性疼痛模型建立成功。
1.4 行为学测定
参照Chaplan 等[11]报道的方法测定机械缩足反射阈值(mechanical withdrawal threshold,MWT),以up-down 法推测阈值,并在阈值上下各刺激大鼠后肢足底中部5 次,中位数法计算50%的反应阈值;参照Hargreaves 等[12]报道的方法测定热缩足反射潜伏期(thermal withdrawal latency,TWL)自动切断时间为20 s,以防止组织损伤。大鼠后肢足底中部热刺激强度在整个实验过程中维持一致。每只动物测定5 次(间隔3 min),取其平均值为大鼠TWL值。在给药前、给药后第1、3、5、7天分别采用MWT 和TWL 评价大鼠机械痛敏和热痛敏。
1.5 Western blot 实验
第7 天,每组各取3 只大鼠麻醉后断头处死,冰上取出L4-5 脊髓节段及背根节,加入裂解液进行匀浆,4℃下12 000 r/min(r=5 cm)离心5 min,并进行BCA 蛋白定量后每份样品使用20 μg 蛋白质。配置分离胶和浓缩胶,当溴酚蓝染料前端电泳至分离胶末端处时即停止电泳,转膜后封闭2 h,加入抗β-actin 兔多克隆抗体(1∶2 000,Abcam,美国),抗CSF-1 兔多克隆抗体(1∶1 000,Abcam,美国),抗Iba1(ionized calcium binding adapter molecule 1,Iba1)兔多克隆抗体(1∶1 000,Abcam,美国),4 ℃孵育过夜后洗膜3 次(每次10 min)。加入HRP标记的山羊抗兔IgG(1∶3 000,Abcam,美国)室温孵育后洗膜、显色、曝光、显影,采用Image J 软件检测目的蛋白条带及β-actin蛋白条带的灰度值,目的蛋白条带灰度值/β-ac⁃tin 蛋白条带灰度值比值作为目标蛋白表达量。
1.6 RT-qPCR 检测
第7 天,每组各取3 只大鼠安乐死后进行检查。TRIzol®reagent(Invitrogen,美国)提取大鼠L4~6 脊髓及背根节总RNA,反转录为cDNA。用2-ΔΔCT法来测定Csf-1mRNA、Iba1mRNA 含量。引物合成(北京天跟生化科技有限公司,中国)为:Csf-1 上游引物:5′-TGCTAAGTGCTCTAGCCGAG-3′;下游引物5′-CCCCCAACAGTCAGCAAGAC-3′。上游引物:Iba1 上游引物:5′-CCATGACCTTCCAA⁃GAGAATGC-3′;下游引物:5′-ACCGGCTTGTGC⁃TGTAGTC。β-actin 上游引物:5′-CGTTGACATC⁃CGTAAAGACCTC-3′;下游引物:5′-TAGGAGC⁃CAGGGCAGTAATCT-3′。扩增条件:94℃预变性5 min,94℃30 s,54℃30 s,72℃20 s,共45 个循环,72℃延伸10 min。计算与内参照β-actin 的比值作为目的基因的相对表达量。
1.7 免疫组织荧光实验
第7 天,每组大鼠取3 只经腹腔注射1%戊巴比妥钠40 mg/kg 麻醉后,用40 g/L 多聚甲醛灌注固定,取大鼠腰4~5 背根节及脊髓,40 g/L 多聚甲醛后固定2 h,再先后于20%、30%蔗糖溶液中脱水,冰冻切片机切片,厚度14 μm。免疫荧光染色:磷酸盐缓冲盐水(phosphate buffered saline,PBS)(0.01 mol/L,pH 值7.4)洗片3 次,20 min/次;加5%羊血清室温封闭2 h;加入抗Iba1 及CSF-1 兔多克隆抗体一抗(1∶200,Cell Signaling Technology,美国),4 ℃过夜孵育;次日复温至室温后PBS 洗3 次,15 min/次;分别加入Cy3 标记的荧光二抗(1∶1 000,Cell Signaling Technology,美国),室温孵育2 h,PSB 洗3 次,20 min/次,晾干,封片剂封片;置荧光显微镜下拍照观察。
1.8 ELISA 检测
第7 天,L4~L5 脊髓节段匀浆后于4℃,3 500 r/min(r=5 cm)下离心10 min,提取上清液并在-80℃保存。按ELISA测定试剂盒说明书步骤进行操作。采用NK3酶标仪(GE公司,美国)于波长490 nm处测定光密度值,对应标准曲线得出TNF-α、IL-6、IL-1β的含量。
1.9 统计学方法
符合正态分布的计量资料以均数±标准差表示,采用graphpad 7.0 软件进行统计分析,行为学结果采用连续性重复测量方差分析,若组别和时间存在交互效应,进一步检验组间和时间点的单独效应,两两比较采用LSD-t法;Western blotting、RT-PCR、免疫荧光化学、ELISA 数据以单因素方差分析,两两比较采用Tukey′s 法;P<0.05 被认为有统计学差异。
2 结果
2.1 各组大鼠MWT 和TWL 变化情况
Control 组、CINP 组、CINP+anti 组大鼠的行为学结果进行重复测量方差分析显示:MWT 和TWL数据均满足球形分布(χ2=3.3,P=0.92;χ2=13.42,P=0.15),各组间差异有统计学意义(F=24.69,P< 0.001;F=21.25,P< 0.001),各组时间点差异有统计学意义(F=37.86,P<0.001;F=40.15,P<0.001),且分组和时间点有交互效应(F=27.11,P<0.001;F=28.61,P<0.001)。两两比较分析比较各组相同时间点MWT和TWL的差异,结果表明各组基础痛觉阈值无统计学差异(F=0.89,P=0.37),而腹腔注射长春新碱后第3、5、7 天,大鼠的MWT[3 d:(12.60±0.55)g;5 d:(9.30±0.84)g,7 d:(8.10±0.70)g,P<0.001vs.Control组]和TWL[3 d:(17.10 ± 0.55)s;5 d:(15.18 ± 0.60)s;7 d:(12.90 ±0.74)s,P<0.001vs.Control组]均显著降低,鞘内给予CSF1 中和抗体明显增加化疗痛大鼠第5、7 天MWT[5 d:(11.68 ± 1.10)g;7 d:(10.60 ± 0.55)g,P<0.001vs.CINP 组]和TWL[5 d:(17.18±0.60)s;7 d:(14.80±0.50)s,P<0.001vs.CINP组;图1]。

图1 各组大鼠MWT 和TWL 变化情况Fig.1 MWT and TWL for rats in different groups
2.2 各组大鼠背根节CSF-1 蛋白及mRNA 表达情况
长春新碱注射后第7 天,分别对Control 组、CINP 组、CINP+anti 组大鼠背根节CSF-1 蛋白及mRNA 进行单因素方差分析结果显示差异有统计学意义(蛋白:F=129.40,P< 0.001;mRNA:F=428.00,P< 0.001):两两比较结果显示CINP组大鼠背根节CSF-1 蛋白及mRNA 明显上调(CINP 组:蛋白ID=0.32±0.02,P<0.001vs.Control组;CINP 组:mRNAID=0.94 ± 0.06,P< 0.001vs.Control 组),说明长春新碱腹腔注射导致CSF-1表达增加。鞘内给予CSF1 中和抗体可以抑制长春新碱诱导CSF-1 蛋白及mRNA 表达上调(CINP+anti 组:蛋白ID=0.22±0.03,P< 0.01vs.CINP组;CINP+anti 组:mRNAID=2.02± 0.06,P=0.97vs.CINP 组,图2 A,B)。
2.3 各组大鼠背根节CSF-1 免疫荧光表达情况
长春新碱注射后7 天,分别对Control 组、CINP组、CINP+anti 组大鼠背根节CSF-1 荧光强度进行单因素方差分析结果显示差异有统计学意义(F=114.20,P< 0.001):两两比较结果显示CINP组大鼠背根节CSF-1荧光强度明显增强(CINP组:252.74±33.25,P<0.001vs.Control 组),说明长春新碱腹腔注射导致背根节CSF-1 表达增加。鞘内给予CSF-1中和抗体可以抑制长春新碱诱导CSF-1荧光强度增强(CINP+anti 组:141.93±12.21,P<0.01vs.CINP 组,图3 A~D)。

图2 各组大鼠背根节CSF-1 蛋白及mRNA 表达情况Fig.2 protein and mRNA expression of CSF-1 in DRG of rats in different groups
2.4 各组大鼠脊髓CSF-1蛋白及mRNA表达情况
长春新碱注射后第7 天,分别对Control 组、CINP 组、CINP+anti 组大鼠脊髓CSF-1 蛋白进行单因素方差分析结果显示差异有统计学意义(蛋白:F=283.20,P<0.001;mRNA:F=0.94,P=0.31):两两比较结果显示CINP 组大鼠脊髓CSF-1 蛋白表达增强(CINP组:蛋白ID=0.85±0.05,P<0.001vs.Control 组),说明腹腔注射长春新碱导致CSF-1表达增加。鞘内给予CSF-1 中和抗体可以抑制长春新碱诱导脊髓CSF-1 表达上调(CINP+anti 组:ID=0.25±0.05,P<0.001vs.CINP 组,图4 A~D)。
2.5 各组大鼠脊髓小胶质细胞标志物Iba1 蛋白及mRNA 表达表达情况

图3 各组大鼠背根节CSF-1 免疫荧光表达情况Fig.3 Immunofluorescence expression levels of CSF-1 in DRG of rats in different groups
长春新碱注射后第7 天,分别对Control 组、CINP 组、CINP+anti 组大鼠脊髓Iba1 蛋白及mRNA进行单因素方差分析结果显示差异有统计学意义(蛋白:F=70.63,P< 0.001;mRNA:F=108.50,P< 0.001):两两比较结果显示CINP 组大鼠背根节Iba1 蛋白及mRNA 表达明显上调[CINP 组(蛋白):0.75± 0.08,P< 0.001vs.Control 组;CINP 组(mRNA):0.95 ± 0.09,P< 0.001vs.Control 组],说明长春新碱腹腔注射导致脊髓小胶质细胞活化。鞘内给予CSF-1 中和抗体可以抑制长春新碱诱导小胶质细胞活化[CINP+anti 组(蛋白):0.53±0.06,P< 0.05vs.CINP 组;CINP+anti 组(mRNA):0.63±0.07,P<0.01vs.CINP 组,图5 A,B]。

图4 各组大鼠脊髓CSF-1 蛋白及mRNA 表达情况Fig.4 Protein and mRNA expression of CSF-1 in spinal cord of rats in different groups

图5 各组大鼠脊髓Iba1 蛋白及mRNA 表达情况Fig.5 Protein and mRNA expression of Iba1 in spinal cord of rats in different groups
2.6 各组大鼠脊髓小胶质细胞标志物Iba1 免疫荧光表达情况
长春新碱注射后第7 天,分别对Control 组、CINP 组、CINP+anti 组大鼠脊髓Iba1 荧光强度进行单因素方差分析结果显示差异有统计学意义(F=91.47,P<0.001):两两比较结果显示CINP 组大鼠脊髓Iba1 荧光强度增强(CINP 组:20.02±2.50,P<0.001vs.Control组),说明长春新碱腹腔注射导致脊髓小胶质细胞活化。鞘内给予CSF1中和抗体可以抑制长春新碱诱导Iba1荧光强度增强(CINP+anti组:ID=6.01±1.82,P<0.001vs.CINP 组,图6 A~D),提示CSF-1作用发挥依赖于脊髓脊髓小胶质细胞。
2.7 各组大鼠脊髓TNF-α、IL-6和IL-1β表达情况
长春新碱注射后第7 天,分别对Control 组、CINP 组、CINP+anti 组大鼠脊髓TNF-α、IL-6 和IL-1β表达进行单因素方差分析结果显示差异有统计学意义(F=20.79,P< 0.01;F=20.81,P<0.01;F=23.23,P<0.01);两两比较结果显示,与Control 组比较,CINP 组大鼠脊髓TNF-α、IL-6 和IL-1β表达增加[(251.45±22.14)pg/mg,P< 0.01,vs.Control 组;(215.42 ± 37.19)pg/mg,P< 0.01,vs.Control 组;(168.43±25.69)pg/mg,P<0.01,vs.Con⁃trol 组],说明长春新碱腹腔注射导致脊髓炎症反应。鞘内给予CSF1 中和抗体可以抑制长春新碱诱导TNF-α、IL-6 和IL-1β表达上调[(165.48±34.26)pg/mg,P<0.05,vs.CINP组;(138.71±16.22)pg/mg,P<0.05,vs.CINP 组;(100.23±18.29)pg/mg,P<0.05,vs.CINP 组,图7 A~C)]。

图6 各组大鼠脊髓Iba1 免疫荧光表达情况Fig.6 Immunofluorescence expression levels of Iba1 in spinal cord of rats in different groups
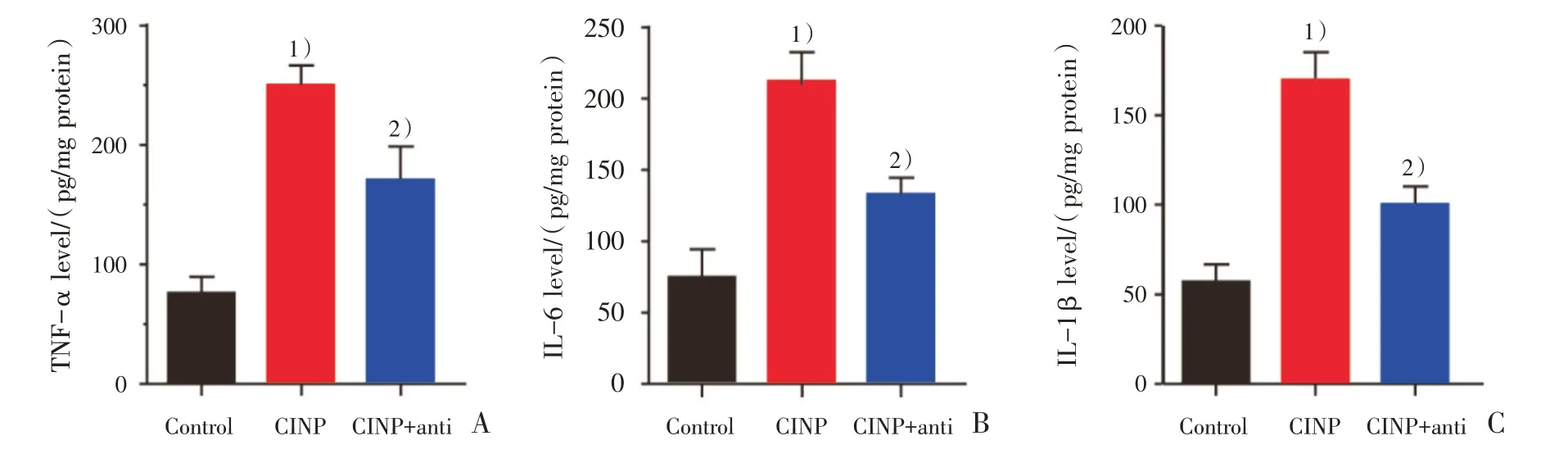
图7 各组大鼠脊髓TNF-α、IL-6 和IL-1β表达情况Fig.7 expression levels of TNF-α,IL-6 and IL-1β in spinal cord of rats in different groups
3 讨论
本研究参照许爱军等[13]方法建立CINP 大鼠模型,该模型由于可操作性强、重复性好、较好模拟临床CINP 特征等优点,已广泛应用于验证药物和探讨机制的动物实验中。长春新碱首次给药后3 d,大鼠MWT 和TWL 开始明显降低,并伴有跛行、抬足、舔舐足底增多以及自发嘶叫等疼痛行为学变化,并持续到本实验观察结束,表明CINP 模型制备成功。我们团队前期研究证实,长春新碱诱导神经病理性疼痛形成过程中,脊髓小胶质细胞活化介导CINP 大鼠痛觉敏化过程,但是小胶质细胞活化调节机制仍不清楚。
CSF-1 是一种细胞因子,通过与Ⅲ型受体酪氨酸激酶偶联CSF-1 受体结合在调节单核细胞、巨噬细胞、小胶质细胞存活、增殖和分化中发挥重要作用[14]。随着神经病理性疼痛机制研究不断深入,细胞因子,尤其CSF-1,备受广泛关注,越来越多证据显示CSF-1 在神经病理性疼痛中发挥重要作用[4-5],结果表明,与Control 组比较,CINP组大鼠脊髓CSF-1蛋白表达明显上调,而CSF-1 mRNA 表达差异无统计学意义,提示CSF-1 原发产生部位并非在脊髓,可能存在其他部位CSF-1 蛋白向脊髓转运;背根节免疫荧光结果表明,与Control 组比较,CINP 组大鼠背根节CSF-1 荧光表达明显上调,脊髓CSF-1 蛋白表达上调是否源于背根节CSF-1 轴向转运,前期实验通过在构建CINP 模型前结扎L4/L5 背根,结果脊髓CSF-1 表达与正常对照组差异无统计学意义,进一步证实背根节CSF-1向脊髓转运。与我们研究不一致,另有研究[15]证实大鼠缺血痛模型建立后6 h 脊髓背角活化的星形胶质细胞产生CSF-1,相反,星形胶质细胞抑制剂氟代柠檬酸显著抑制缺血6 h 后CSF-1 上调,提示CSF-1 其产生部位在脊髓,导致上述实验CSF-1 产生部位差异可能与使用模型以及动物种属不同有关。
既然本研究提示可能存在CSF-1 向脊髓转运,那么CSF1 对长春新碱诱发痛觉过敏调节机制如何?最近的研究表明[7],脊神经结扎大鼠背根节初级感觉神经元中CSF-1 表达上调,通过轴向转运作用于脊髓小胶质细胞表面CSF-1 受体,进而激活小胶质细胞。与上述研究一致的是,本研究腹腔注射长春新碱后,CINP 组脊髓Iba1(小胶质细胞标志物)蛋白和mRNA 表达显著升高,相反,鞘内注射CSF-1 中和抗体明显抑制CINP 大鼠脊髓Iba1 蛋白和mRNA,提示,通过鞘内注射CSF-1 中和抗体阻断CSF-1 信号明显抑制脊髓小胶质细胞活化,CSF-1 信号作用是通过脊髓小胶质细胞活化实现的。
为了进一步证实CSF-1 信号调控脊髓小胶质细胞活化,我们采用脊髓Iba1 免疫荧光化学从形态学角度探讨阻断CSF-1 信号对小胶质细胞活化的影响,结果显示鞘内注射CSF-1 中和抗体阻断CSF-1 信号明显抑制脊髓小胶质细胞活化。一般认为,胶质细胞介导神经炎症在慢性疼痛中枢敏化中发挥作用[16-17],活化胶质细胞释放促炎细胞因子,如:TNF-α、IL-6 和IL-1β,其与感觉神经元表面受体结合,增强神经元兴奋性,促发痛觉过敏[18-19],本研究表明:腹腔注射长春新碱后,CINP组大鼠脊髓TNF-α、IL-6 和IL-1β表达显著上调,相反,鞘内注射CSF-1 中和抗体明显抑制CINP 大鼠脊髓TNF-α、IL-6 和IL-1β表达,提示,通过鞘内注射CSF-1 中和抗体阻断CSF-1 信号明显抑制脊髓神经炎症,即CSF-1 信号作用发挥是依赖于神经炎症。
最近的研究显示,在骨肿瘤诱导的疼痛动物模型中,背根节CSF-1 介导痛觉过敏依赖于钠通道转录水平调控[5],而后者已被证实在多种炎症及神经病理性疼痛中发挥着重要作用[20-21]。因此,背根节水平的CSF-1 在化疗药物引起的痛觉过敏中的具体作用和机制有待研究进一步证实。
总之,CSF-1 自背根节向脊髓转运参与长春新碱诱导神经病理性疼痛发生过程,其机制可能与大鼠脊髓小胶质细胞活化及其炎症反应有关。

