长链非编码RNA LINC00173在紫杉醇耐药乳腺癌细胞中的作用
杨 硕,陈天天,王文锐,杨清玲,陈昌杰
乳腺癌是女性最常见的恶性肿瘤[1],也是女性恶性肿瘤病人第二大死亡原因,化疗耐药是造成病人生存期逐渐缩短的重要原因。长链非编码RNA(long non-coding RNA,LncRNA)是本身不具有编码蛋白质功能的RNA分子,早期发现时被认为是“转录噪音”。近年来随着非编码RNA研究领域的拓展,人们逐渐认识到LncRNA 在越来越多的癌症中发挥重要的原癌基因或抑癌基因作用[2-3]。其通过与各种生物大分子如DNA、蛋白质和RNAs相互作用,参与多种细胞或者生物进程。近年来的研究[4]表明,LncRNA在人类多种癌症中异常表达,具有细胞和组织特异性。LncRNA参与调控肿瘤的发生、增殖、凋亡和侵袭及转移等过程[5-6]。目前越来越多的研究[7-9]发现LINC00173在不同癌症中发挥着不同的调控作用,如LncRNA LINC00173在宫颈癌、结直肠癌及乳腺癌中发挥着抑癌的作用,而在黑素瘤中充当着癌基因的角色。有研究[10]表明LINC00173在调控细胞的耐药性及血管生成方面产生重要作用,但是对其细胞的增殖、侵袭等研究较少。本研究就LINC00173在乳腺癌细胞株中的表达及相关机制进行研究,为进一步提供化疗预后评估生物标志物提供实验依据。
1 材料与方法
1.1 细胞与试剂 正常乳腺上皮细胞株MCF-10A和乳腺癌细胞株MCF-7、SKBR-3、MDA-MB-231购自中国科学院细胞库;胎牛血清和DMEM高糖培养基购自Hyclone公司;Trizol试剂和Lipofectamine2000购自Invitrogen公司;荧光定量聚合酶链反应(qRT-PCR)试剂购自Takara公司;LncRNA LINC00173慢病毒过表达载体及干扰片段购自上海吉玛公司;所有引物由南京金斯瑞生物科技有限公司合成;一抗CyclinD1、β-catenin、P-gp及二抗购自Proteintech公司;CCK8试剂盒购自吉玛公司;Transwell小室购自Corning公司。
1.2 方法
1.2.1 细胞培养 用紫杉醇诱导MCF-7细胞耐药性的产生,使MCF-7细胞处于10 μg/mL的浓度中稳定生长。乳腺癌细胞株均接种于含10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2和95%饱和湿度条件下的培养箱中培养,待细胞生长至融合度80%左右后进行传代培养。所有实验均取对数生长期细胞。
1.2.2 qRT-PCR检测乳腺癌细胞株LINC00173的表达 采用Trizol法提取各乳腺癌细胞株总RNA,根据逆转录试剂说明书进行逆转录,按照荧光定量试剂盒说明书进行PCR实验。GAPDH作为内参,所用的引物序列见表1。qRT-PCR反应参数为95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 34 s,40个循环。获得的数据运用2-ΔΔCt计算表达量。

表1 引物序列
1.2.3 过表达细胞株的构建 收集对数生长期细胞,胰酶消化后接种(3~5)×103个细胞于96孔板,设置不同梯度的感染复数(MOI)值,分别为1、5、10、50、100,加入相应的病毒量后放入5% CO2、37 ℃培养箱中培养;24 h后更换新鲜培养基;96 h后观察荧光表达情况,以确认目的细胞的感染方法和感染指数。取对数生长期细胞消化后重悬,取2×105/mL细胞接种至6孔板中,37 ℃培养箱中培养;取阴性对照和目的病毒按照相应MOI值的病毒量与培养基混合,加入终浓度5 μg/mL的Polybrene,37 ℃培养;24 h后加入新鲜培养基,48 h后荧光倒置显微镜下观察并记录结果。
1.2.4 转染LINC00173干扰片段 收集对数生长期细胞,制成单细胞悬液均匀接种于6孔板中,放入5% CO2、37 ℃培养箱中培养24 h,当细胞汇合度达到70%~90%时分别加入5 μL阴性对照组和干扰片段组和250 μL Opti-MEM轻柔混匀,室温放置5 min,5 μL Lipofectamine2000稀释于250 μLOpti-MEM轻柔混匀,室温放置5 min,将稀释后的Lipofectamine2000与干扰片段混匀,室温放置20 min,用PBS洗涤,加入1.5 mL无血清的培养基,将混合物缓慢加到6孔板中,24~48 h后筛选出效果最佳的干扰片段。LINC00173干扰片段序列为5′-CUC CUA UUC ACC CUU CAG ATT-3′;5′-UCU GAA GGG UGA AUA GGA GTT-3′。
1.2.5 CCK-8法检测细胞的增殖活性 按照Cell-Counting Kit-8细胞增殖检测的说明书进行,细胞消化接种至6孔板(1×105个/孔)),分别将实验组、对照组的质粒转染至细胞中,培养48 h后,细胞消化离心至96孔板(2 000个/孔),每组设立3个复孔。分别在0、24、48、72 h时,加入CCK-8试剂(10 μL/孔),2 h后分别检测各孔的吸光度(450 nm)。
1.2.6 划痕实验检测细胞的迁移能力 胰酶消化对数生长期细胞,离心将细胞制成单细胞悬液接种于6孔板中,置于5% CO2、37 ℃培养箱中培养。当细胞生长至80%左右汇合时,用10 μL无菌枪头在细胞板中央轻轻划出一道伤口,注意保持各组划出的伤口宽度基本一致,用PBS清洗2次,加入无血清培养基继续放于5% CO2、37 ℃培养箱中培养,24 h后在低倍镜下观察各组细胞的迁移结果。
1.2.7 Transwell实验检测细胞的侵袭能力 胰酶消化对数生长期细胞,用无血清培养基将每组的细胞调整到相同细胞密度。按照实验分组,各组配置100 μL加入Transwell小室的上室。Transwell小室的下室加入600 μL含10%胎牛血清的DMEM培养基,5% CO2、37 ℃培养箱中培养24 h。取出Transwell小室,用棉签小心擦去Transwell小室上室的培养基以及膜上部未穿过的细胞,4%多聚甲醇固定20 min,吉姆萨染液染色,倒置显微镜随机计数5个高倍镜视野下细胞数目并拍照记录。
1.2.8 Western blotting法检测CyclinD1、β-catenin、P-gp蛋白的表达 收集转染干扰片段的MCF-7细胞及过表达LINC00173处于对数生长期的MCF-7/PR耐药细胞,加入RIPA 裂解液,冰浴30 min,4 ℃条件下经12 000 r/min离心30 min,提取细胞总蛋白。采用BCA法测定蛋白浓度。取30 μg蛋白样品与上样缓冲液充分混匀后点样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜、封闭,加入CyclinD1、β-catenin、P-gp蛋白一抗稀释液(1∶1 000),4 ℃孵育24 h,洗膜,加入二抗稀释液(1∶2 000)室温孵育2 h,ECL显影,应用ImageJ软件分析蛋白条带灰度值。
1.3 统计学方法 采用方差分析、q检验和t(或t′)检验。
2 结果
2.1 人乳腺癌细胞株MCF-10A、MCF-7、MDA-MB-231和SKBR-3中LINC00173表达水平比较 qRT-PCR结果显示,相对于正常人乳腺上皮细胞系MCF-10A,LINC00173在3种乳腺癌细胞系中相对低表达,差异均有统计学意义(P<0.01)(见表2)。
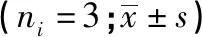
表2 在MCF-10A、MCF-7 、MDA-MB-231和SKBR-3细胞中LINC00173表达水平比较
2.2 siRNA下调乳腺癌细胞系MCF-7中LINC00173水平 为进一步研究LINC00173在乳腺癌中的作用,特异性的si-LINC0013被转入到MCF-7中,非特异性的siRNA作为阴性对照(si-NC)。与si-NC组相比,si-LINC00173组的LINC00173表达量明显降低(P<0.01)(见表3)。
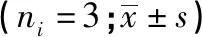
表3 si-LINC00173对MCF-7细胞LINC00173表达的影响
2.3 过表达LINC00173对乳腺癌耐药细胞MCF-7/PR中LINC00173表达的影响 为评估LINC00173在乳腺癌细胞中的作用,LV-LINC00173载体转入到MCF-7/PR细胞中,以阴性对照(LV-NC)组为对照。与阴性对照组相比,过表达LV-LINC00173载体组LINC00173的表达量升高(P<0.01)(见表4)。
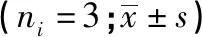
表4 LV-LINC00173对MCF-7/PR细胞LINC00173表达的影响
2.4 LINC00173对乳腺癌细胞增殖的影响 为探讨LINC00173在乳腺癌细胞中的生物学作用,利用CCK8法检测细胞的增殖能力,结果显示,与si-NC转染组相比,si-LINC00173转染组明显促进MCF-7细胞的增殖(P<0.01)(见表5);与LV-NC组相比,LV-LINC00173组明显抑制细胞的增殖(P<0.01)(见表6)。
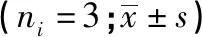
表5 si-LINC00173对MCF-7细胞的增殖促进作用
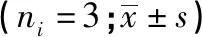
表6 LV-LINC00173对MCF-7/PR细胞的增殖抑制作用
2.5 LINC00173表达对乳腺癌细胞的侵袭和迁移能力的影响 与si-NC组相比,通过划痕实验结果发现,si-LINC00173的迁移率明显上升(见图1)。Transwell实验结果表明,si-LINC00173侵袭的细胞数明显增加(P<0.01)(见图2、表7)。而上调LINC00173表达后,LV-NC组相比,LV-LINC00173侵袭的细胞与迁移能力明显降低(见图3、4、表8)。
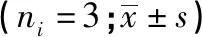
表7 si-LINC00173对MCF-7细胞迁移能力的影响
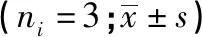
表8 LV-LINC00173对MCF-7/PR细胞迁移能力的影响
2.6 LINC00173对CyclinD1、β-catenin、P-gp的影响 Western blotting结果显示,与si-NC组相比,si-LINC00173的CyclinD1、β-catenin、P-gp蛋白水平明显升高(见图5,表9)。而相对于阴性对照(LV-NC)组,过表达LINC00173后,乳腺癌耐药细胞株MCF-7/PR的CyclinD1、β-catenin、P-gp蛋白表达量显著降低(P<0.01)(见图6、表10)。
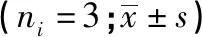
表9 si-LINC00173对MCF-7细胞的CyclinD1、β-catenin、P-gp的影响
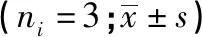
表10 LV-LINC00173对MCF-7/PR细胞的CyclinD1、β-catenin、P-gp的影响
3 讨论
LncRNA是一类长约200个核苷酸的非编码RNA,在非编码RNA中所占比例最高,广泛存在于人体正常组织中[11-12],在转录或转录后水平发挥基因调控作用,参与细胞的增殖、分化、凋亡、转移等多种生物学行为[13-14]。近年来的研究[15-17]表明,越来越多的lncRNA,如SOX2OT、BCRT1、AFAP1-AS1等与乳腺癌的发生发展相关,涉及细胞中的多种分子和信号通路。LINC00173在乳腺癌中的作用研究报道目前尚少。
LINC00173位于细胞核内的12号染色体,参与了肿瘤的形成与发展,LINC00173在许多肿瘤中发挥着抑癌作用,调控肿瘤的发生与发展。ZENG等[18]研究证明,LINC00173在非小细胞肺癌中的表达显著降低,与肿瘤的大小和分化程度有关,体外过表达LINC00173后抑制了癌细胞的转移[19]。FAN等[20]研究指出,在肿瘤细胞中,上调LINC00173后,乳腺癌细胞增殖活性显著降低,β-catenin、P-gp、CyclinD1蛋白水平降低,提示LINC00173的表达可能通过下调β-catenin的表达从而抑制乳腺癌细胞的增殖。虽然对LINC00173的研究很多,但其在乳腺癌中的作用研究较少。
LINC00173可能通过多种方式在肿瘤的发生与发展中发挥作用。有研究[21]表明,在粒细胞分化和早期髓系祖细胞或前体与EZH2的相互作用中产生作用,进而促进肿瘤的形成;YU等[8]研究发现 LINC00173可以与PLP2蛋白相互作用,下调LINC00173,降低PLP2蛋白,减少对细胞周期的阻断作用,从而促进细胞增殖;ZHAO等[22]研究表明,LINC00173可能通过一些靶基因调控癌症的进展和耐药,比如FBXW7、Ekt等。另有报道[23]LINC00173在肿瘤的增殖、侵袭及转移中的作用,但在乳腺癌中与增殖、转移的关系报道很少。
为进一步阐明LINC00173在乳腺癌中的作用机制,本研究比较了3株乳腺癌细胞株LINC00173的表达量。结果发现LINC00173在乳腺癌细胞株中相对低表达,根据数据库分析LINC00173在MCF-7细胞中主要分布于细胞核内,因此在后续实验中用MCF-7细胞及MCF-7/PR耐药细胞株进行研究。在MCF-7细胞中下调LINC00173的表达,乳腺癌细胞的增殖、侵袭及迁移能力明显增加。相反,在MCF-7/PR细胞中上调LINC00173的表达,乳腺癌细胞的增殖、侵袭及迁移能力明显下降,表明LINC00173可能会调控乳腺癌细胞的发展进程。这些结果表明LINC00173在乳腺癌的发生发展过程中起着抑癌的作用,它的缺失与过表达可能引起乳腺癌。综上所述,上调LINC00173在乳腺癌细胞的增殖、侵袭和转移中发挥重要作用;可能通过β-catenin信号通路,抑制乳腺癌耐药细胞的侵袭和转移能力。但目前的研究较浅,LINC00173在肿瘤的转移中的调控作用还需进一步研究,为临床开发肿瘤标志物及靶向药物提供新的方向。

