PGAM5对食管癌细胞系增殖与转移能力的影响
郭秉楠,燕宪亮,许 铁
食管癌作为消化道系统中常见的恶性肿瘤,由于其高侵袭性和低存活率,5 a生存率仅为10%~15%,其发生率在人类所有恶性肿瘤中列第八位,死亡率列第六位[1-3]。由于人们的健康意识以及检测条件的限制,大量原发食管癌患者初诊时已发现淋巴结转移[4]。近年来,随着对食管癌发生发展机理的深入研究,越来越多的治疗靶点被发现,但是有效且安全的治疗靶点对食管癌的预后仍不甚理想。因此,寻找参与食管癌发生和转移相关的分子标志物及治疗干预靶点,对于指导治疗、提高患者生存率具有重要的意义。
磷酸甘油酸变位酶/蛋白家族5 (PGAM5,phosphoglycerate mutase/protein family member)是一个非典型的线粒体丝氨酸/苏氨酸磷酸酶,与磷酸甘油酸变位酶同源,但缺乏相应的酶催化功能,最初发现与Bcl-xL相互作用[5]。最近的研究发现,PGAM5调节多重细胞死亡通路,包括凋亡和坏死[6-7]。例如PGAM5与Bcl-xL调节低氧诱导下的线粒体自噬,从而控制细胞凋亡。目前关于PGAM5在肿瘤中的作用研究较少,主要集中于肝癌和弥散性大B淋巴细胞瘤,均发现其在肿瘤组织中显著升高,但在食管癌中的生物学作用尚不明确[8-9]。本研究通过小干扰RNA技术,在体外探讨PGAM5对食管癌细胞增殖与转移能力的影响,现报道如下。
1 材料与方法
1.1 实验试剂人食管上皮细胞系HEEC及人食管癌细胞系KYSE150购自中科院细胞库;RPMI1640培养基、胎牛血清购自Gibco公司;小干扰RNA(PGAM5:5’-AGTCAGAAGGGTTGGCCAA-3’)、对照小干扰RNA(5’-TTCTCCGAACGTGTCACGTTT-3’)购自上海吉玛公司; Lipofectamine 2000转染试剂购自Thermo Fisher公司;抗PGAM5、Bcl-xL 和MMP2抗体购自CST公司;β-actin抗体购自Santa Cruz;CCK-8购自碧云天公司;Annexin V-FITC和PI购自Biolegend公司。
1.2 实验方法
1.2.1 细胞培养与转染人食管正常上皮细胞HEEC及食管癌细胞系KYSE150培养于含10%胎牛血清的RPMI1640培养基中。两种细胞系在含5%二氧化碳的37 ℃的培养箱中备用。在转染特异性siRNA及对照siRNA前一天取对数生长期的细胞系各5×105个细胞接种于6 cm培养皿中,待细胞生长到60%密度时,按照Lipofectamine 2000说明书进行转染。
1.2.2 细胞增殖实验取转染后的人食管癌细胞系KYSE150铺于96孔培养板中,每空4 000个细胞,每孔加完全培养基200 μL后置于含5%二氧化碳的37 ℃的培养箱培养4 d,分别取24、48、72、96 h时间点弃培养基,加入新鲜无血清培养基100 μL、CCK8溶液10 μL,充分混匀后加入96孔板中,继续培养4 h后,酶标仪测OD450值。
1.2.3 细胞凋亡实验取1×106转染后的KYSE150细胞放置于流式管中,500 μL 流式缓冲液(含0.5%FBS的PBS)洗1遍,100 μL流式缓冲液重悬细胞并加入3 μL Annexin V-FITC 和5 μL PI,轻轻混匀后4 ℃避光孵育30 min,500 μL 流式缓冲液洗2遍,流式细胞仪检测细胞凋亡情况。
1.2.4 细胞划痕实验人食管癌细胞系KYSE150转染siRNA 48 h后,用200 μL黄色移液器吸头,利用直尺在6孔板底部划1条等距离平行线,用PBS轻轻洗去滑落的细胞,用维持培养基(含1%胎牛血清)在37 ℃的培养箱继续培养。分别于0、12、24、48 h用电子显微镜采集图像,观察细胞迁移情况。细胞划痕实验相对定量通过image J软件进行。
1.2.5 Transwell实验侵袭实验在Transwell小室上层均匀铺40 μL含基质胶的培养基,置于37 ℃的培养箱备用。每空4 000个转染后的细胞加入上室中后加入200 μL培养基,Transwell下层加含15%胎牛血清的培养基800 μL,继续培养24、48 h。培养结束后,90%甲醇固定15 min,结晶紫染色15 min,PBS漂洗2次,电子显微镜采集图像,观察细胞侵袭情况。细胞侵袭实验相对定量通过image J软件进行。
1.2.6 免疫印迹实验转染后的正常人食管上皮细胞及食管癌癌细胞系裂解液50 μg于上样缓冲液中100 ℃煮10 min后进行SDS-PAGE电泳。电泳2 h后,转印到PVDF膜上;一抗(1∶1 000)4 ℃孵育过夜后,TBST漂洗3次,每次10 min;二抗(1∶5 000)室温孵育2 h后,TBST漂洗3次,每次10 min;化学发光(electro chemilamines cence,ECL)仪中进行拍照并分析条带灰度值。
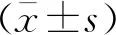
2 结果
2.1 两种细胞系PGAM5的表达通过Western blotting实验检测发现,与人食管上皮细胞系HEEC相比,KYSE150细胞系的PGAM5蛋白的表达水平显著高于HEEC细胞系,差异有统计学意义(P<0.05)(图1),提示食管癌细胞中PGAM5蛋白可能异常高表达。
①P<0.05。
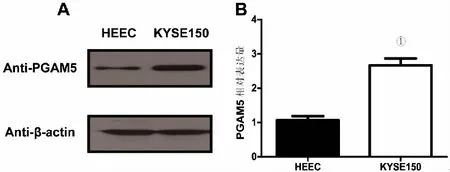
2.2 siRNA干扰食管癌细胞系后对PGAM5、Bcl-xL 、MMP2蛋白表达的影响siPGAM5转染食管癌细胞系KYSE150 48 h后,Western blotting检测PGAM5、Bcl-xL、MMP2蛋白在KYSE150细胞系中表达的变化,发现与siCtrl组相比,siPGAM5组PGAM5蛋白表达量显著降低,同时发现Bcl-xL、MMP2蛋白表达水平也显著降低。提示干扰PGAM5后,可以降低抗凋亡蛋白Bcl-xL的稳定性,同时降低迁移与黏附相关蛋白相关MMP2的表达(图2)。
①P<0.05。
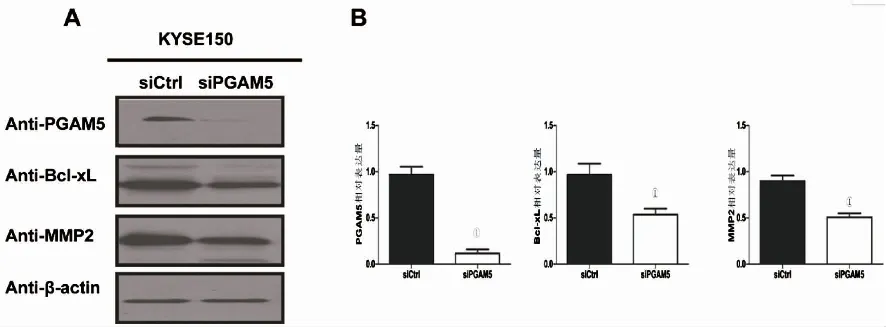
2.3 siRNA干扰PGAM5后对食管癌细胞系增殖和凋亡能力的影响通过CCK8实验分析发现:与siCtrl组相比,siPGAM5组细胞增殖能力显著降低,差异有统计学意义(P<0.05)(图3A);通过流式细胞术检测发现:与siCtrl组相比,siPGAM5组细胞凋亡能力显著增高(图3B、C),差异有统计学意义(P<0.05),提示干扰PGAM5可以抑制KYSE150细胞系增殖并促进其凋亡。
A:CCK8检测细胞增殖;B、C:流式细胞术检测细胞凋亡。①P<0.05。
2.4 siRNA干扰PGAM5后对食管癌细胞系转移能力的影响通过划痕实验发现:与siCtrl组相比,siPGAM5组在48 h后的迁移能力显著降低,差异有统计学意义(P<0.05)(图4A),提示干扰PGAM5可以抑制KYSE150细胞系的迁移能力。同时通过Transwell实验发现:siPGAM5组细胞侵袭数量明显低于siCtrl组,差异有统计学意义(P<0.05),提示干扰PGAM5可以抑制KYSE150细胞系的侵袭能力(图4B)。
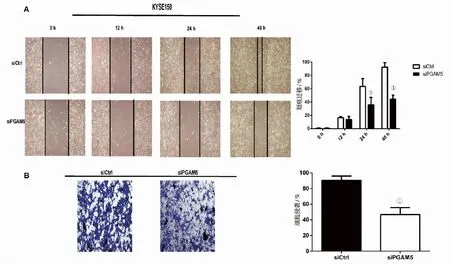
A:划痕实验检测细胞迁移;B:Transwell实验检测细胞侵袭。①P<0.05。
3 讨论
PGAM5作为线粒体膜上的蛋白,可通过多种细胞坏死性通路参与多种细胞内活动。许多研究表明,细胞的凋亡和坏死会影响肿瘤的发生发展,如抗凋亡基因Bcl-xL在肝癌、乳腺癌、胶质瘤等多种肿瘤中促进肿瘤的发生[10-12]。PGAM5作为一种新发现的与Bcl-xL相互作用的蛋白在肝损伤、肺纤维化及心脏损伤中发挥重要作用[13-16],但在肿瘤中的作用知之甚少。本研究首次发现了PGAM5在人食管癌细胞系中的作用。
本研究首先通过与正常人食管上皮细胞系比较发现,人食管癌细胞系KYSE150的PGAM5蛋白表达水平异常升高。通过siRNA技术干扰人食管癌细胞系中PGAM5蛋白的表达后发现Bcl-xL蛋白的表达亦下调,与之前报道的肝癌中的结果相一致[8],提示干扰PGAM5可以抑制细胞增殖。进一步发现干扰PGAM5后,MMP2蛋白表达量随之降低。作为一种金属基质蛋白酶,MMP2是降解基底膜和细胞外基质的关键酶之一[17],提示抑制PGAM5蛋白表达后,可以阻止食管癌细胞突破基底膜,从而抑制食管癌细胞的转移。为了证实上述Westren blot实验结果和本实验假说,进一步通过CCK-8实验,细胞划痕实验以及Transwell实验验证。实验结果表明,抑制PGAM5后,KYSE150细胞的增殖和转移能力均显著降低。
综上所述,虽然目前对食管癌的治疗仍存在困难,但是随着对其发生发展机制了解的更为深入,越来越多的靶点被发现。本研究提示,PGAM5可能通过调节Bcl-xL和MMP2的表达,进而调节食管癌细胞的增殖与转移,但更为详尽的机制还需进一步研究。

