超高效液相色谱-串联质谱法测定甜菜中甜菜安和甜菜宁的残留量
董见南,贾金蓉,陈国峰,刘峰,张晓波
(黑龙江省农业科学院农产品质量安全研究所,哈尔滨 150086)
0 引言
甜菜安(Desmedipham)和甜菜宁(Phenmedipham)为二氨基甲酸酯类除草剂,先后由Arndt 等人于1967年、1969 年报道除草活性,德国先灵公司开发的选择性内吸除草剂[1]。能有效防治多种阔叶杂草,在我国主要在甜菜和草莓等作物上登记使用。已有报道中对甜菜安及甜菜宁的研究主要集中在合成[1-2]、药效[3-5]、制剂分析[6]及环境基质中的残留分析[7-8],作物基质中甜菜安及甜菜宁残留量分析方法鲜有报道。黄雅俊等[9]、逯忠斌等[10]建立的甜菜安及甜菜宁在甜菜及甜菜叶中的残留分析方法,分别使用丙酮和硫酸铜溶液-甲醇混合液提取,经液液分配转入二氯甲烷中,再使用中性氧化铝柱净化,高效液相色谱检测分析。此方法检测器灵敏度较低,因此采用加大样本量(50 g)的方法增加浓缩倍数来提高灵敏度,这使得净化过程较为复杂,且前处理过程使用大量的有机溶剂,不能满足经济、环保、绿色的发展要求。GB/T 20769-2008[11]建立的水果蔬菜中的多残留分析方法中包含甜菜宁,该方法使用高效液相色谱-串联质谱做检测器,灵敏度较高,使用乙腈做提取溶剂,固相萃取柱净化较层析柱简便。已有的文献未能同时检测甜菜安和甜菜宁且将两种除草剂分别定量检测,本研究结合了分散固相萃取净化法,建立了超高效液相色谱-串联质谱法同时分析甜菜中甜菜安及甜菜宁残留量的方法,并对田间试验样品进行了检测分析,为指导农药的合理安全使用提供数据支持。
1 材料与方法
1.1 试剂与仪器
甜菜安标准品(99.0%)、甜菜宁标准品(99.7%)由Dr.Ehrenstorfer 公司提供;乙腈、甲醇、甲酸均为色谱纯,由迪马公司提供;NaCl 为分析纯,由北京化学试剂公司提供;丙基乙二胺(PSA)40~60µm,由上海安谱有限公司提供。供试农药为27%安•宁•乙呋黄乳油(甜菜安7%、甜菜宁9%、乙氧呋草黄11%)。
Waters TQ Detector 超高效液相色谱-串联质谱仪(HPLC-MS/MS);色谱柱Acquity UPLC® BEH C18(100 mm×2.1 mm,1.7µm);电子天平Sartorius BSA6202S;振荡器IKA HS501;过滤器(滤膜孔径0.22µm);常用玻璃器皿。
1.2 试验方法
1.2.1田间试验
参照《农药残留试验准则》(NY/T 788-2018)[12],2018 年在黑龙江省哈尔滨市、北京市及宁夏回族自治区银川市3 地进行了田间试验。27%安•宁•乙呋黄乳油,推荐施药剂量1 215~1 620 g a.i./hm2(制剂300~400 mL/亩),选择最高剂量1 620 g a.i./hm2进行最大风险试验。于甜菜苗后阔叶杂草2~4 叶期,喷雾施药一次。另设空白对照小区。于甜菜收获期采集甜菜根块样品与对照样品。样品采集后用自封袋密封,贴好标签后在-20 ℃以下保存。
1.2.2前处理
称取粉碎的甜菜样品10 g 于50 mL 具塞离心管中,移取10 mL 水和20 mL 乙腈,加盖后振荡提取30 min,加入4 g NaCl,涡旋1 min 盐析,以3 500 r/min 离心5 min。移取10 mL 上层有机相,40 ℃水浴旋转蒸发至干,1 mL 乙腈-水(5∶5)定容。用50 mg PSA 分散固相萃取净化,上清液经0.22µm 有机系滤膜过滤,待进样分析。外标法进行定量和定性分析。
1.2.3仪器条件
色谱柱Acquity UPLC®BEH C18(100 mm×2.1 mm,1.7µm);柱温35 ℃;流速0.30 mL/min;流动相及梯度洗脱见表1;进样量10µL;电喷雾离子源ESI;正离子源扫描方式;毛细管电压3.5 kV;离子源温度150 ℃;脱溶剂温度350 ℃;脱溶剂气流量650 L/h;锥孔气流量50 L/h;多重反应监测(MRM)方式,甜菜安和甜菜宁的定量、定性离子对及其他质谱分析条件见表2。

表1 梯度洗脱比例Table 1 Ratio table of gradient elution
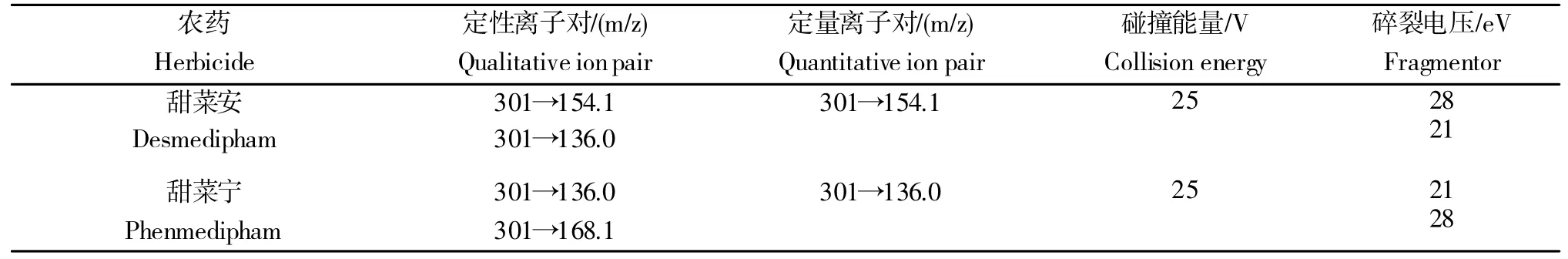
表2 甜菜安和甜菜宁的质谱分析条件Table 2 Mass spectrometry analysis conditions of desmedipham and phenmedipham
1.2.4标准工作曲线的绘制
分别称取甜菜安和甜菜宁标准品0.010 9 g(精确至0.000 1 g)于10 mL容量瓶中,用乙腈定容至刻度线,配制成质量浓度为1 000 mg/L 的标准贮备液,再配制成质量浓度为100 mg/L 的混合工作溶液。试验时再用乙腈-水(5∶5)逐级稀释成质量浓度为1.0、0.5、0.1、0.05、0.01 mg/L 的系列标准溶液。在上述仪器条件下测定,以标准溶液浓度为横坐标(x)、定量离子峰峰面积为纵坐标(y)绘制标准工作曲线。
1.2.5方法的回收率和精密度
向空白甜菜中添加甜菜安和甜菜宁的混合工作溶液,样品中添加浓度如表1 所示,每个浓度进行5 次重复试验,然后按照上述方法测定,计算回收率和相对标准偏差。
2 结果与分析
2.1 仪器参数优化
甜菜安及甜菜宁的结构式见图1,二者从结构上比较相似,为了在液谱上实现两者的分析,需要较大比例的水基流动相,因此在流动相的梯度洗脱方面进行了优化。在经过前1 min 的预浓缩(水基-甲醇90∶10)后,选择1.0~5.0 min逐渐过渡至水基-甲醇50∶50,5.0~15.0 min逐渐过渡至水基-甲醇30∶70,使得甜菜安与甜菜宁达到完全分离。使用纯乙腈作定容溶剂时,两种除草剂的溶剂效应严重,色谱峰会出现较明显的溶剂前延,因此选择乙腈-水(5∶5)作定容溶剂,色谱峰峰形明显改善(见图2)。
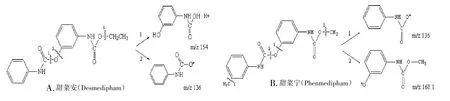
图1 甜菜安(A)及甜菜宁(B)可能的碎片离子断裂方式Fig.1 Possible broken ways of desmedipham(A)and phenmedipham(B)to fragment ions
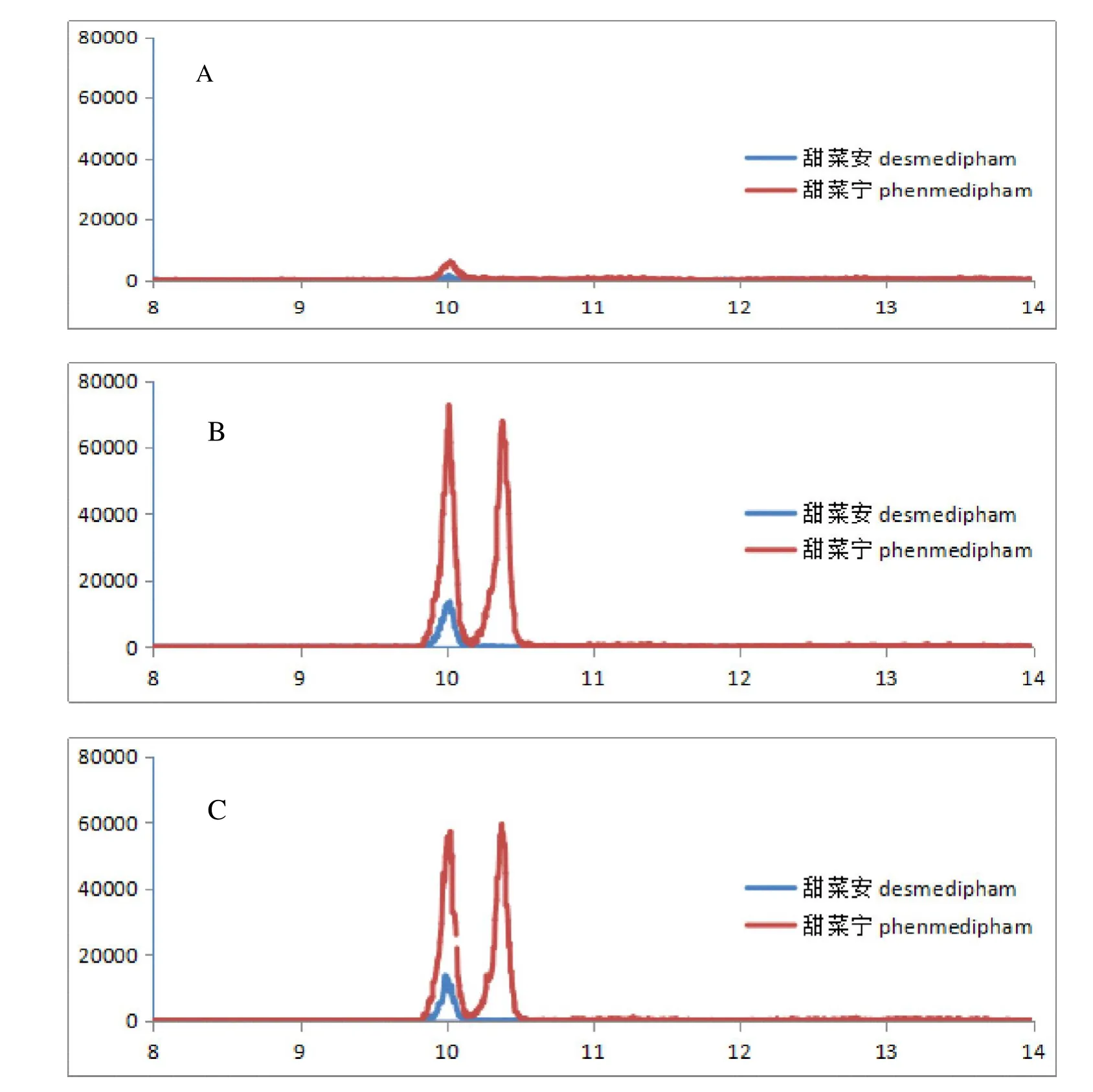
图2 甜菜安及甜菜宁在甜菜空白样品(A)、基质匹配标样(B)和添加回收样品(C)中的典型色谱图Fig.2 Typical UPLC-MS/MS chromatograms of desmedipham and phenmedipham in sugar beet blank(A),sugar beet matrix standard(B)and sugar beet recovery sample(C)
甜菜安及甜菜宁的结构式仅一个甲基位置不同,因此易得到相同或相似的碎片离子。对甜菜安及甜菜宁进行碎片离子扫描(图3),二者均易得到核质比(m/z)为136的碎片离子,为了使甜菜安和甜菜宁在离子对方面得到区分,兼顾其他碎片离子的灵敏度,最终确定甜菜安以离子对(m/z)301→154.1 进行定量分析,301→136 进行定性分析,甜菜宁以离子对(m/z)301→136 进行定量分析,301→168.1 进行定性分析。可能的碎片离子断裂方式如图1所示。

图3 甜菜安(A)及甜菜宁(B)碎片离子扫描图Fig.3 The fragment ions scan chromatograms of desmedipham(A)and phenmedipham(B)
2.2 前处理方法摸索
国标GB/T 20769-2008[11]收录了蔬菜水果中甜菜宁的残留分析方法,参照国标选用乙腈做提取溶剂。乙腈提取之后的溶液,会有色素、酚类、醌类等杂质[13]。考虑甜菜中可能含有较高的糖类等杂质,本文比较了无净化、弗罗里硅土、C18、PSA(25 mg 及50 mg)对浓缩后提取液的净化效果。试验结果表明,对于两种除草剂,净化与否及不同净化剂对回收率均无明显影响,但净化后甜菜安的灵敏度有大幅度提高,且50 mg PSA净化效果最显著。因此选择使用50 mg PSA 做为净化剂对提取浓缩液进行分散固相萃取净化。
2.3 检测方法评价
用乙腈-水(5∶5)配制不同质量浓度的甜菜安及甜菜宁系列标准溶液,浓度与仪器条件见1.2.4,在0.01~1.0 mg/L浓度线性良好。
甜菜宁的标准工作曲线为:y=31 658 x-45.9(R2=0.999 9)
甜菜安的标准工作曲线为:y=71 690 x+90.7(R2=0.999 6)
甜菜安及甜菜宁在甜菜中的添加回收试验,典型色谱图如图2 所示。甜菜安的平均回收率为91.1%~95.6%,相对标准偏差(RSD)为2.4%~7.6%;甜菜宁的平均回收率为93.4%~95.8%,RSD 为5.0%~9.8%(表3)。将最小添加浓度确定为方法的定量限(LOQ,以质量分数计,mg/kg),甜菜安及甜菜宁在甜菜中的LOQ均为0.02 mg/kg。以定量离子色谱峰3 倍信噪比对应浓度确定为方法的检出限(LOD,以质量分数计,mg/kg),甜菜安的LOD 为1.5×10-3mg/kg,甜菜宁的LOD 为2.6×10-4mg/kg。中国制定的最大残留限量(GB 2763-2016)均为0.1 mg/kg。结果表明所建方法的准确度、精密度及灵敏度较好,均符合农药残留分析试验的要求。
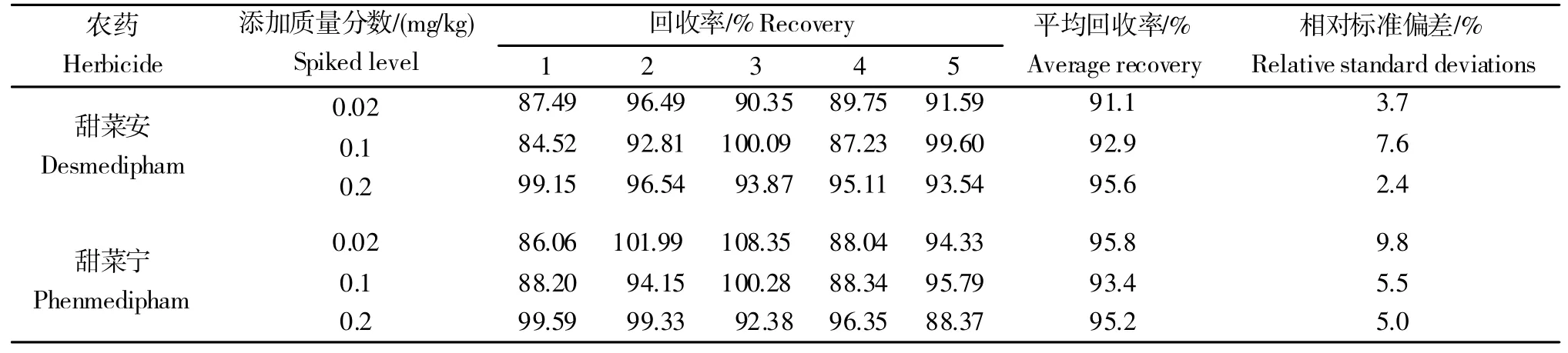
表3 甜菜安及甜菜宁在甜菜中的添加回收率Table 3 Recoveries of desmedipham and phenmedipham in sugarbeet
2.4 甜菜安及甜菜宁在田间样品中的检测
2018年按照施药剂量1 620 g a.i./hm2(制剂400 mL/亩)在甜菜上施用1次,施药时期为苗后阔叶杂草2~4 叶期,甜菜收获时采集甜菜块根样品进行残留量测定。哈尔滨市、北京市及银川市3 地样品中甜菜安及甜菜宁的残留量均<0.02 mg/kg。我国制定的甜菜安及甜菜宁在甜菜中的最大残留限量为0.1 mg/kg。试验结果表明,按照推荐方法施用该农药,收获期甜菜中的甜菜安及甜菜宁残留量低于我国限量标准。
3 讨论与结论
本文研究建立了采用超高效液相色谱-串联质谱法同时测定甜菜中甜菜安及甜菜宁残留量的方法。已有关于甜菜安及甜菜宁残留检测方法的报道较少。黄雅俊等[9]使用丙酮作提取溶剂,逯忠斌等[10]选用硫酸铜溶液-甲醇混合液提取,Perret等人[7]选用甲醇进行土壤中两种除草剂的提取,近年来随着QuEChERS 方法的发展应用,乙腈作为提取溶剂的优点越来越得到广大科学工作者的认可,国标GB/T 20769-2008[11]亦选用乙腈作为水果蔬菜中甜菜宁的提取溶剂。综合考虑后续浓缩净化步骤,本研究直接选择乙腈与水的混合溶液做提取溶剂,NaCl盐析后通过简单的离心步骤即可实现有机相与水相的分离。国标使用固相萃取柱法进行净化,每个样品需要消耗有机溶剂35~40 mL,净化过程约耗时20 min,本研究选用分散固相萃取法净化,几乎不额外消耗有机溶剂,每个样品3~5 min 即可完成净化步骤。与固相萃取柱法相比,分散固相萃取法操作简便且节省溶剂,省时省力、绿色环保。考虑甜菜样品中可能含有的杂质,通过比较无净化、PSA及弗罗里硅土等几种净化方式,最终选择50 mg PSA 作为净化剂。利用串联四级杆质谱检测器选择性强的优点,分散固相萃取可以取代国标方法中固相萃取柱的净化方法,使净化步骤更加简便高效。
经本文建立的残留量测定方法,甜菜安及甜菜宁在甜菜中的平均回收率分别为91.1%~95.6%、93.4%~95.8%,RSD 分别为2.4%~7.6%、5.0%~9.8%,方法的定量限(LOQ)均为0.02 mg/kg。该方法步骤简单,省时快速,精准度和灵敏度均能满足农药残留检测的要求。田间试验表明,以施药剂量1 620 g a.i./hm2(制剂400 mL/亩)于苗后阔叶杂草2~4 叶期在甜菜上施用27%安•宁•乙呋黄乳油1 次,收获期甜菜中甜菜安及甜菜宁的残留量均<0.02 mg/kg。我国已制定二者在甜菜中的最大残留限量为0.1 mg/kg。结果表明,按照推荐剂量施用27%安•宁•乙呋黄乳油后,收获甜菜中甜菜安及甜菜宁的残留量低于我国限量标准,该数据为指导农业生产提供了数据参考。

