叶片黄化对‘赤霞珠’葡萄光合及叶绿素荧光特性的影响
,,, ,
(宁夏农林科学院 种质资源研究所,宁夏 银川 750002)
葡萄Vitis viniferaL.是栽培面积最大的果树之一。随着我国葡萄种植面积的扩大,叶片黄化已成为其常见的病害,并制约着葡萄产量及品质的提高。葡萄叶片黄化主要表现为叶片颜色失绿,黄化较严重时叶面呈淡黄色甚至黄白色,叶缘、叶尖焦枯[1-2]。叶片失绿会降低光合产物的积累,致使光合作用不能正常进行[3-4],还可导致叶片叶面积减小,生长势减弱,植株的产量及品质等大幅降低[5]。因此,研究不同黄化程度葡萄植株叶片光合、叶绿素荧光等参数的变化特点及叶片黄化的发生机制,对于减轻葡萄黄化的危害,保证葡萄的生长及果实发育均有重要意义。
黄化现象在不同植物上均有发生。王志军等[6]研究发现,膜下滴灌水稻黄化剑叶的光合色素含量、净光合速率、光合活性均显著低于正常绿叶;张晨禹等[7]的研究结果表明,‘湘妃翠’茶树的黄化植株其光合色素含量、光化学效率等参数均显著低于正常植株(对照);熊博等[3]研究发现,叶片黄化抑制了黄果柑、不知火幼苗的正常生长,而且叶片的光合色素含量、Fv/Fm值、光化学淬灭(qP)、非光化学淬灭(NPQ)等参数均显著降低;徐冬平等[8]研究发现,玉米黄化植株净光合能力降低的原因可能是其电子传递潜力、原初光能捕获效率和转换效率、光能分配及利用率均较低;周龙等[2]研究发现,生理性黄化可导致无核白和白鸡心葡萄叶片组织内栅栏组织细胞和海绵组织细胞之间模糊不清。
因此,本研究以已出现黄化现象的‘赤霞珠’葡萄为材料,通过分析不同黄化程度葡萄叶片光合色素含量、光合作用及叶绿素荧光参数的变化特点,以期探明试验地内不同黄化程度下‘赤霞珠’葡萄的光合作用特征,进一步了解黄化对葡萄生理性的危害和影响,旨在为酿酒葡萄叶片黄化的改善提供理论参考依据。
1 材料与方法
1.1 试验地概况
试验于2018年7月在宁夏农林科学院园林场试验基地(106°8′58″E、38°38′58″N)进行。该基地属灌淤潮土,土壤pH 值为8.1 ~8.3,0 ~60 cm土壤中有机质含量为4.92 ~8.26 g·kg-1,全盐含量为0.7 ~1.6 g·kg-1,速效氮、速效磷、速效钾含量分别为85 ~175、45 ~58、145 ~240 g·kg-1[9]。
1.2 试验材料
试验品种为‘赤霞珠’,欧亚种。2002年定植,直立独龙干整形,南北行向,株行距为1.0 m×3.0 m,采用滴灌方式进行灌溉。2018年该试验基地内‘赤霞珠’葡萄黄化植株的比例达到65.10%,黄化指数为37.22%。
1.3 仪器与设备
Handy PEA 连续激发式荧光仪和TPS-2 光合作用测定仪,汉莎科技集团有限公司;UV2600紫外分光光度计,上海天美科学仪器有限公司;ME204 分析天平,梅特勒-托利多国际贸易(上海)有限公司;1580R 高速冷冻台式离心机,美国基因有限公司。
1.4 材料处理方法
参照刘春燕等[10]的分级标准将试验基地内黄化葡萄植株分为4 个等级:I级,叶脉为绿色,叶肉为黄绿色;Ⅱ级,叶脉保持绿色,叶脉间显著变黄;Ⅲ级,叶脉呈淡黄色,叶片由黄色变为白色;Ⅳ级,叶面全部黄化,叶缘焦枯,叶片卷曲。以正常植株为对照(CK)。对所有葡萄植株进行统一管理。
试验基地内随机选取I、Ⅱ、Ⅲ、Ⅳ级黄化植株和正常植株(CK)各5 株为试验材料,挂牌标记,于2018年7月测定各植株的光合作用参数,并采集叶片,立即用液氮处理后保存于-80 ℃下以备用。
1.5 测定项目与测定方法
1.5.1 土壤化学性质的测定
分别采集各黄化等级和正常植株(CK)下0 ~60 cm 的土壤样品,然后分别将I和Ⅱ级、Ⅲ和Ⅳ级的土壤样品混合均匀再进行风干处理,测定土壤样品的化学性质,土壤pH 值、全盐、有机质、速效氮、速效磷、速效钾、有效锰等营养元素均由宁夏回族自治区农产品质量监测中心检测。
1.5.2 叶绿素含量的测定
用乙醇-丙酮浸提比色法[11]测定叶绿素含量,各黄化等级重复测定3 次。
1.5.3 气体交换参数的测定
选择晴天的9:30—11:00 时,采用TPS-2 光合作用测定仪,分别选取以挂牌标记的正常植株(CK)及4 个等级的黄化植株,直接测定各植株叶片的净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci)等参数。各黄化等级重复测定5 次。
1.5.4 叶绿素荧光参数测定
选择晴天的9:30—11:00 时,将待测叶片暗适应15 min 以上,用Handy PEA 植物效率分析仪测定其叶绿素荧光参数。在630 nm 的红光、3 000 μmol·m-2s-1的光强下进行测量,记录时程为1 s,重复测定5 次。
利用配套软件对数据进行处理和分析。各荧光参数分别说明如下:Tfm表示暗适应后从照光至达到最大荧光所需的时间;Fo表示暗适应后的最小荧光强度,Fm表示暗适应后的最大荧光强度;Mo表示原初光化学反应速率;VJ表示在2 ms 时(J相)的相对可变荧光强度;Fv/Fm表示PSⅡ最大光化学效率;Fo/Fm表示热耗散量子比率;φEo表示用于电子传递量子比率;ψo表示原初光化学产额;ABS/RC 表示单位反应中心吸收的能量,即单位反应中心的能量(ABS)/热耗散的能量(RC)之值;TRo/RC 表示单位反应中心捕获的能量,即被反应中心捕获的能量(TRo)/热耗散的能量(RC)之值;ETo/RC 表示单位反应中心用于电子传递的能量,即被反应中心捕获的能量(ETo)/热耗散的能量(RC)之值;DIo/RC 表示单位反应中心热耗的能量,即单位反应中心吸收的能量(DIo)/热耗散的能量(RC)之值;PIABS(performance index of plants)表示以吸收光能为基础的性能指数,即吸收光能(ABS)/最大荧光(Fm)之值。相关参数的运算方法及生理意义参见相关研究文献[12-13]。
根据下列公式[12-14]可分别计算出相对可变荧光(Vt)、相对可变荧光之差(ΔVt)、可变荧光FV占(FJ-Fo)振幅的比例(Wt)、可变荧光FV占(FJ-Fo)振幅的比例之差(ΔWt)、可变荧光FV占(F300μs-F50μs)振幅的比例(Wk)、可 变 荧光FV占(F300μs-F50μs)振幅的比例之差(ΔWk):
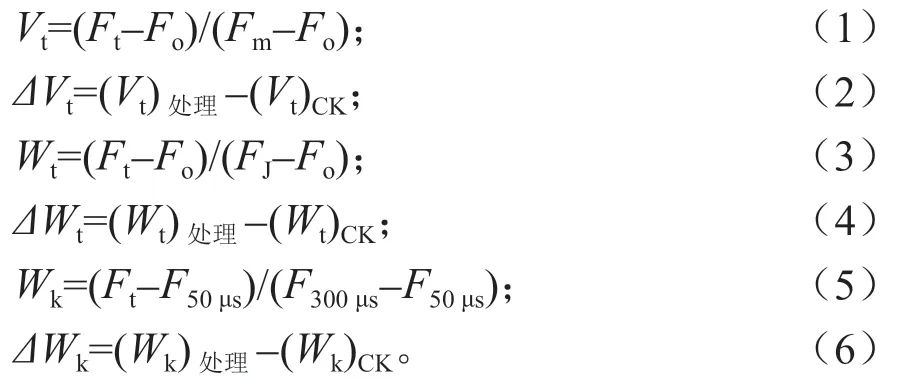
式(1)~(6)中:Ft表示荧光曲线任意时刻的荧光信号值,Fo表示在20 μs 时(O 相)的荧光信号值,FJ表示在2 ms 时(J 相)的荧光信号值,F50μs表示在50 μs 时的荧光信号值,F300μs表示在300 μs 时的荧光信号值;Ft、Fo、FJ和F50μs、F300μs的计量单位均为mV。
1.6 数据处理
采用Excel 2013 软件进行数据统计,采用IBM SPSS Statistics 23 软件进行数据分析,利用Origin 2017 Pro 软件绘图。
2 结果与分析
2.1 土壤化学性质分析
试验基地内0 ~60 cm 土壤的基本化学性质见表1。黄化葡萄地与对照葡萄地土壤中养分及微量元素的含量差异均显著。试验基地土壤pH 值>8.0,且土壤中有效铁、有效锰含量均低于临界值;黄化葡萄地土壤中有机质、速效氮、速效磷、有效铜、有效铁等养分及微量元素含量均显著低于对照葡萄地。
2.2 叶片黄化对‘赤霞珠’葡萄叶片光合色素的影响
叶片黄化可显著降低‘赤霞珠’葡萄叶片中叶绿素a、叶绿素b、类胡萝卜素的含量,并改变光系统反应中心色素的组成比例(表2)。随黄化程度的加深,叶绿素a、叶绿素b 和类胡萝卜素的含量均显著降低,I、Ⅱ、Ⅲ、Ⅳ级黄化叶片中的叶绿素总量较对照(CK)分别降低了63.91%、70.43%、73.91%、76.52%;与CK 相比,Ⅳ级黄化叶片中叶绿素a、叶绿素b 和类胡萝卜素的含量分别降低了76.77%、75.70%和64.47%,叶片黄化导致叶绿体受到一定程度损伤,影响了光合色素的合成,或导致光合色素降解;且I、Ⅱ、Ⅲ、Ⅳ级黄化叶片中的类胡萝卜素/叶绿素之值较CK分别增高了0.89%、11.76%、24.37%、50.42%,表明黄化叶片中的类胡萝卜素在色素组成中的比例有所增高。
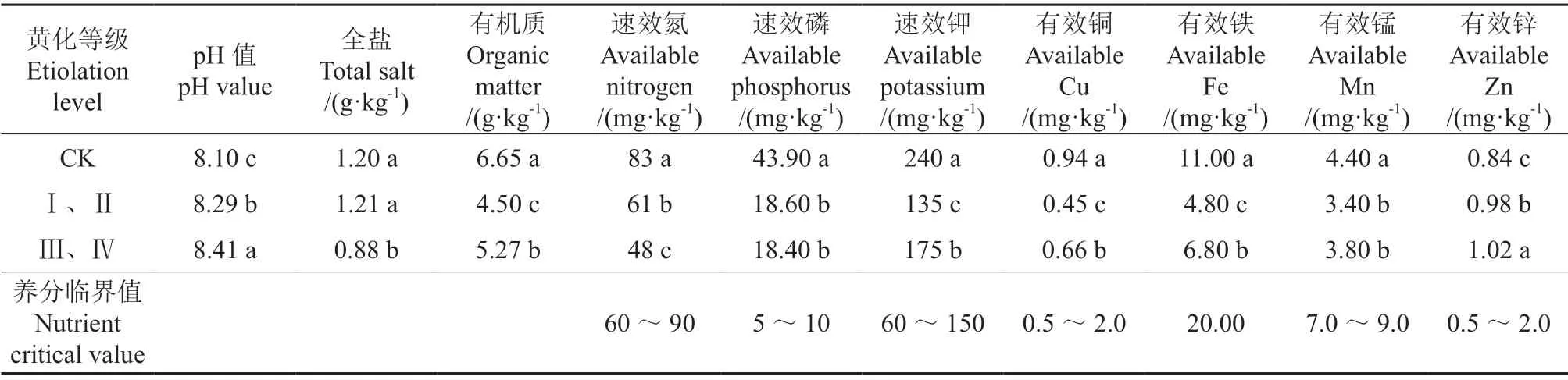
表1 供试土壤(0 ~60 cm)的基本化学性质†Table1 Basic physicochemical properties of the soil tested (0-60 cm)
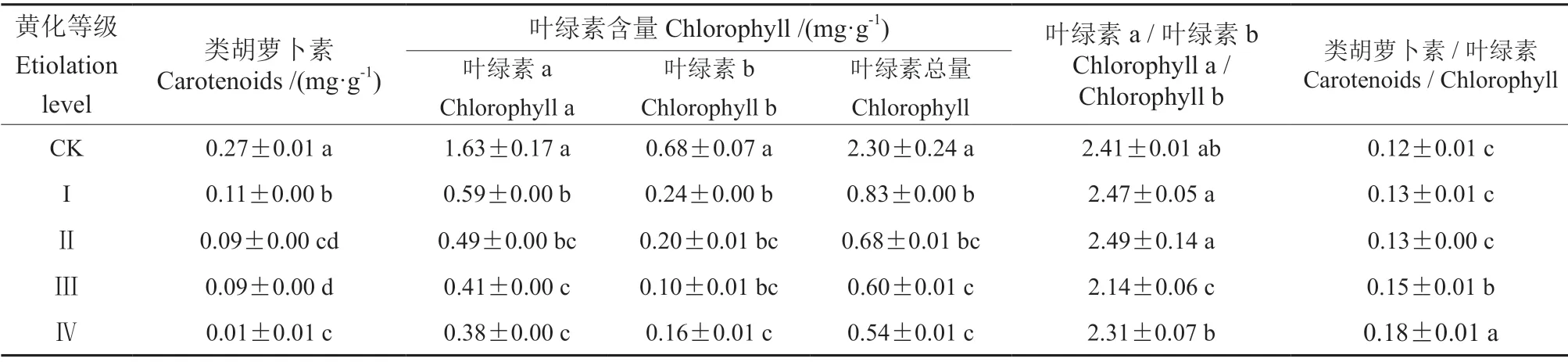
表2 ‘赤霞珠’葡萄正常和黄化叶片中光合色素的差异比较Table2 Comparative of photosynthetic pigments content between green and yellowish leaves of ‘Cabernet Sauvignon’ grape leaves
2.3 叶片黄化对‘赤霞珠’葡萄叶片气体交换参数的影响
叶片黄化对‘赤霞珠’葡萄叶片光合作用气体交换参数的影响结果如图1所示。叶片黄化迫使葡萄叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)均显著下降,与CK 相比,I、Ⅱ、Ⅲ、Ⅳ级黄化叶片的Pn分别显著下降42.64%、56.25%、70.16%、85.08%,I、Ⅱ、Ⅲ、Ⅳ级黄化叶片的Gs则分别显著下降了66.03%、68.01%、72.14%、76.16%,说明黄化可显著降低叶片的光合碳同化效率。
2.4 叶片黄化对‘赤霞珠’葡萄叶片叶绿素荧光动力学曲线的影响
黄化对‘赤霞珠’葡萄叶片快速叶绿素a 快相荧光动力学曲线的影响情况如图2所示。由图2A可知,黄化叶片的多相荧光由O—J—I—P 变为O—K—J—I—P;除Ⅲ级黄化叶片外,各黄化等级叶片的Fo值均增高,而其Fm值均降低,Ⅲ和Ⅳ级黄化叶片的荧光曲线在J、I、P 相的荧光强度均显著低于CK,说明PSⅡ电子传递已受到强烈抑制。由相对荧光变化曲线(图2B)可知,与CK 相比,叶片黄化可导致300 μs(K 点)、2 ms(J 点)、10 ms(H 点)和30 ms(I点)的相对荧光值均明显上升,说明PSⅡ反应中心电子供体侧的性能受到伤害,电子传递效率下降。分析黄化叶片在J 相前后的相对荧光变化特征(图2C)可发现,黄化叶片在100 ms(G 相)的相对荧光值显著下降,且出现明显的凹峰,随着黄化程度的加重,G 相凹陷越深,G 相是QB2-全部被还原为QBH2时的特征峰,G 相凹陷说明此处电子供应相对不足。在ΔWt曲线中,K 相出现凹峰,其凹陷程度随着黄化程度的加深而加大,说明其PSⅡ供体侧的电子供应不足。对原始荧光曲线10 ~300 μs 段的荧光值进行Fk-Fo标准化后绘制ΔWk曲线,结果如图2D 所示,不同黄化程度叶片ΔWk曲线中的Δ(L-band)均大于0,说明反应中心结构被破坏,其功能均受到了影响。
2.5 叶片黄化对‘赤霞珠’葡萄叶片叶绿素荧光动力学参数的影响
将叶绿素a 快相荧光动力学OJIP 曲线进行解析数学解析,获得的大量表征光合器官结构和电子传递性能参数如图3所示,解析结果反映了不同黄化等级下叶片的光合性能。将其中最具代表性的叶绿素荧光性能参数进行汇总,结果见表3。不同等级黄化叶片与CK 的叶绿素荧光诱导动力学曲线参数的差异均显著。随着黄化程度的加深,最大光化学效率(Fv/Fm)、反应中心密度(RC/CSm)、光合性能指数(PIABS)等参数均显著降低,说明叶片黄化抑制了葡萄叶片单位叶面积的总体光反应活性;与CK 相比,Ⅳ级黄化叶片的RC/CSm、Fv/Fm、PIABS值分别下降了89.64%、61.73%、99.74%。
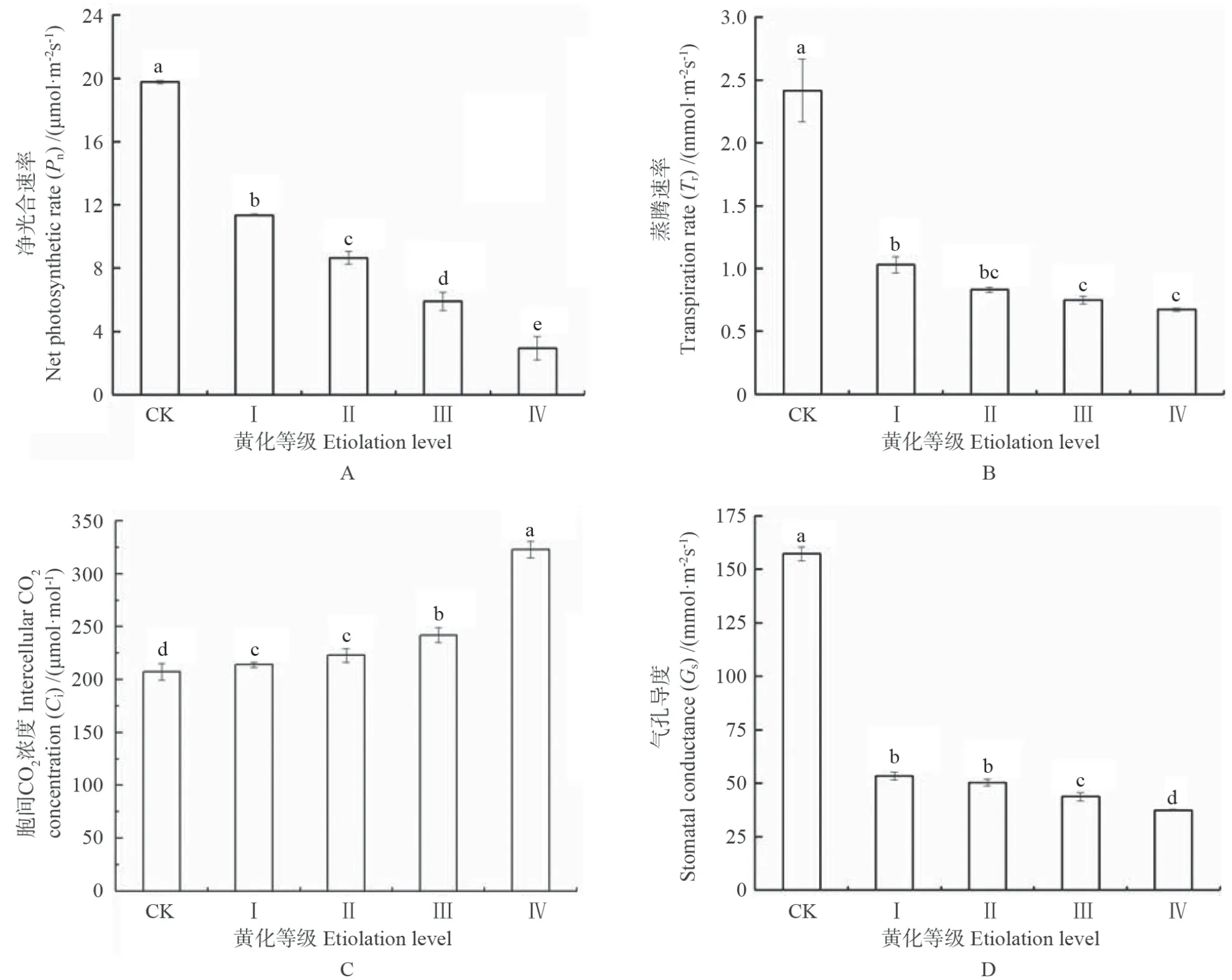
图1 黄化对‘赤霞珠’葡萄叶片光合作用气体交换参数的影响Fig.1 Effect of etiolation on photosynthetic gas exchange parameters of ‘Cabernet Sauvignon’ grape leaves
同时,黄化导致植株功能叶的原初光化学产额(ψo)、用于电子传递的量子产额(φEo)和PSI受体侧末端电子受体的量子产额(φRo)均显著降低,表明叶片黄化使得电子传递受到严重抑制,光反应活性及PSI的相对活性均显著下降;单位反应中心光能的吸收量(ABS/RC)、捕获量(TRo/RC)、消耗量(DIo/RC)随着黄化程度的加重均显著增加,单位反应中心捕获的用于电子传递的能量(ETo/RC)则显著降低,表明叶片光合器官的功能受到抑制,光合电子传递速率低下,较多能量被淬灭和还原为QA,PSⅡ最大光化学效率较低。
2.6 土壤化学指标与葡萄光合指标的相关性分析
土壤化学指标与葡萄叶片光合作用指标间的相关性分析结果见表4。土壤pH 值和有效锌含量与ψo、ETo/CSo、PIABS、RC/CSm、类胡萝卜素、叶绿素a、叶绿素b、Pn、Gs之间均呈显著负相关,说明土壤pH 值和有效锌含量的增加可降低葡萄叶片中叶绿素的含量,减弱光合作用;而土壤中速效氮、速效磷的含量与PIABS、类胡萝卜素、叶绿素a、叶绿素b、Gs之间均呈显著正相关,表明增加土壤中速效氮、速效磷的含量,即可增强其光合作用,缓解葡萄叶片的黄化问题。
2.7 ‘赤霞珠’葡萄叶片光合和叶绿素荧光参数的主成分分析
利用28 个常见的光合和叶绿素荧光参数进行主成分分析,第1 主成分(principal component 1,PC1)、第2 主成分(PC2)的累积方差贡献率为89.13%,这2 个主成分能够很好地反映原数据的变异信息。28 个常见的光合和叶绿素荧光参数在这2 个主成分的载荷图如图4A 所示,叶片光合色素、Pn及PIABS等部分叶绿素荧光参数均位于PC1的正向端,TRo/RC、Fo/Fm等参数均位于PC1 的负向端;φRo、叶绿素a/b、Fo等参数均位于PC2 的正向端,而Ci、类胡萝卜素/叶绿素等参数均位于PC2 的负向端。
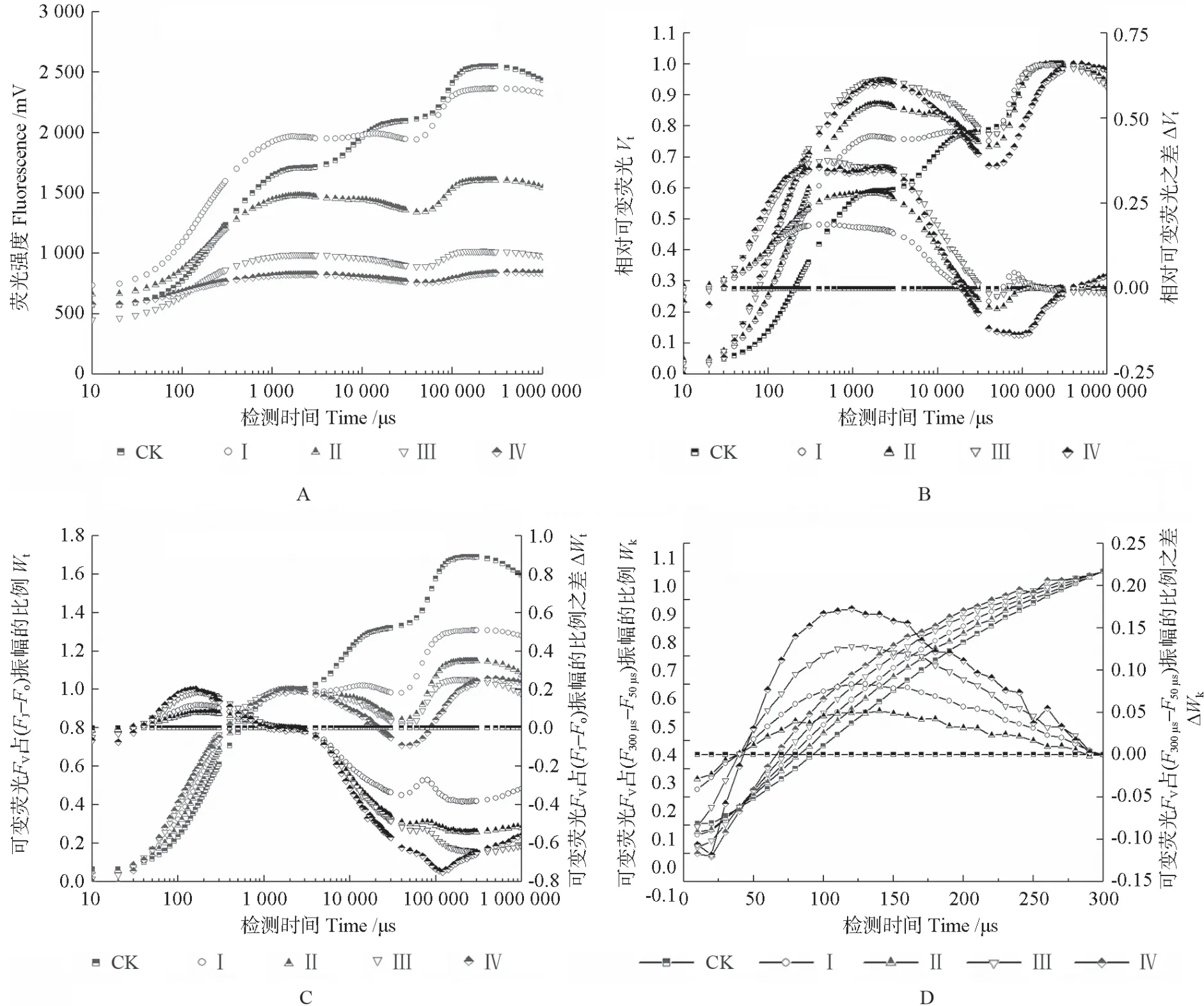
图2 黄化对‘赤霞珠’葡萄叶片快速叶绿素a 快相荧光动力学曲线的影响Fig.2 Effects of etiolation on fast chlorophyll a fluorescence curves of ‘Cabernet Sauvignon’ grape leaves
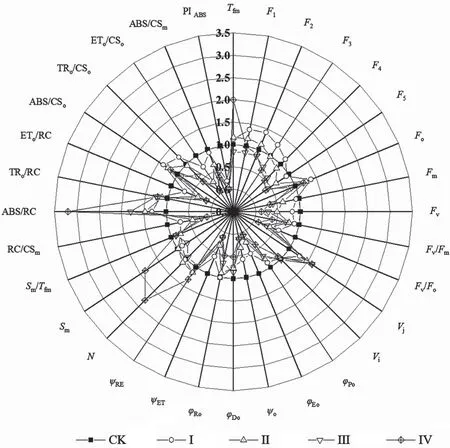
图3 不同黄化等级葡萄叶片叶绿素荧光参数的比较Fig.3 Comparison of parameters of chlorophyll fluorescence of grape leaves with different etiolation level
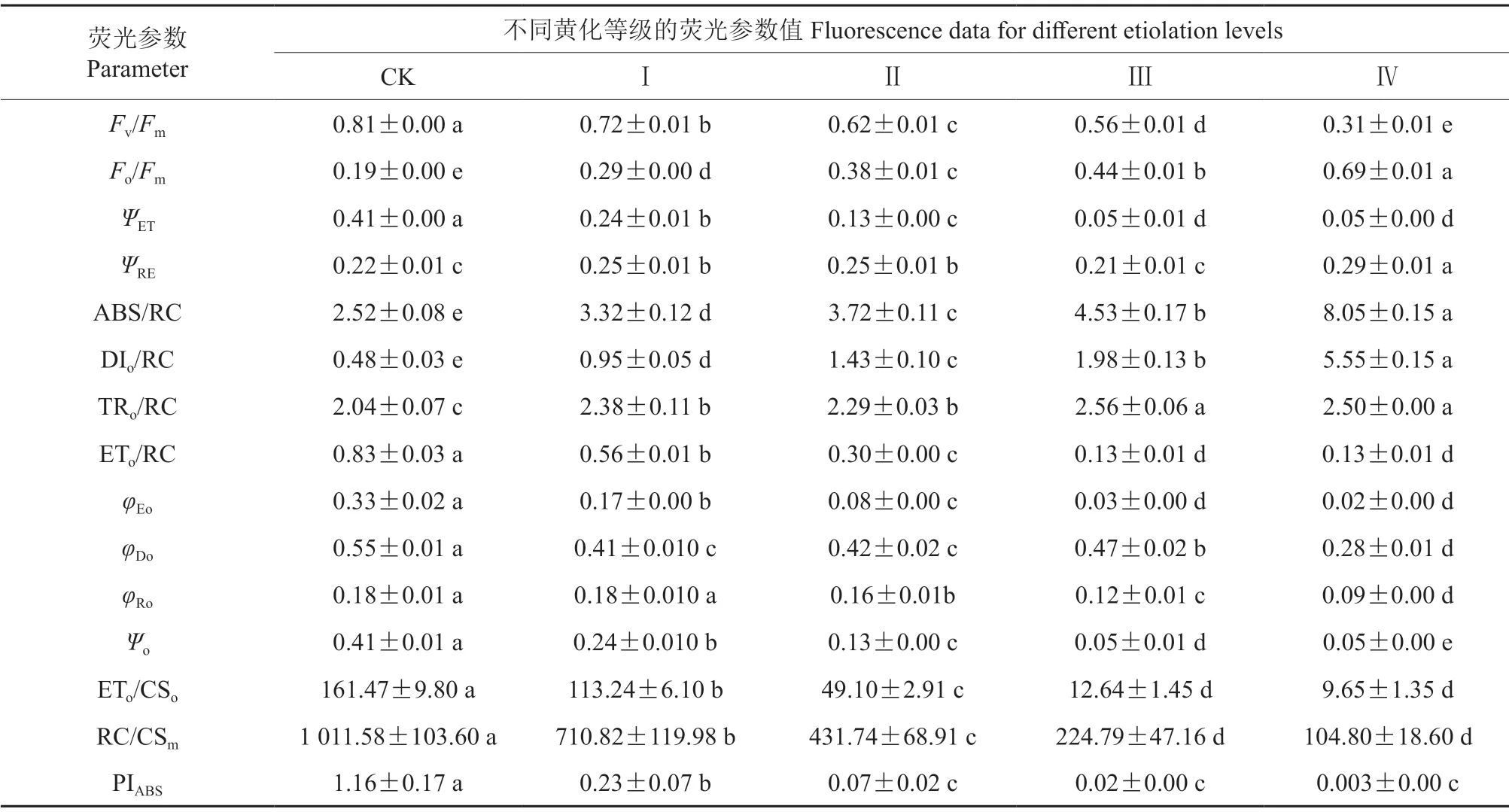
表3 黄化对‘赤霞珠’葡萄叶片叶绿素荧光性能参数的影响Table3 Effect of etiolation on chlorophyll fluorescence data of ‘Cabernet Sauvignon’ grape leaves
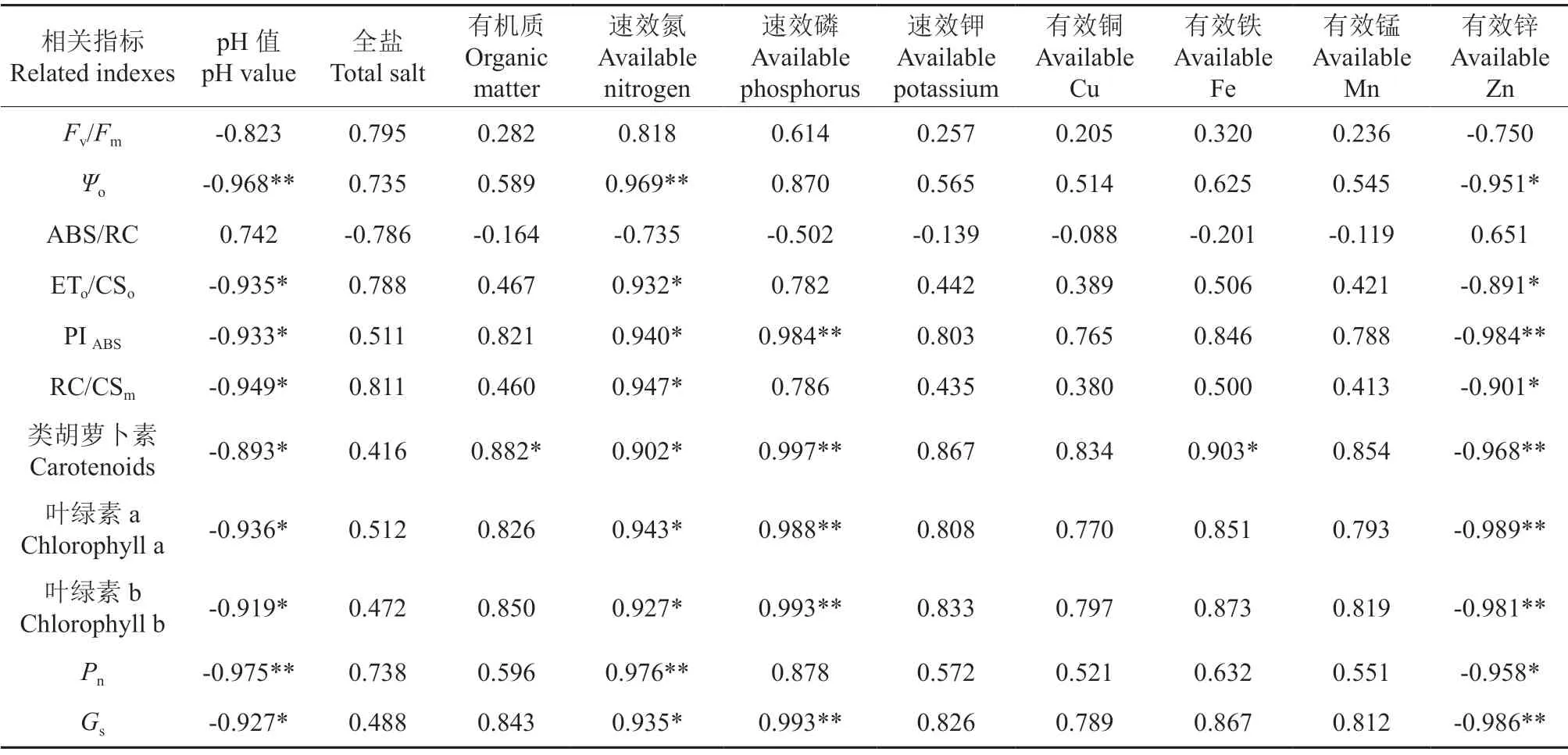
表4 土壤化学指标与葡萄叶片光合作用指标间的相关性分析结果†Table4 Correlation coefficients between chemical indices of soil and photosynthesis of grape leaves
图4B 表示经过降维后不同黄化程度叶片各参数在二维上的得分情况。CK 位于第1 象限,其光合色素含量较高,且叶片光合作用相关参数正常。4 个等级黄化叶片的各参数分别位于第2、第3 象限,说明其叶绿素a、叶绿素b 等光合色素含量及Pn等相关光合参数值均逐渐降低;其中,I级黄化叶片的各参数均位于第2 象限,说明其具有较高的Fo及叶绿素a/b 值;Ⅳ级黄化叶片的各参数均位于第3 象限,说明其DIo/RC、类胡萝卜素/叶绿素、ABS/RC 值均较高。
综上所述,正常植株(CK)具有较高的光合色素及光合速率,其光化学效率、光合电子传递速率、量子效率均正常;I、Ⅱ级黄化等级为一类,其叶绿素含量和叶绿素荧光参数均较低;Ⅲ、Ⅳ级黄化等级为一类,其ΨRE、DIo/RC 等叶绿素荧光参数值均较高,说明叶片受到强烈光抑制,其PSⅡ潜在的光化学效率、光合电子传递速率、量子效率均显著降低。
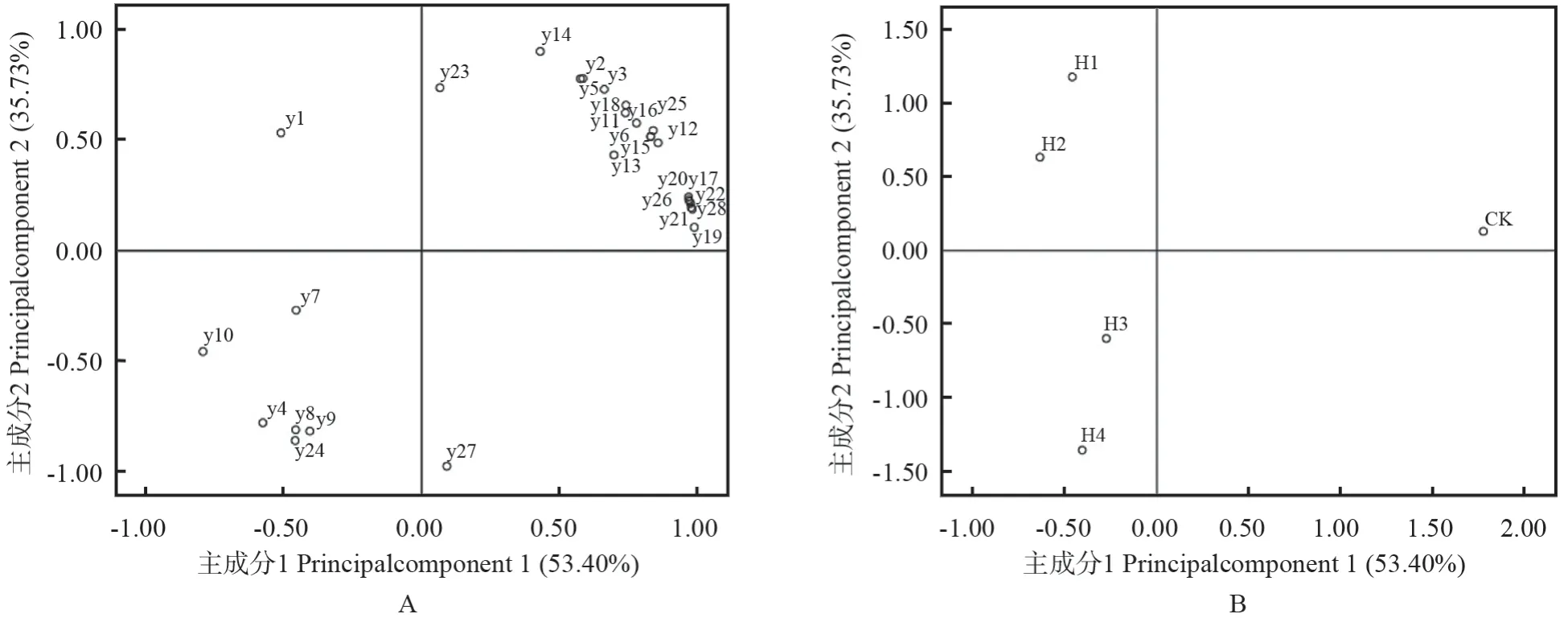
图4 不同等级黄化叶片各光合参数的主成分分析结果Fig.4 PCA result of photosynthesis index of grape leaves with different etiolation level
3 讨 论
3.1 土壤养分和微量元素含量分析
土壤pH 值与光合色素、光合作用相关参数间均呈显著负相关,且pH 值的增高可促使土壤中有效铁、有效镁等营养物质发生钝化,同时增加HC O3-的含量[15-16],不利于葡萄植株对养分的吸收;土壤中速效氮含量与叶片中叶绿素含量呈正相关,这与刘文国等[17]的研究结果一致;但黄化植株所处土壤中速效氮、速效磷、有效铜、有效铁等元素的含量均显著低于CK。土壤养分与植株养分、光合作用之间的关系复杂,本研究仅根据单因子之间的相关分析结果还不能完全解释上述复杂的关系,尚需借助其他方法解释更深层的相关性,以揭示试验地葡萄植株发生黄化现象的根本原因。
3.2 叶片黄化对‘赤霞珠’葡萄叶片光合色素和叶绿素荧光参数的影响
在植物的光合作用中,叶绿体色素作为主要色素,主要参与捕获光能并利用所收集的能量来分解水、驱动电子传输和产生化学物质[7,18],类胡萝卜素是光捕获信号复合体的主要成分,可保持叶绿素以及其他成分的平衡[7,19-20],而叶绿素a、叶绿素b 及类胡萝卜素在植物体内的合成、积累受到遗传因素和环境条件的共同影响[21]。随着黄化程度的加深,叶片中叶绿素a、叶绿素b 及类胡萝卜素的含量显著降低,同时叶片中的类胡萝卜素在色素组成中的比例随着黄化程度的加深而增高(表2),叶片黄化可能会导致叶绿体结构受损,或破坏叶绿素前体物质,进而影响光合色素的合成及降解[3]。叶绿素的含量与植株的光合作用之间呈正相关[22-23],其含量的降低会影响植株正常的光合作用。葡萄的光合作用参数对叶片黄化十分敏感,与CK 相比,叶片黄化迫使葡萄叶片的Pn、Gs和Tr均显著下降(图1),表明叶片黄化抑制了‘赤霞珠’葡萄的光合作用;且Gs伴随着Pn的降低而显著降低,其Ci却呈上升趋势,说明Pn的下降可能由于叶片叶肉细胞的光合能力降低、碳同化能力下降等非气孔因素所致[24]。
叶绿素荧光诱导技术是测定光合功能的灵敏探针,蕴含着丰富的光合信息[25]。PSⅡ的活性对于光合作用的维持具有重要功用,而其活性易受到电子供/受体侧性能的影响[26]。叶片黄化导致叶片出现明显的K 点,同时G 相出现明显的凹峰,且其随黄化程度的加深而加深(图2),表明PSⅡ反应中心电子供/受体侧的性能均受到叶片黄化的影响[25,27-29],Δ(L-band)>0,说明反应中心结构被破坏,其功能受到影响;叶片的Fo随黄化程度的加深而显著增加,且Fm、Fv均显著下降(图3),说明黄化导致葡萄叶片PSⅡ天线色素吸收的能量流向光化学的部分减少,而用于还原和热耗散的能量增加[30],黄化叶片受到光抑制,PSⅡ反应中心原初电子受体QA的还原能力降低,QA→QB的能力下降,电子传递活性降低[31],光化学效率显著降低,PSⅡ反应中心失活,PSⅡ潜在活性减弱而其原初光能转换效率减小[7];叶片的TRo/RC、DIo/RC 均显著增加,而φEo、ψET均显著降低,说明黄化导致葡萄叶片的光能向化学能转化速率和电子传递速率均减小,反应中心吸收和传递到的QA及QB能量均减少,PSⅡ受体侧受到严重破坏,使其电子传递能力大幅降低,使得放氧复合体的活性减弱,使其PSⅡ最大光化学效率降低[3]。黄化叶片的叶绿素合成受到阻碍,降低了PSⅡ的容量和运行水平,黄化叶片光能利用效率和Pn均显著降低[32-33]。
葡萄叶片黄化影响植株的生理特性、光合特性、内部组织结构等,本研究只关注了‘赤霞珠’葡萄在不同黄化程度下叶片的光合色素、光合作用气体交换参数及叶绿素荧光参数的变化特征,忽视了叶片黄化对葡萄生理特性等方面的影响情况,还存在一定的局限性。葡萄叶片黄化受多个因素的影响,探究并确定贺兰山东麓地区葡萄黄化病害发生的主要影响因素将是本研究后期努力的方向。
4 结 论
不同黄化等级葡萄叶片的主要光合色素、光合参数及荧光参数的测定结果表明,叶片黄化可导致葡萄叶片光合色素含量显著降低,黄化叶片的PSⅡ反应中心电子供/受体侧遭到破坏,叶片受到光抑制,导致叶片的光能利用效率及光合速率均显著降低,葡萄植株同化产物累积减少。本研究揭示了不同黄化程度的葡萄叶片叶绿素荧光参数的变化特征,进一步了解黄化对葡萄生理特性的危害和影响,可为了解葡萄叶片黄化机制及其诊断提供参考依据。

